99Tcm标记右旋糖苷衍生物DCM-1的淋巴结摄取和显像
李洪玉,梁积新,杨春慧,罗洪义,庄 玲,陈 阳,郑德强,鲁 佳,孙桂全
(1.中国原子能科学研究院 同位素研究所,北京 102413;2.原子高科股份有限公司,北京 102413;3.中国核工业北京四○一医院,北京 102413)
前哨淋巴结(SLN)是指接受淋巴引流的第一级淋巴结。当某原发癌发生淋巴结转移时,最先引起反应的就是SLN。由此可见,SLN的病理学特征可预测并反映该肿瘤的区域淋巴结转移状况,准确识别和定位SLN对病情监测和患者预后评估至关重要。
前哨淋巴结活检(Sentinel Lymph Node Biopsy,SLNB)是获取SLN并进行病理学检查的技术手段。用放射性核素显像法检测SLN是SLNB的常用方法之一[1],而SLN显像作为放射性核素定位法的一种有效手段,可以为SLNB提供SLN位置、数目及状态的重要信息。SLN显像的成功率很大程度上取决于所采用放射性药物的种类。一种理想的SLN放射性药物应具有如下性质:纳米颗粒且大小均匀;在正常或癌变的SLN中的摄取率高并且滞留时间较长;可从注射点快速清除;较少发生向下一级淋巴结的迁移。目前临床上最常用的SLN显像剂是胶体类药物,如99Tcm-硫胶体、99Tcm-硫化锑、99Tcm-硫化铼,以及其他大分子药物,如99Tcm-人血清白蛋白、99Tcm-右旋糖苷等[2]。然而,这些药物都是非特异性的,主要靠主动扩散作用向淋巴管路转移,药物颗粒最终靠淋巴巨噬细胞的吞噬作用被淋巴结摄取,存在示踪剂颗粒大小不均、注射后至显像的时间间隔不易确定、注射点浓集较高、随时间延长向下一级淋巴结迁移等缺点。
最近的研究[3]表明,甘露糖对淋巴巨噬细胞表面的受体具有亲和作用,99Tcm标记的甘露糖基化右旋糖苷类大分子化合物,由于具有受体结合性质且分子大小较为确定,因而在SLN显像方面体现出较强的应用价值。LymphoseekTM(99Tcm-DTPA-甘露糖基化右旋糖苷)[4]即为近年开发出来的SLN显像剂,目前在国外已进入三期临床研究。Lymphoseek选择了DTPA作为99Tcm的螯合基团,而99Tcm-DTPA配合物仅在大量DTPA配体和过量亚锡离子的存在下才是稳定的,且其化学结构始终存在不确定性,因此,仍有必要研究一种化学结构确定,稳定性和靶向性兼备的SLN药物。
DCM(Dextran-S-Cysteine-Mannose)是指一类连接有半胱氨酸的甘露糖基化右旋糖苷衍生物,化学结构示于图1,其分子通过巯基的硫原子连接了半胱氨酸,S-半胱氨酸基团的氨基可耦联甘露糖基;另一方面,未连接甘露糖基的S-半胱氨酸基团可作为SNO三齿配体与[99Tcm(CO)3(H2O)3]+螯合。通过这种分子设计,DCM类化合物无需连接其他双功能螯合剂,可直接进行99Tcm的标记[5]。
相关的生物分布实验和显像研究表明,该类锝标记的DCM配合物与未连接甘露糖基的DC(Dextran-S-Cysteine)配合物相比较,在SLN的摄取大大提高,体现出了受体结合的特点,但注射剂量是关键因素[6-7]。
本研究用羰基锝标记了DCM-1,得到99Tcm-(CO)3-DCM-1,并进行正常鼠淋巴结中的分布和显像研究,重点考察不同注射剂量的99Tcm-(CO)3-DCM-1对正常鼠淋巴结摄取及体内分布的影响。
1 实验材料
1.1 主要仪器
99Mo-99Tcm发生器:原子高科股份有限公司产品;FH463A自动定标器、FT-603型闪烁探头:北京核仪器厂;CRC15R放射性活度计:美国CAPINTEC公司;微量注射器:美国 Hamilton公司;高效液相系统:ProStar 210型,美国Varian公司;HPLC放射性检测器:德国Raytest公司;Milli-Q高纯水制备系统:美国MILLIPORE公司。

图1 右旋糖苷衍生物DCM-1的化学结构Fig.1 The structure of dextran mannose conjugates: DCM-1
1.2 主要试剂
Isolink药盒:由Mallinckrodt-Tyco公司生产并赠送;右旋糖苷衍生物DCM-1:希腊放射性核素和放射性显像产品研究所的Ioannis Pirmettis博士合成,法国Roberto Pasqualini博士提供;专利蓝溶液(2.5%):Roberto Pasqualini博士提供;其他试剂均为国产分析纯,实验用水均为二次去离子水。
1.3 实验动物
Balb/C小白鼠:随机分组,每组5只,雌雄兼用,18~22 g;Wistar大鼠:随机分组,每组3只,雌雄兼用,180~220 g;动物均为清洁级,由中国医学科学院实验动物研究所提供。
2 实验方法
2.1 [99Tcm(CO)3(H2O)3]+ 的制备
向Isolink药盒中加入1 mL新鲜的 Na99TcmO4洗脱液(37~370 MBq),于95 ℃反应25~30 min,间歇振荡,反应结束后,冷却到室温,用 PBS-HCl缓冲液(0.64 mol/L,pH为2.5)调节pH为7.5~8.5。
2.2 DCM-1的99Tcm标记[5]
将1 mL [99Tcm(CO)3(H2O)3]+溶液 (37~370 MBq)加入到含有400 μg DCM-1冻干品的瓶中,于75 ℃反应30 min,冷却,即得标记化合物99Tcm-(CO)3-DCM-1。
2.3 99Tcm-(CO)3-DCM-1的放化纯度测定
采用高效液相色谱法(HPLC)分析测定标记物的放化纯度,HPLC分析条件:C-18色谱柱(Hypersil ODS2,4.6 mm×250 mm),紫外检测器波长为254 nm,流速为1 mL/ min。淋洗液组成:流动相A : 0.1%TFA/H2O,B: 0.1%TFA/MeOH;淋洗梯度:0~4 min,0~0%B;4~6 min,0~25%B;6~17 min,25%~100%B;17~25 min,100%B;25~30 min,100%~0B;30~35 min,0B。
总体上说,在公路桥梁建设过程中,预应力的使用是一项长期且复杂的工程,技术要求高,每个环节都要求精准把握,因此,针对这项技术的实际应用,需要根据项目的实际特点,采用正确的方式进行。不断提高施工作业的精度和准度,提升施工工艺,保障各项施工工艺始终符合行业标准和具体施工需求。从而全面提高预应力在我国公路桥梁中的具体作用。
2.4 99Tcm-(CO)3-DCM-1的稳定性
将标记溶液用生理盐水稀释80倍,于室温下静置5 h,用HPLC分析放化纯度,考察其体外稳定性。将99Tcm-(CO)3-DCM-1由小鼠脚垫皮下注射,1 h后取尿液离心后取上层澄清液进行HPLC分析,考察其体内稳定性。
2.5 99Tcm-(CO)3-DCM-1在正常鼠体内的生物分布
取健康Balb/C小鼠,随机分组,每组5只;Wistar大鼠,随机分组,每组3只。标记物用生理盐水稀释,经正常鼠的右后足脚垫进行皮下注射,注射液放射性浓度为3~37 GBq/L。注射后按摩脚掌30 s以利于药物吸收,分别于处死前10 min在给药同侧的脚垫处皮下注入专利蓝溶液,再按摩脚掌30 s。给药后1、4 h处死动物,取SLN(即腘窝淋巴结,popliteal lymph node)、次级淋巴结(即腰淋巴结,2LN)、注射点(即右后足,injection site)、肝、脾、血等,肝、脾、血称重,测量各器官或组织的放射性计数,计算放射性摄取率(SLN、2LN、注射点单位为%ID,肝、脾、血的单位为%ID·g-1),并计算SLN提取率(popliteal extraction rate,PE%),公式如下:
PE%=[(SLN摄取率-2LN摄取率)/SLN摄取率]×100%
PE%体现了药物在SLN滞留的比率,该值越大,说明药物在SLN的滞留越强,向下一级淋巴结迁移的可能性越小。
2.6 正常大鼠体内的淋巴结显像
取Wistar大鼠,每3只一组,每只右后足脚垫皮下注射不同剂量的标记物,分别在注射后不同时间点进行显像,显像前10 min经腹腔注射0.8 mL 10%水合氯醛溶液对大鼠进行麻醉。显像数据在计算机系统128×128矩阵中进行记录与分析,放大倍数:1,采集计数:50 K/只。
3 结果与讨论
3.1 99Tcm-(CO)3-DCM-1的制备及稳定性
将99Tcm-(CO)3-DCM-1溶液用生理盐水稀释80倍,于室温下静置5 h,放化纯度仍>90%,说明99Tcm-(CO)3-DCM-1体外稳定性较好。给药后1 h,尿液的HPLC分析图谱示于图2d,结果显示,主峰保留时间未变,99Tcm-(CO)3-DCM-1在小鼠体内未发生分解。
3.2 99Tcm-(CO)3-DCM-1在正常鼠体内的生物分布
将99Tcm-(CO)3-DCM-1分别以每25 μL 2 μg、每5 μL 2 μg、每5 μL 0.2 μg、每5 μL 0.05 μg和每5 μL 0.005 μg剂量注入Balb/C小白鼠体内,99Tcm-(CO)3-DCM-1在Balb/C小白鼠体内的生物分布结果列于表1。
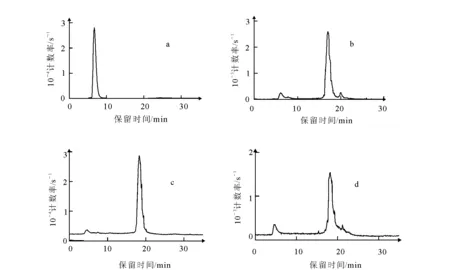
a——[99Tcm (CO)3(H2O)3]+ ;b——99Tcm-(CO)3-DCM-1;c——99Tcm-(CO)3-DCM-1稀释80倍;d——99Tcm-(CO)3-DCM-1小鼠代谢的尿样品图2 各种样品的HPLC图 a——[99Tcm (CO)3(H2O)3]+ ;b——99Tcm-(CO)3-DCM-1;c——99Tcm-(CO)3-DCM-1 (80 times dilution);d——the mice’s urine sample of 99Tcm-(CO)3-DCM-1 metabolismFig.2 Radio-HPLC profiles of the samples

注射后时间组织或器官Balb/C小鼠体内的放射性摄取率2 μg(25 μL)2 μg(5 μL)0.2 μg(5 μL)0.05 μg(5 μL)0.005 μg(5 μL)SLN3.18±0.186.12±0.764.34±1.436.47±1.456.37±0.862LN2.16±0.414.88±1.521.75±0.670.22±0.140.54±0.09注射点30.68±8.3340.51±8.6116.73±1.1854.23±2.2476.65±4.141 h肝23.34±3.5029.02±3.004.05±0.891.34±0.272.61±0.34脾13.82±3.621.79±0.320.12±0.090.23±0.130.16±0.07血2.93±0.442.23±0.530.01±0.000.04±0.041.09±0.13SLN提取率PE%32.120.359.796.691.5SLN3.47±1.027.69±1.575.19±1.474.32±0.917.08±0.802LN2.07±0.474.51±1.070.78±0.450.20±0.090.69±0.37注射点36.09±3.0934.90±3.0821.41±1.6544.58±3.2670.29±3.244 h肝21.60±3.2936.65±2.384.58±0.551.17±0.413.24±0.14脾15.41±3.482.82±0.430.16±0.070.25±0.280.21±0.03血1.27±0.071.33±1.510.00±0.010.04±0.061.06±0.14SLN提取率PE%40.341.485.095.490.3
注:SLN、2LN、注射点摄取率的单位为%ID;肝、脾、血摄取率的单位为%ID·g-1
由表1可见,注射剂量,包括注射化学量和注射体积,对99Tcm-(CO)3-DCM-1在Balb/C小白鼠体内的SLN摄取具有显著影响。当注射药物化学量保持不变,而注射体积由25 μL 减少到5 μL时,SLN 的摄取几乎增加了一倍,注射后1 h从3.18%增至6.12%,注射后4 h从3.47%增至7.69%,存在显著差异(P<0.001)。当注射体积保持不变,而注射药物化学量由2 μg减少到0.05 μg时,SLN 的摄取也会提高,同时2LN的摄取减少到只有0.22%,相应的SLN提取率PE%从20%~40% 增长到90%以上,说明向次级淋巴结的迁移随注入化学量的减少而减少。然而,实验结果也表明,注射剂量并不是越低越好,当注射剂量减少到每5 μL 0.005 μg时,SLN摄取率和提取率PE%均出现下滑,而注射点的滞留却明显增加。当注射剂量相对较小时,如每5 μL 0.05 μg时,生物分布较理想,SLN摄取较高,而其他组织或器官(除注射点)摄取较低。
另外,分别以每30 μL 0.05 μg和每5 μL 0.05 μg的剂量注入Wistar大鼠体内,得到99Tcm-(CO)3-DCM-1在Wistar大鼠体内的生物分布结果列于表2。
在Wistar大鼠生物分布实验中得到了与小鼠相似的实验结果,注射剂量减少时,SLN的摄取增加,如表2所示,注射化学量为0.05 μg、注射体积30 μL时,SLN的摄取率达到15%~17%,当注射体积由30 μL 减少到5 μL(注射化学量相同)时,SLN的摄取率几乎增加一倍,达到30%~32%,而且药物向下一级次淋巴结的迁移较小,PE%均在95%左右,但不得不注意到,仍有约50%的药物滞留在注射点。注射剂量0.05 μg(30 μL)和0.05 μg(5 μL)时所得数据经对照,具有统计学意义(P<0.01),差异显著。
以前的研究表明,注射剂量是影响前哨淋巴结显像药物生物分布的关键因素,并应在可行的前提下尽量降低注射体积[8]。注射体积增大,会降低淋巴结对药物的摄取;而减少注射化学量,会降低肝和血液中的摄取并减少药物向下一级淋巴结的迁移。适量降低注射剂量有利于提高SLN的摄取率和2LN提取率,但也并不是越低越好,降低注射剂量,意味着要对药物进行大量稀释,有可能造成药物分子相互聚集,形成聚合大分子而滞留在注射点,因此需要进行综合考虑,从而确定最佳注射剂量。
表2 99Tcm-(CO)3-DCM-1在Wistar大鼠体内的生物分布
注:SLN、2LN、注射点摄取率的单位为%ID;肝、脾、血摄取率的单位为%ID·g-1
3.3 Wistar大鼠的淋巴结显像
99Tcm-(CO)3-DCM-1分别以剂量a:0.5 μg每50 μL(2.1×106Bq)和剂量b:1.0 μg每50 μL(4.1×106Bq)的注射剂量注射Wistar大鼠,进行显像,显像结果示于图3。
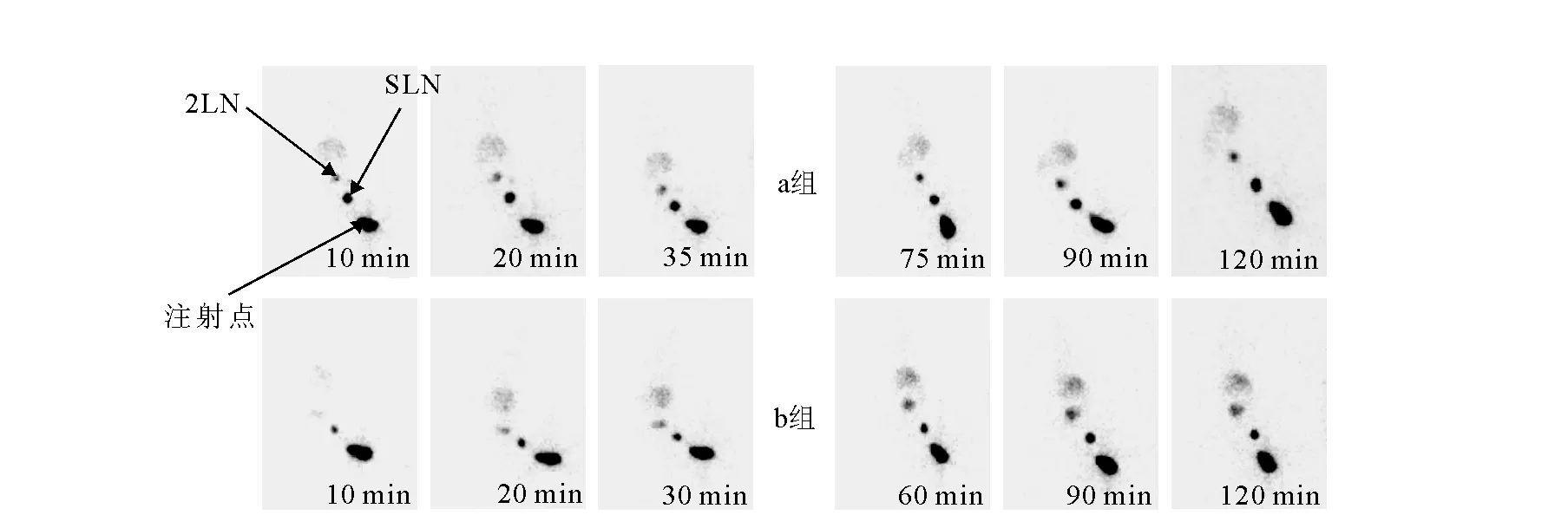
a组——0.5 μg(50 μL);b组——1.0 μg(50 μL)图3 99Tcm-(CO)3-DCM-1在Wistar大鼠体内显像图Fig.3 SPECT images pictures of 99Tcm-(CO)3-DCM-1 in Wistar rats
由图3可以看出,显像与生物分布的结果一致,99Tcm-(CO)3-DCM-1具有较高的SLN摄取,注药后10 min,SLN即已显影,随后各个时间点,SLN显像均非常清晰;虽然在注射点仍有较强滞留,但并不影响对SLN的观察;而随时间延长,可看到有小部分放射性向2LN迁移,膀胱与2LN显影会发生重叠,但即使给药2 h后,仍未见放射性向第三淋巴结的转移;全身放射性本底较低,可见肝区轻微显影。当注射化学量从0.5 μg增加到1.0 μg时,SLN摄取有所下降,肝区显影略加重。
4 结 论
用[99Tcm(CO)3(H2O)3]+标记甘露糖基化的右旋糖苷衍生物DCM-1,标记过程简单,标记率大于90%。99Tcm-(CO)3-DCM-1在SLN的摄取较高,在大鼠的分布实验中,SLN的摄取达30%以上,显像实验可见SLN清晰显影;向下一级淋巴结的迁移较少,PE%最高可达97.7%。淋巴结摄取对注射剂量很敏感,当注射剂量减少时,SLN的摄取率和PE%都相应提高。结果表明,99Tcm-(CO)3-DCM-1具有较高的前哨淋巴结摄取及优良的体内分布性质,具备应用于前哨淋巴结显像的潜在价值,值得进一步的研究。
参考文献:
[1] 王雪鹃,张岩,李艳,等.前哨淋巴结显像剂99Tcm-rituximab体外特性和安全限度的实验研究[J].同位素,2011,24(增刊):90-94.
Wang Xuejuan, Zhang Yan, Li Yan,et al. Experimental Study of Biological Property and Safety Limitation of Sentinel Lymph Node Imaging Agent99Tcm-rituximab[J]. Journal of Isotopes,2011, 24 (z): 90-94(in Chinese).
[2] Wilhelm AJ, Mijnhout GS, Franssen EJ. Radiopharmaceuticals in sentinel lymph-node detection an overview[J]. Eur J Nucl Med, 1999, 26: S36-S42.
[3] 杨春慧,李洪玉,梁积新,等.99Tcm标记右旋糖苷衍生物的制备及其生物分布[J].同位素,2012,25(3):149-154.
Yang Chunhui, LI Hongyu, LIANG Jixin, et al. Preparation and Biodistribution Study of99TcmLabelled Dextran Conjugates[J]. Journal of Isotopes, 2012, 25(3):149-154(in Chinese).
[4] Wallace AM, Hoh CK, Darrah DD, et al. Sentinel lymph node mapping of breast cancer via intradermal administration of Lymphoseek[J]. Nucl Med Biol, 2007, 34: 849-853.
[5] Pirmettis I, Arano Y, Tsotakos T, et al. New(99m)Tc(CO)(3)Mannosylated Dextran Bearing S-Derivatized Cysteine Chelator for Sentinel Lymph Node Detection[J]. Mol Pharm, 2012, 9(6):1 681-92.
[6] Kyoko T, Tomoya U, Emi K, et al.99mTc-labeled mannosyl-neoglycoalbumin for sentinel lymph node identification[J]. Nucl Med Biol, 2004, 31(7): 893-900.
[7] Eutimio GF, Erica AO, Natanael GS, et al. Combining dose and injection volume for good performance of a specific radiopharmaceutical for sentinel node detection[J]. Nucl Med Biol, 2012, 39(1):145-153.
[8] 李洪玉,梁积新,罗洪义,等.99Tcm-硫化铼胶体用于前哨淋巴结检测的生物实验――注射剂量与明胶浓度的影响[J].同位素,2011,24(2):72-76.
Li Hongyu, Lian Jixin, Luo Hongyi, et al. Biodistribution of99TcmLabelled Colloidal Rhenium Sulphide for Sentinel Node Detection:the Effects of Dosage and Concentration of Gelatin[J].2011,24(2): 72-76(in Chinese).

