人β-防御素2联合乙肝疫苗对小鼠免疫效应的研究①
曾文兴 苏 虹 王美珍 刘玉琳 王福财 胡有长 江丽霞 施桥发 (南昌大学医学院,南昌330006)
乙型肝炎是乙型肝炎病毒(HBV)感染引起最常见的全球性肝脏疾病[1]。据估计,全世界有20亿人已感染乙型肝炎病毒(HBV),其中3.6亿存在慢性感染、肝硬化、肝癌或并发其他严重疾病或死亡的风险。几十年来以明矾为佐剂的乙肝疫苗接种在防治乙肝病毒感染中发挥了重要作用。但有报道称在一些尿毒症和其他免疫缺陷疾病等免疫功能抑制患者中,由于保护性机制存在不足,导致铝佐剂的佐剂作用效应不明显,不能诱导有效的保护性免疫应答,使疫苗接种成功率降低[2]。因此,科学界一直在努力寻找更有效的疫苗佐剂来增强乙肝疫苗免疫效果。
防御素是一类富含半胱氨酸的内源性抗菌肽,它的分子结构稳定且具有广泛的抗细菌、真菌和部分病毒的作用[3-8]。按照分子结构特征及来源不同,动物防御素可分为 α-防御素、β-防御素和 θ-防御素 3 种[9,10]。最近研究表明,防御素-2(BD2)是防御素家族的重要成员,被认为是联系先天免疫和获得性免疫的桥梁。许多研究都表明人β-防御素2具有细胞趋化的活性[11,12],通过 CCR6趋化记忆 T细胞和未成熟树突状细胞,并可以促进树突状细胞成熟[13-16],加强抗原递呈作用,从而加强机体免疫应答。本研究中我们采用含 HBD2基因的质粒pEGF-C1/HBD2联合乙肝疫苗免疫小鼠,观察HBD2增强乙肝疫苗免疫效果的作用。
1 材料与方法
1.1 材料
1.1.1 动物与试剂 BALB/c小鼠(雌性,6~8周龄,每只18~22克,SPF级),华中科技大学同济医学院动物中心提供;CD8-FITC/CD4-PE/CD3-PerCP,购自BD公司;重组乙型肝炎疫苗,每支1.0 ml(20 μg/ml),北京天坛生物制品股份有限公司;无内毒素质粒大量试剂盒购自天根生物技术公司。乙肝表面抗体诊断试剂盒购自英科新创科技有限公司。
1.1.2 仪器 酶标仪(model 3550,Biorad公司);CO2恒温培养箱(Napco公司,法国);ELX-800型流式细胞仪(BD公司,美国);低温离心机(科大创新KDC-2046)。
1.2 方法
1.2.1 无内毒素质粒大量抽提 抽提步骤参照天根公司试剂盒操作手册进行质粒抽提。其主要步骤如下:收集菌液,离心并收集细菌沉淀;加入溶液P1重悬细菌,加入溶液P2,室温放置5分钟,加入溶液P3,立即混匀,室温放置5分钟后离心,将离心后得到的上清液加入到吸附柱AC中离心,弃废液;向AC柱中加入E-WB,离心弃废液,加入洗液WB,离心弃废液,取出吸附柱AC,放到一个干净离心管中,在吸附膜中加入EB缓冲液将其重新溶解后离心收集滤液。通过分光光度计测量质粒的OD值,计算纯度和浓度。
1.2.2 实验动物和免疫接种及采血 4~6周龄BALB/c小鼠随机分成4组,每组10只,在小鼠股四头肌注射小鼠,分别在第二周和第四周加强免疫1次。小鼠分组及免疫计量如下:第一组:PBS组免疫PBS 200 μl,第二组免疫2 μg乙肝疫苗,第三组将2 μg乙肝疫苗联合100 μg pEGF-C1质粒混合后免疫,第四组:100 μg pEGF-C1/HBD2质粒联合2 μg乙肝疫苗混合后免疫,保证每只免疫小鼠200 μl等体积,在第三次免疫后两周眼眶采血,离心收集血清。
1.2.3 小鼠血清乙肝表面抗体检测 用ELISA检测试剂盒通过酶标仪检测小鼠血清中总乙肝表面抗体OD值:在预包被的96孔板中分别加入稀释的血清50 μl;另设一组空白对照。然后加入酶标试剂50 μl,混匀,37℃温育1小时;洗涤6次,每孔加入显色剂A、B各50 μl;轻轻振荡,37℃避光显色20分钟;每孔加入终止液50 μl,混匀,酶标仪检测450 nm处OD值。
1.2.4 淋巴细胞增殖试验 免疫后的小鼠脾脏制备成单个细胞悬液,用10%小牛血清含双抗1640调整细胞浓度为2×106ml-1,取96孔板,每孔加入100 μl细胞悬液,分别加入刺激物 ConA 5 μg/ml,乙肝疫苗0.2 μg/ml和1640作为控制组。一式三份,每孔终体积为200 μl,另设调零孔。培养板放于37℃ 5%CO2培养箱培养72小时,在结束前4小时,每孔加入20 μl CCK8继续培养4小时,培养结束后,用酶标仪检测每孔A450OD值。
1.2.5 脾细胞指数检测 第三次免疫后两周,称量小鼠体重,颈椎脱臼处死小鼠,无菌取脾脏,并称各小鼠脾重,按公式计算脾脏指数。
1.2.6 流式细胞术检测CD3+/CD4+T细胞与CD3+/CD8+T细胞数值与比例 将脾制成单个细胞悬液后用PBS调整细胞浓度,将购买的荧光抗体CD3∶CD8∶CD4=2∶2∶1 体积比例混合后,按每 100 μl单个核细胞悬液(浓度107个/ml)中加入10 μl混合抗体,充分混匀后,室温避光孵育30分钟。用PBS 300 μl重悬,经流式细胞仪检测,以不加抗体的细胞为背景对照,以CD3分子设门,进一步检测CD4+和CD8+T淋巴细胞百分率。
1.3 统计学分析 所有数据采用SPSS19软件进行处理。检验前各组数据进行正态性检验和方差齐性检验,非正态分布数据经数据转换成为正态分布数据后再进行方差分析,对方差分析结果有统计学意义的各组采用SNK法进行两两比较。P<0.05为差异有统计学意义。
2 结果
2.1 人β-防御素2对小鼠HBsAb的影响 采用双抗原夹心ELISA法对免疫三次后各组小鼠血清中HBsAb水平进行检测,结果显示乙肝疫苗联合pEGF-C1/HBD2质粒免疫组抗体水平最高,且明显高于乙肝疫苗联合pEGFP-C1质粒免疫组和PBS对照组(P<0.05),但与乙肝疫苗组相比增高不明显(P>0.05),说明人β-防御素2可能具有增强小鼠对乙肝疫苗体液免疫应答的功能。结果见表1、图1。
2.2 细胞体外增殖反应 采用CCK8试剂盒通过酶标仪检测OD450值,观察各实验组细胞增殖情况。结果在分别以PBS、ConA和HBsAg等3种不同物质为体外试验刺激物的试验中,均观察到乙肝疫苗联合pEGF-C1/HBD2免疫组小鼠脾淋巴细胞增殖能力比其它免疫组小鼠明显增强(P<0.05),且乙肝疫苗免疫组小鼠脾淋巴细胞增殖能力比PBS组和乙肝疫苗联合pEGF-C1免疫组强(P<0.05)。在同一免疫组内,不同体外刺激物作用下的各个小组之间,ConA与乙肝疫苗对细胞的刺激增殖作用都比Control强(P<0.05),结果见表2。
表1 不同免疫组小鼠血清HBsAb OD450值(±s,n=5)Tab.1 OD450 values of the mouse serum HBsAb(±s,n=5)
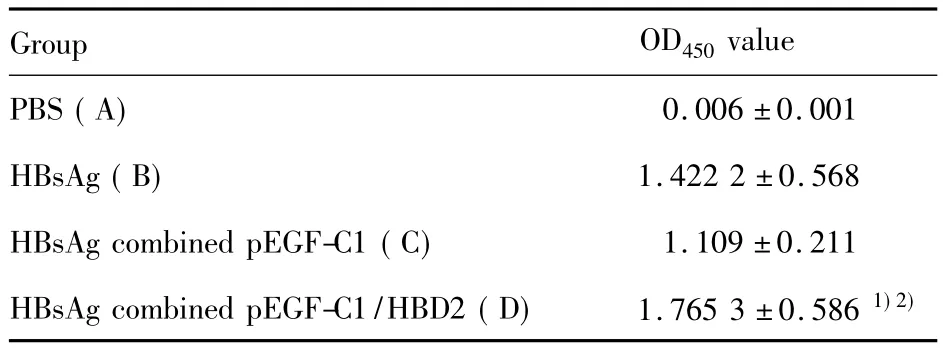
表1 不同免疫组小鼠血清HBsAb OD450值(±s,n=5)Tab.1 OD450 values of the mouse serum HBsAb(±s,n=5)
Note:A,B,C and D indicate the mice groups immunized with PBS,HB-sAg vaccine,HBsAg vaccine combined with pEGF-C1 and HBsAg vaccine combined with pEGF-C1/HBD2,respectively.1)P <0.05,group D is compared with group A and C;2)P >0.05,group D is compared with group B.
Group OD450value PBS(A)0.006±0.001 HBsAg(B) 1.422 2±0.568 HBsAg combined pEGF-C1(C) 1.109±0.211 HBsAg combined pEGF-C1/HBD2(D) 1.765 3±0.586 1)2)

图1 各免疫组小鼠血清总HBsAb OD450值Fig.1 OD450 values of the mouse serum total HBsAb
表2 不同免疫组小鼠脾淋巴细胞体外刺激增殖效应(OD450,±s,n=5)Tab.2 The proliferation effective of the spleen lymphocytes from various groups(OD450,±s,n=5)

表2 不同免疫组小鼠脾淋巴细胞体外刺激增殖效应(OD450,±s,n=5)Tab.2 The proliferation effective of the spleen lymphocytes from various groups(OD450,±s,n=5)
Note:1)Compared with other groups stimulated with PBS in vitro,P <0.05;2)Compared with other groups stimulated with ConA in vitro,P <0.05;3)Compared with other groups stimulated with HBsAg in vitro,P <0.05;4)Compared with other stimulating groups in vitro immunized with HBsAg invivo,P <0.05;5)Compared with other stimulating groups in vitro immunized with HBsAg combined pEGF-C1 in vivo,P <0.05;6)Compared with other stimulating groups in vitro immunized with HBsAg combined PEGF-C1/HBD2,P<0.05.
Immunized groups in vivo Stimulating groups in vitro PBS ConA HBsAg PBS HBsAg HBsAg combined pEGF-C1 HBsAg combined pEGF-C1/HBD2 0.32±0.01 0.37±0.01 0.30±0.01 0.64±0.011)0.34±0.01 0.39±0.01 0.36±0.02 0.54±0.052)0.37±0.01 0.42±0.014)0.38±0.035)0.79±0.033)6)
表3 各组之间小鼠脾淋巴细胞中CD3+CD4+T细胞及CD3+CD8+T细胞的比较(±s,n=8)Tab.3 The percents of the CD3+CD4+T cells and CD3+CD8+T cells in the spleen lymphocytes from various groups(±s,n=8)

表3 各组之间小鼠脾淋巴细胞中CD3+CD4+T细胞及CD3+CD8+T细胞的比较(±s,n=8)Tab.3 The percents of the CD3+CD4+T cells and CD3+CD8+T cells in the spleen lymphocytes from various groups(±s,n=8)
Note:1)P <0.05,for the value of the percent of CD3 and CD4 double positive T cell,compared with other 3 groups;2)P <0.05,for the value of the percent of CD3 and CD8 double positive T cell,compared with other 3 groups;3)P <0.05,for the value of the percent of CD3 and CD8 double positive T cell,compared with PBS group;4)P <0.05,for the value of CD4+/CD8+T cell,compared with other 3 groups;5)P <0.05,for the value of the percent of CD4 and CD8 double positive T cell,compared with HBsAg group.
Groups CD3+CD4+(%) CD3+CD8+(%) CD4+/CD8+PBS 14.94±6.62 27.00±4.71 0.577±0.27 HBsAg 12.69±3.47 38.70±5.502) 0.33±0.11 HBsAg combined pEGF-C1 12.31±1.54 19.49±5.453) 0.66±0.175)HBsAg combined pEGF-C1/HBD2 23.20±2.191) 23.02±2.10 1.01±0.014)
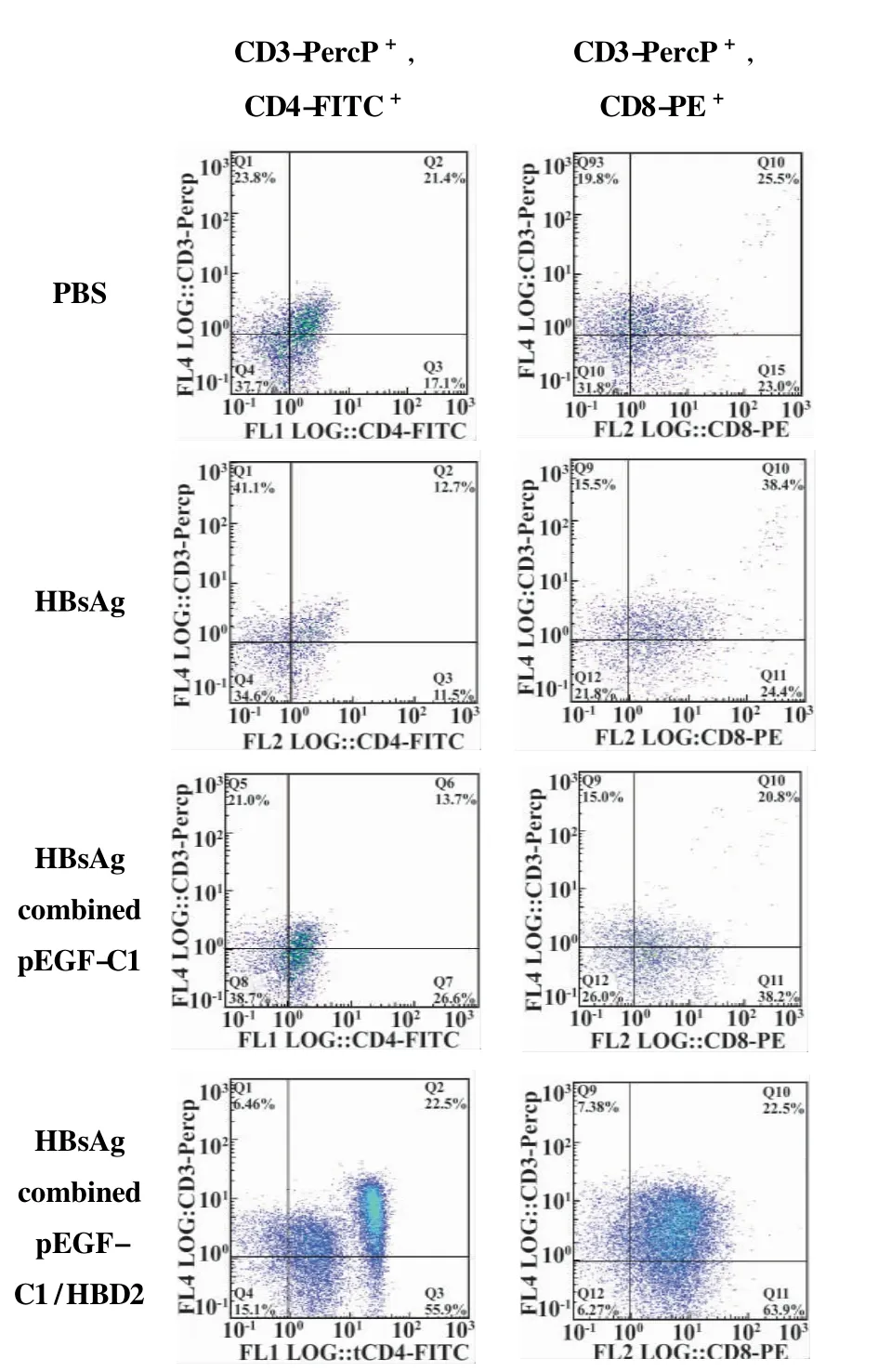
图2 流式分析各免疫组小鼠脾脏CD3+CD4+T和CD3+CD8+T细胞百分率Fig.2 The percents of the CD3+CD4+T cells and CD3+CD8+T cells in the spleen lymphocytes from various groups
2.3 各免疫组小鼠T细胞功能亚群检测 经流式细胞术检测表明,与其他组相比,乙肝疫苗联合pEGFP-C1/HBD2免疫组CD4+T细胞百分率明显升高(P<0.05),而乙肝疫苗免疫组和乙肝疫苗联合pEGFP-C1免疫组与PBS组相比,CD4+T细胞百分率均有轻微下降,但差异无统计学意义(P>0.05)。CD8+T细胞百分率在乙肝疫苗免疫组百分率最高,与其他相比差异有统计学意义(P<0.05),但乙肝疫苗联合pEGFP-C1/HBD2免疫组+T细胞百分率比乙肝疫苗联合pEGFP-C1免疫组更高,但两组相比差异无统计学意义(P>0.05),而乙肝疫苗联合pEGFP-C1免疫组+T细胞百分率比PBS组明显下降(P<0.05)。乙肝疫苗联合pEGFP-C1/HBD2免疫组CD4+/CD8+T细胞比值显著提高,与其他组相比差异有统计学意义(P<0.05),而乙肝疫苗联合pEGFP-C1免疫组比乙肝疫苗免疫组也有显著升高(P<0.05),但与PBS组相比差异无统计学意义(P>0.05 ),结果见表3、图2。
表4 各种免疫组小鼠脾脏指数(±s,n=5)Tab.4 The spleen index of the mice immunized(±s,n=5)
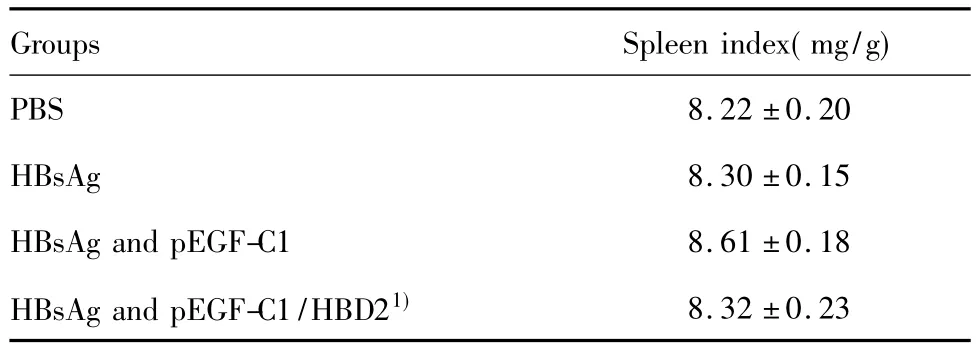
表4 各种免疫组小鼠脾脏指数(±s,n=5)Tab.4 The spleen index of the mice immunized(±s,n=5)
Note:1)P>0.05,compared with other 3 groups.
Groups Spleen index(mg/g)PBS 8.22±0.20 HBsAg 8.30±0.15 HBsAg and pEGF-C1 8.61±0.18 HBsAg and pEGF-C1/HBD21)8.32±0.23
2.4 脾脏指数 通过对各免疫组小鼠的体重和脾脏重量进行方差分析,结果表明各免疫组小鼠脾细胞指数差异没有显著意义(P>0.05),结果见表4。
3 讨论
近年来,以明矾为佐剂的乙肝疫苗用于预防接种和防止乙肝病毒感染中发挥了重要作用。但有相关报道在一部分人群中不会诱导特异性抗体生成,且明矾不辅助细胞免疫反应,因此科研人员一直在努力寻找更有效的疫苗佐剂来增强疫苗的免疫效应。有些试验也取得了一定的成果,但是仍然有一定局限性。
在本研究中,通过对各免疫组小鼠血清乙肝表面抗体水平进行比较,发现含有HBD2基因的质粒免疫后,小鼠产生的血清抗体比单独乙肝疫苗免疫产生的抗体含量明显增加,因此人-β防御素2能够提高机体对乙肝疫苗产生的体液免疫反应,从而提高保护抗体水平,更好的预防HBV感染。
一些研究者已经证明通过促进抗原递呈细胞对抗原的摄取、加工和递呈,可使更多的抗原被给予组织相容性抗原相关的辅助性T细胞,刺激T细胞增殖和分化[17]。本文研究了以HBD2为佐剂的乙肝疫苗免疫小鼠脾细胞的体外增殖效应,发现用乙肝疫苗联合pEGFP-C1/HBD2质粒免疫组小鼠脾淋巴细胞表现出比其他组更高水平的淋巴细胞增殖反应。这种情况可能与人-β防御素2在小鼠体内促进了树突状细胞趋化与成熟,增强了外源性抗原递呈,激活了更多的CD4+T细胞,显著提高了CD4+T的百分率或者其活性有关。有研究认为Al(OH)3作为佐剂,可能具有双重效应,在小剂量时,对细胞增殖有促进作用,而在大剂量时会产生免疫抑制效应。本研究还发现,小剂量乙肝疫苗在体外可以较好地刺激T细胞增殖,其效应甚至比ConA更强,表明乙肝疫苗可以有效刺激免疫细胞增殖,产生较好免疫效应,但这种效应是否与作为佐剂的Al(OH)3有关,还需要更多实验证实。
宿主的免疫功能特别是细胞免疫功能对 HBV感染后的临床转归有重要作用[18-20]。国内外研究初步表明,慢性乙型肝炎患者体内细胞免疫功能不足,T淋巴细胞亚群失衡,使机体不能有效清除入侵的乙肝病毒,导致疾病的慢性化[21-23]。而本研究发现HBD2可能存在提高乙肝疫苗细胞免疫功能的作用,从而可能更好地防治HBV感染。
机体正常免疫功能是由各种淋巴细胞亚群间的相互作用来维持的,T淋巴细胞亚群中的CD4+T和CD8+T细胞能够调节其他免疫细胞活性,参与细胞和体液免疫反应。其中CD3/CD4双阳性辅助性T细胞其主要功能是辅助诱导其他免疫细胞增殖和分化,调节免疫功能。而CD3/CD8双阳性细胞群体,可特异性杀伤靶细胞,具有抗病毒、抗肿瘤和重要的免疫调节作用。本研究通过流式细胞仪检测、比较了不同免疫组小鼠中脾细胞表面分子CD4+T和CD8+T细胞百分率及CD4+/CD8+比值,发现与PBS组相比,乙肝疫苗对小鼠CD4+T细胞无明显激活促进效应,但对小鼠CD8+T细胞具有明显的激活作用。而乙肝疫苗联合pEGFP-C1免疫小鼠后,与PBS对照组相比CD4+T细胞和CD8+T细胞百分率都表现为一定程度的下降,并且后者下降程度有统计学意义,表现为对乙肝疫苗细胞免疫效应具有一定抑制作用。乙肝疫苗联合pEGFP-C1/HBD2免疫小鼠后,对CD4+T细胞百分率比单独使用乙肝疫苗的免疫组和乙肝疫苗联合pEGFP-C1免疫均有更好的激活作用,但对CD8+T细胞百分率没有显著提高作用。表明pEGFP-C1/HBD2质粒免疫可以在一定程度上提高乙肝疫苗免疫小鼠CD4+T和CD8+T淋巴细胞的数量和比例,对免疫状态的调节具有重要意义。
综上所述,本研究发现人-β防御素2对乙肝疫苗在小鼠中的免疫功能有一定增强作用,尤其是CD4+T淋巴细胞带来的Th细胞效应更为明显。因此HBD2可能具有一定的增强乙肝疫苗免疫保护作用的佐剂效应。本研究对探讨适用于增强乙肝疫苗免疫效应的新型免疫佐剂有重要意义。
1 Rehermann B,Nascimbeni M.Immunology of hepatitis B virus and hepatitis C virus infection[J].Nat Rev Immunol,2005;5(3):215-229.
2 Fujihashi K,Koga T,McGee J R.Mucosal vaccination and immune responses in the elderly[J].Vaccine,2000;18(16):1675-1680.
3 Schwaab M,Hansen S,Pearson M D et al.Human beta-defensins at the front line of the peritonsillar abscess[J].Eur J Clin Microbiol Infect Dis,2009;28(7):745-755.
4 Krishnakumari V,Rangaraj N,Nagaraj R.Antifungal activities of human beta-defensins HBD-1 to HBD-3 and their C-terminal analogs Phd1 to Phd3 [J].Antimicrob Agents Chemother,2009;53(1):256-260.
5 Yurong Y,Yibao J,Ruiping S et al.Effects of chicken intestinal antimicrobial peptides on humoral immunity of chickens and antibody titres after vaccination with infectious bursal disease virus vaccine in chicken[J].Arch Anim Nutr,2006;60(5):427-435.
6 Xu Z,Peng L,Zhong Z.High-level expression of a soluble functional antimicrobial peptide,human beta-defensin 2,in Escherichia coli[J],Biothechnol Prog,2006;22(2):382-386.
7 Weinberg A,Qui ones-Mateu M E,Lederman M M.Role of human beta-defensins in HIV infection [J].Adv Dent Res,2006;19(1):42-48.
8 Schneider J J,Unholzer A,Schaller M et al.Human defensins[J].J Mol Med(Berl),2005;83(8):587-595.
9 Kim C,Kaufmann S H.Defensin:a multifunctional molecule lives up to its versatile name[J].Trends Microbiol,2006;14(10):428-431.
10 Selsted M E,Ouellette A J.Mammalian defensins in the antimicrobial immune response[J].Nat Immunol,2005;6(6):551-557.
11 Dhople V,Krukemeyer A,Ramamoorthy A.The human beta-defensin-3,an antibacterial peptide with multiple biological functions[J].Biochim Biophys Acta,2006;1758(9):1499-1512.
12 Wong J H,Xia L,Ng T B.A review of defensins of diverse origins[J].Curr Protein Pept Sci,2007;8(5):446-459.
13 Yang D,Chertov O,Bykovskaia S N et al.Beta-defensins:linking innate and adaptive immunity through dendritic and T cell CCR6[J].Science,1999;286(5439):525-528.
14 Biragyn A,Ruffini P A,Leifer C A et al.Toll-like receptor 4-dependent activation of dendritic cells by beta-defensin 2.[J].Science,2002;298(5595):1025-1029.
15 Rhrl J,Yang D,Oppenheim J J et al.Specific binding and chemotactic activity of mBD4 and its functional orthologue hBD2 to CCR6-expressing cells[J].J Biol Chem,2010;285(10):7028-7034.
16 Morgera F,Pacor S,Creatti L et al.Effects on antigen-presenting cells of short-term interaction with the human host defence peptide beta-defensin 2 [J].Biochem J,2011;436(3):537-546.
17 Coombes A G,Lavelle E C,Davis S S.Biodegradable lamellar particles of poly(lactide)induce sustained immune responses to a single dose of adsorbed protein [J].Vaccine,1999;17(19):2410-2422.
18 Alatrakchi N,Koziel M J.Antiviral T-cell responses and therapy in chronic hepatitis B [J].J Hepatol,2003;39(4):631-634.
19 Stoop J N,van der Molen R G,Baan C C et al.Regulatory T cells contribute to the impaired immune response in patients with chronic hepatitis B virus infection [J].Hepatology,2005;41(4):771-778.
20 Phillips S,Chokshi S,Riva A et al.CD8(+)T cell control of hepatitis B virus replication:direct comparison between cytolytic and noncytolytic functions[J].J Immunol,2010;184(1):287-295.
21 You J,Sriplung H,Geater A et al.Effect of viral load on T-lymphocyte failure in patients with chronic hepatitis B[J].World J Gastroenterol,2008;14(7):1112-1119.
22 Chang J J,Thompson A J,Visvanathan K et al.The phenotype of hepatitis B virus-specific T cells differ in the liver and blood in chronic hepatitis B virus infection[J].Hepatology,2007;46(5):1332-1340.
23 徐志强,张鸿飞,杨晓晋 et al.小儿慢性乙型肝炎外周血T细胞亚群和临床病理关系的研究[J].中华试验和临床病毒学杂志,2004;18(2):142-144.

