慢性乙型肝炎患者外周血Treg/Th17比率的检测及其与肝功能的相关性研究①
林振忠 余雪平 苏智军 郭如意 明德松 黄绿叶 苏密龙
(福建医科大学附属泉州第一医院检验科,泉州362000)
我国是乙型肝炎病毒(HBV)高感染率国家,现有CHB患者约2 000万人,每年约有100万人死于HBV相关性肝脏疾病。HBV本身不引起肝脏病变,而细胞免疫介导的肝损害可导致各种急慢性肝炎[1]。CD4+T淋巴细胞,尤其是Treg和Th17细胞在HBV致病过程中发挥重要作用[2-4]。Treg与Th17细胞分别起着抗炎和促炎作用,Treg/Th17失衡可能加重肝脏免疫炎症或促进病毒感染慢性化[4]。最近研究表明,Treg/Th17比率可能是一个有效的评估疾病严重程度的免疫指标[5,6]。然而,Treg/Th17比率与CHB患者肝组织免疫炎症及病情分级的关系尚未阐明。本实验通过检测CHB患者外周血Treg和Th17细胞的频数,探讨Treg、Th17细胞及Treg/Th17比率与肝功能的关系,以便更好地反映CHB患者肝组织的免疫炎症。
1 材料与方法
1.1 研究对象 选择2010年7月~2011年8月我院住院CHB患者70例,其中男54例,女16例,年龄19~62岁,平均(30.65±14.26)岁;HBeAg阳性CHB患者41例,HBeAg阴性CHB患者29例,诊断均符合2000年(西安)全国传染病与寄生虫病学术会议制定的标准[7],近3个月未接受过免疫调节剂(如胸腺肽、糖皮质激素)、保肝及抗病毒治疗,排除甲、丙、丁、戊型病毒感染及合并酒精性、药物性、自身免疫性或代谢性肝病以及原发性肝癌。另选同期我院门诊健康体检者(HC)20例,其中男13例,女7例,年龄21~64岁,平均(36.50±13.26)岁。本实验得到我院伦理委员会批准同意,患者签署知情同意书。
1.2 试剂 改良型RPMI1640购自北京赛默飞世尔生物化学制品有限公司;人淋巴细胞分离液和胎牛血清购自北京索莱宝科技有限公司;佛波酯(PMA)、离子霉素(Ion)、莫能菌素(Mon)、IL-17AFITC和CD127-PE单克隆抗体购自美国eBioscience公司;CD4-FITC、CD8-PE、CD3-PC5、CD25-PC5 等单克隆抗体购自美国Beckman coulter immunotech公司;破膜剂购自美国Invitrogen公司;人细胞因子TGF-β1酶联免疫吸附实验(ELISA)试剂盒购自美国MARKET公司。
1.3 标本采集及细胞分离 抽取入选研究对象的外周静脉血2管,1管3 ml(肝素抗凝),Ficoll密度梯度离心法分离PBMC,用RPMI1640培养液调整PBMC密度到2×106ml-1;另一管5 ml,收集血清,-80℃冰冻待ELISA检测。
1.4 外周血Th17、Treg细胞频数的检测 抽取外周静脉血3 ml(肝素抗凝),Ficoll密度梯度离心法分离PBMC,用RPMI1640培养液调整PBMC密度到2×106ml-1,将2 ml PBMC悬液加入至6孔板内,再加入佛波酯(25 ng/ml)、离子霉素(1 μg/ml)和莫能菌素(1.7 μg/ml)(以上均为工作浓度),37℃5%CO2细胞培养箱培养5小时。收集细胞后分为测定管和对照管各 100 μl,加入 10 μl CD3-PC5 和 20 μl CD8-PE单克隆抗体,室温避光孵育15分钟。100μl固定液(A液)室温避光固定反应15分钟后,加入3 ml PBS,混匀后离心弃去上清。加入100 μl破膜剂(B液)进行细胞打孔利于细胞因子染色,测定管加入 IL-17A-FITC 20 μl,对照管加入 20 μl同型对照,室温避光孵育20分钟后,再加入3 ml PBS,静置10分钟,离心弃去上清液,再加入0.5 ml PBS重悬,上机检测。应用流式细胞仪(Beckman coulter Epics XL型,美国 Beckman公司),根据 CD3、CD8设门以圈定T淋巴细胞群,对 Th17细胞(CD3+CD8-IL-17+T)进行检测。
取100 μl静脉血,加入CD4-FITC和CD127-PE单克隆抗体各 20 μl,CD25-PC5 单克隆抗体 10 μl,混匀后避光孵育20分钟,再加入2 ml红细胞裂解液,混匀后避光孵育20分钟,加3 ml PBS洗涤1次后,再加入0.5 ml PBS重悬,上机检测。应用流式细胞仪对Treg细胞(CD4+CD25highCD127lowT)进行检测。
1.5 血清TGF-β1的检测 取上述冻存的血清,通过ELISA双抗体夹心法检测细胞因子TGF-β1,具体操作按照试剂盒提供的说明书进行,在酶标仪(Alisei Quality System,意大利SEAC公司)450 nm处读取数据。
1.6 肝功能指标检测 采用全自动生化仪(Beckman LX-20,美国 Beckman公司)检测谷丙转氨酶(ALT)、谷草转氨酶(AST)、总胆红素(TBil)、直接胆红素(DBil)等肝功能指标,试剂由美国Beckman公司提供。
1.7 统计学处理 采用SPSS13.0统计分析软件进行统计分析,计量资料采用±s表示,各组间采用Mann-Whitney U检验;治疗前后采用Wilcoxon配对T检验;相关性检验采用Spearman's相关分析,以P<0.05为差异有统计学意义。
2 结果
2.1 研究对象的临床资料 CHB组和正常对照组年龄、性别具有可比性(P>0.05),见表1。
表1 各组研究对象的临床资料(±s)Tab.1 Clinical data of each group(±s)

表1 各组研究对象的临床资料(±s)Tab.1 Clinical data of each group(±s)
Note:Compared with healthy control,the liver function indicators were higher in the CHB group,the age and gender were almost the same between the two group.
CHB HC CHB VS HC HBeAg positive HBeAg negative P N(n)<0.001 Gender(male)Age(year)TBil(μmol/L)DBil(μmol/L)ALT(U/L)AST(U/L)20 13(65%)36.50±13.26 19.00±4.75 16.23±3.28 16.40±1.91 13.35±1.12 41 29(70.7%)30.58±10.01 71.35±103.36 39.29±60.20 510.11±499.95 277.14±324.03 29 23(79.3%)36.75±10.00 64.02±82.31 36.42±50.31 480.97±712.25 258.07±322.07 0.419 0.315<0.05<0.05<0.001
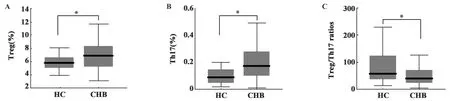
图1 健康对照组与CHB组Treg、Th17细胞(%)和Treg/Th17比率的比较Fig.1 Frequency of Treg and Th17 cells and the ratio of Treg/Th17 in patients with chronic hepatitis B and healthy controls
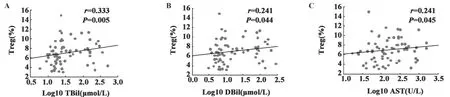
图2 Treg细胞(%)与各肝功能指标的相关性分析Fig.2 The relationship between the frequency of Treg cells and liver function indicators
2.2 CHB患者外周血Treg、Th17细胞频数及Treg/Th17比率的检测结果 CHB患者Treg细胞频数[(7.04±2.41)%]明显高于健康对照者[(5.83±1.07)%,P=0.025];Th17细胞频数[(0.23±0.16)%]也明显高于健康对照者[(0.11±0.05)%,P=0.005],CHB患者 Th17细胞升高较Treg细胞明显,Treg/Th17比率(56.72±60.37)低于健康对照者(76.09±68.49,P=0.047),见图1。
2.3 Treg和Th17细胞与肝功能的相关性 CHB患者 Treg细胞与TBil、DBil、AST 呈正相关(P <0.05),Th17细胞与以上指标均无明显相关性(P>0.05),见图2。
2.4 Treg/Th17比率与肝功能的相关性 HBeAg阳性CHB患者Treg/Th17比率与总胆红素(TBil)、直接胆红素(DBil)和谷丙转氨酶(ALT)呈正相关(P<0.05);HBeAg阴性CHB患者Treg/Th17比率与ALT呈负相关(P<0.05),见图3。
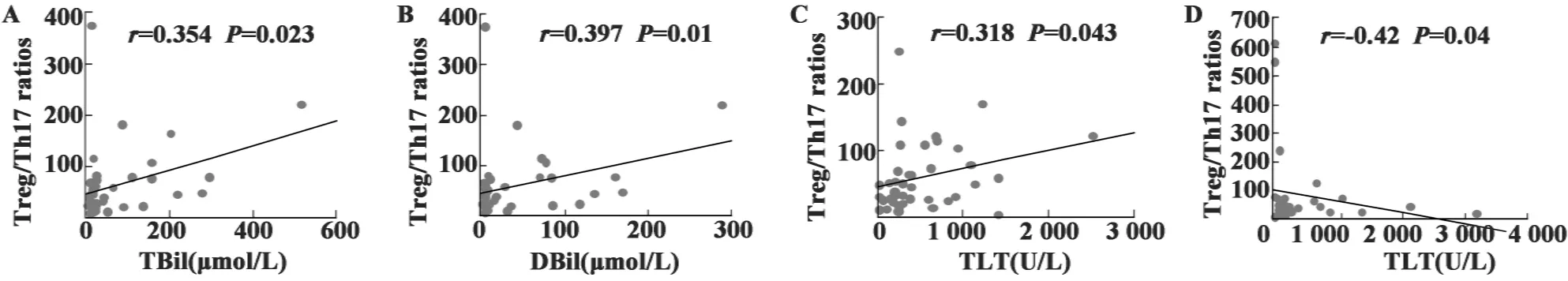
图3 Treg/Th17比率与各肝功能指标的相关性Fig.3 The relationship between the ratio of Treg/Th17 and liver function indicators
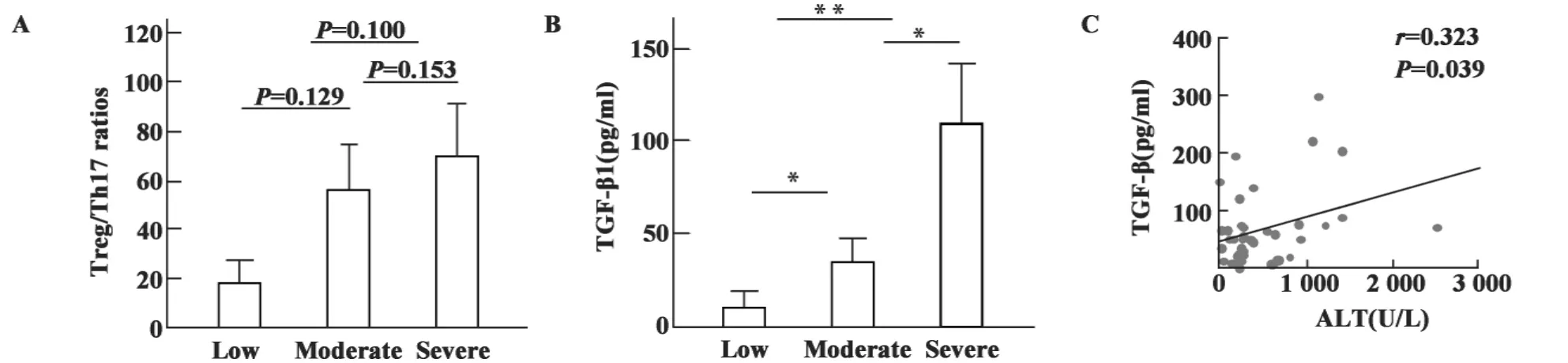
图4 Treg/Th17比率和TGF-β1与CHB病情分级的关系Fig.4 The relationship between the ratio of Treg/Th17 and TGF-β1 and the grade of liver injury
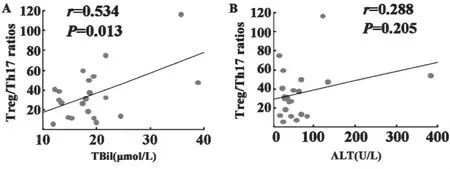
图5 23例HBeAg阳性CHB患者随访时Treg/Th17比率与肝功能指标相关性Fig.5 The relationship between the ratio of Treg/Th17 and liver function indicators in 23 HBeAg positive CHB after therapy
2.5 Treg/Th17比率和TGF-β1与CHB病情分级的关系 本研究分析了41例HBeAg阳性CHB患者。其中轻度3例,中度25例,重度13例。数据显示,Treg/Th17比率随病情加重而升高,但差异不明显,而各组间 TGF-β1差异明显,且 TGF-β1与 ALT呈正相关,见图4。
2.6 综合治疗后Treg/Th17比率与肝功能的相关性 本研究共23例HBeAg阳性CHB患者接受随访,平均随访(2.02±1.91)月。数据显示,综合治疗(保肝及核苷(酸)类似物抗病毒)后,CHB患者的肝功能指标(TBil、DBil、ALT、AST)、Treg 细胞频数及TGF-β1均明显下降(P<0.01),Th17细胞却有所升高,表现为Treg/Th17比率下降(P>0.05)。Treg/Th17比率与TBil呈正相关(P<0.05),与ALT等趋向正相关(P>0.05,见图5)。
3 讨论
免疫介导的肝脏炎症在HBV致病过程中发挥着重要的作用。近来年,研究的焦点主要集中于功能失调的Treg和Th17细胞。Treg细胞通过表达特异性的转录因子(Foxp3)和分泌IL-10、TGF-β1等细胞因子,介导自身免疫耐受和维持免疫平衡[8,9]。Th17 细胞通过分泌 IL-17、IL-22、GM-CSF、IL-6 等细胞因子,参与恶性肿瘤、酒精性肝病和自身免疫性疾病等免疫病理反应[10]。其中IL-17是T细胞诱导的炎症反应的早期启动因素,在炎症的发生发展过程中起促进作用[11]。多数研究认为Treg细胞功能缺陷和Th17细胞上调可能是导致CHB病情进展的重要因素[2,4]。本实验显示,CHB 患者外周血中 Treg和Th17细胞明显增加,但Treg细胞增加比例不及Th17细胞,Treg/Th17平衡被打破,导致促炎因子Th17细胞处于相对优势地位,而抑炎因子Treg细胞相对缺乏,进而导致CHB肝脏免疫炎症的发生。
应注意的是,Treg/Th17平衡不仅与CHB致病机制相关,而且还与肝组织免疫炎症相关。本实验发现随着病情进展,HBeAg阳性 CHB患者 Treg/Th17比率呈升高趋势,而TGF-β1水平明显升高。由于低水平TGF-β1促进Th17分化,而高水平TGF-β1有助于Treg细胞产生[2]。因此随着 CHB病情进展,Treg细胞和TGF-β1之间形成正反馈,导致Treg细胞逐渐增多,因而Treg/Th17比率也随着升高。增多的Treg细胞可能扮演着抑制功能过度亢进的Th17细胞的角色,从而有利于维持免疫平衡,减轻肝组织损伤,进而防止病情进展至肝功能衰竭[3]。相关性发现 HBeAg阳性 CHB患者,Treg/Th17比率与TBil、DBil、ALT等肝脏炎症指标呈正相关,进一步提示Treg/Th17比率在一定程度上反映了肝脏的免疫炎症程度。在HBeAg阴性患者中,我们却发现相反的情况,Treg/Th17比率与ALT呈负相关。可能的解释为:HBeAg阳性CHB患者主要处于免疫清除早期,Treg细胞仍维持在高水平阶段,有利于维持免疫耐受,而HBeAg是介导免疫耐受(主要与Treg细胞有关)的主要因子[12];HBeAg阴性患者则处于免疫再活动期,常可进展为肝纤维化、肝硬化、失代偿肝硬化和HCC[7],与Th17细胞分泌的特征性IL-17有关[13];因此 HBeAg阳性 CHB患者可能以Treg细胞为主要优势,而HBeAg阴性CHB患者主要是Th17细胞起主要作用,这从本实验中Treg细胞与TBil、DBil、AST呈正相关得到证实。
以往研究表明,阿德福韦酯治疗能减少外周血中Treg细胞频数,进而影响宿主免疫反应[14]。本实验随访资料显示,随着肝脏炎症缓解,HBeAg阳性CHB患者Treg细胞频数明显下降,而Th17细胞频数有所上升,Treg/Th17比率伴随TBil下降而下降,进一步表明Treg/Th17比率与肝脏免疫炎症相关。不足的是,本研究缺乏系统的随访资料,从而无法观察到Treg/Th17比率与肝脏免疫炎症的动态变化。
综上所述,本实验发现Treg细胞及Treg/Th17比率与肝功能指标具有良好的相关性,Treg/Th17比率在一定程度上反映了肝组织免疫炎症程度。检测Treg、Th17细胞频数及其比率,能较好地反映CHB患者肝组织的免疫炎症。
1 Rehermann B,Nascimbeni M.Immunology of hepatitis B virus and hepatitis C virus infection [J].Nat Rev Immunol,2005;5(3):215-229.
2 Zhang J Y,Song C H,Shi F et al.Decreased ratio of Treg cells to Th17 cells correlates with HBV DNA suppression in chronic hepatitis B patients undergoing entecavir treatment[J].PLoS ONE,2010;5(11):e13869.
3 Wang Q H,Zheng Y H,Huang Z M et al.Activated IL-23/IL-17 pathway closely correlates with increased Foxp3 expression in livers of chronic hepatitis B patients[J].BMC Immunology,2011;12(25):1472-1481.
4 Niu Y H,Liu H L,Yin D L et al.The balance between intrahepatic IL-17+T cells and Foxp3+regulatory T cells plays an important role in HBV-related end-stage liver disease [J].BMC Immunology,2011;12(47):1471-1479.
5 Oukka M.Interplay between pathogenic Th17 and regulatory T cells[J].Ann Rheum Dis,2007;66(Suppl 3):iii87-iii90.
6 Weaver C T,Hatton R D.Interplay between the Th17 and Treg cell lineages:a(co-)evolutionary perspective [J].Nat Rev Immunol,2009;9(12):883-889.
7 Chinese Society of Hepatology and Chinese Society of Infectious Diseases,Chinese Medical Association.The guideline of prevention and treatment for chronic hepatitis B(2010 version) [J].J Clin Hepatol,2011;27(1):1-16.
8 Roncador G,Brown P J,Maestre L et al.Banham AH:Analysis of FOXP3 protein expression in human CD4+CD25+regulatory T cells at the single-cell level[J].Eur J Immunol,2005;35(6):1681-1691.
9 Hirota K,Yoshitomi H,Tanaka S et al.T cell self-reactivity forms a cytokine milieu for spontaneous development of IL-17+T cells that cause autoimmune arthritis[J].J Exp Med,2007;204(1):41-47.
10 Ma D,Zhu X,Zhao P et al.Profile of Th17 cytokines(IL-17,TGF-beta,IL-6)and Th1 cytokine(IFN-gamma)in patients with immune thrombocytopenic purpura [J].Ann Hematol,2008;87(11):899-904.
11 Bettlli E,Carrier Y,Gao W et al.Reciprocal developmental pathways for the generation of pathogenic effector Th17 and regulatory T cells[J].Nature,2006;441(7090):235-238.
12 Hsu Y S,Chien R N,Yeh C T et al.Long-term outcome after spontaneous HBeAg seroconversion in patients with chronic hepatitis B[J].Hepatology,2002;35(6):1522-1527.
13 Wang L Y,Chen S J,Xu K S.IL-17 expression is correlated with hepatitis B related liver diseases and fibrosis[J].Int J Mol Med,2011;27(3):385-392.
14 Stoop J N,Vander Molen R G,Kuipers E J et al.Inhibition of viral replication reduces regulatory T cells and enhances the antiviral immune response in chronic hepatitis B [J].Virology,2007;361(1):141-148.

