中药预防流感作用与黏膜免疫相关性研究①
徐培平 丁 伟 赵 昉 向 燕 李向阳 张奉学 (广州中医药大学,广州510405)
中医药在预防流感方面有着丰富的经验[1],前期研究表明,中药预防流感的三类主要方药(辛凉解表剂-银翘散制剂,扶正祛邪剂-玉屏风散制剂,芳香辟秽剂-冰香散制剂)具有较好的作用(另文发表)。流感是一种呼吸道传染病,病毒首先侵袭呼吸道黏膜,黏膜表面的免疫反应是第一道防线,其分泌性IgA可以有选择的转移到黏膜表面,能够结合病毒防止其粘附和进入,在阻止流感病毒感染和传播中占有重要的地位[2,3]。中药预防流感的给药方式主要是通过药物口服、烟熏及佩戴等[4],我们提出“中药预防流感的作用与黏膜免疫相关性”的设想[5],推测中药除直接作用于呼吸道黏膜外,还可通过作用于肠道黏膜,通过共同黏膜免疫系统进而影响呼吸道黏膜IgA分泌,最终在临床上表现为对流感的防治。为此,我们进行了中药预防给药正常小鼠及流感病毒感染小鼠呼吸道、肠道黏膜分泌IgA的比较研究,以期了解中药预防流感的作用与黏膜免疫相关性,探讨中药预防流感的黏膜免疫机制。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 BALB/c小鼠,雌性,13~15克,由广东省医学实验动物中心提供,SPF级,实验动物质量合格证号:0098186。
1.1.2 试剂与器材 Mouse IgA ELISA Kit:Bethyl Laboratories,Inc.Lot No:E99-103-111117,120124,110517。乙醚,广州化学试剂厂,批号:20100601-1。利巴韦林,由肇庆星湖药厂提供,批号:20100821。402AI医用超声雾化器,江苏鱼跃医疗设备有限公司,批号:0805001。YX280A手提式不绣钢蒸汽消毒器,上海三申医疗器械有限公司,批号:0602142。FA1004型电子分析天平,上海良平仪器仪表有限公司。YJ-875医用净化工作台,苏州净化设备厂。超纯水器,Millipore。超低温水箱,Sanyo日本。酶标仪(Bio-Teck,ELx800)。
1.1.3 病毒 流感病毒A/FM/1/47(H1N1)鼠肺适应株,由中国医学科学院医药生物技术研究所提供,广州中医药大学热带医学研究所病毒室冷冻保存,于狗肾细胞(MDCK)传代,以细胞病变及鸡红血球血凝法来判断其滴度。
1.1.4 实验药物 各配伍组合药物选定符合2000年版中国药典规定的饮片,购自广州中医药大学附属第一医院中药房。
1.1.4.1 银翘散制剂 系由银翘散进行加减配伍,主要由银花、连翘、牛蒡子、贯仲、藿香、荆芥等药物构成。
1.1.4.2 玉屏风散制剂 系由玉屏风散进行加减配伍,主要由防风、黄芪、白术、人参、黄精、北五味等药物构成。
1.1.4.3 冰香散 主要由冰片、广藿香、艾草等药物构成。
上述方药按剂量比例配制,根据《中药药理研究方法学》[6],按体表面积换算动物给药剂量。银翘散制剂与玉屏风散制剂系将配好的方药放于砂锅内,加入5倍的冷水浸泡30分钟,用火加热,开始用强火,沸后改用文火,煮沸1小时(银翘散制剂)或1.5小时(玉屏风散制剂),用纱布过滤。药渣加2倍量水继续按上法煎煮,沸后煎煮30分钟,过滤,合并得2次滤液,于恒重蒸发皿中,水浴蒸干浓缩成的终浓度为2 g/ml(银翘散制剂)或3 g/ml(玉屏风散制剂)。经高压灭菌20分钟,冷却后置冰箱中备用。冰香散采取水煮蒸馏工艺制得精油制剂,终浓度为1.15%。相同的方药在各实验组中保持一致。
1.2 实验方法
1.2.1 不同预防方药预防给药对正常小鼠黏膜免疫的影响 将BALB/c小鼠随机分6组,设空白对照组(生理盐水)、利巴韦林组、银翘散制剂组、玉屏风散制剂组、冰香散滴鼻组、冰香散雾化组。不同预防方药相应采用滴鼻、雾化吸入、口服三种预防途径给药。共给药12天,每天一次给药。银翘散制剂口服给药,给药剂量为40 g/kg(生药材)。玉屏风散制剂口服给药,给药剂量为60 g/kg(生药材)。冰香散采用滴鼻与雾化吸入两种给药方式,使用时将冰香散精油混悬于20 ml蒸馏水中(含0.5%吐温),微孔滤膜过滤。冰香散小鼠滴鼻给药剂量为0.03 g/kg(生药材),每次4~5滴,每日2次。冰香散雾化给药剂量为0.6 g/kg(生药材),最大雾化率:4 ml/min。利巴韦林口服给药,给药剂量为100 mg/kg。小鼠口服给药体积为20 ml/kg。给药第12天,杀剖小鼠,空白对照组称体重和肺重测定肺指数。各组均采血分离血清,收集鼻咽冲洗液、支气管肺泡灌洗液、肠道冲洗液进行ELISA法检测IgA含量。
1.2.2 不同预防方药预防给药对流感病毒感染小鼠黏膜免疫的影响 将BALB/c小鼠随机分6组,设病毒对照组、利巴韦林组、银翘散制剂、玉屏风散制剂、冰香散滴鼻组、冰香散雾化组。在乙醚轻度麻醉下,滴鼻感染15 LD50流感病毒液,每鼠4滴,约0.05 ml。试验药物在感染攻击前提前给药一周,攻击后继续给药5天,采用滴鼻、雾化吸入、口服三种预防途径给药。共给药12天,每天一次给药。给药剂量及方法见1.2.1。感染后5天,杀剖小鼠,称体重和肺重测定肺指数。采血分离血清,收集鼻咽冲洗液、支气管肺泡灌洗液、肠道冲洗液进行ELISA法检测IgA含量。
1.2.3 鼻咽冲洗液的采集 处死小鼠,开胸暴露气管,从气管中部剪断,用0.3 ml PBS从气管断端向上反复冲洗鼻咽部,收集从鼻咽部流出的冲洗液,重复3次。所有冲洗液2 000 r/min×10分钟离心,收集上清,置-40℃冰箱保存待测。
1.2.4 支气管肺泡灌洗液的采集 暴露小鼠的气管,从气管中部剪断,将肺和心脏完整取出,置一平皿内,用滤纸沾于肺表面,1 ml PBS从气管断端冲洗肺,反复冲洗3次。将全部灌洗液收集在试管中,4℃,3 000 r/min×10分钟离心,取上清液分装,-40℃冰箱保存待测。
1.2.5 肠道冲洗液的采集 开腹暴露小鼠腹腔,游离小肠、取出贲门端至回盲部末端全小肠,平铺于一平皿中,纵行剖开,3 ml PBS反复冲洗肠腔表面,用载玻片轻刮黏膜表面粘液置EP管内,2 000 r/min 15分钟离心,收集上清、-40℃保存待测。
1.2.6 小鼠血清的收集 摘眼球采血,收集血液后,3 000 r/min离心10分钟将血清和红细胞迅速小心地分离,收集血清,-40℃保存待测。
1.2.7 IgA的测定 按小鼠IgA的ELISA试剂盒要求测定:取稀释后的样品20 μl,加入96孔板,随后加入80 μl样品缓冲液,20℃恒温振荡60分钟;洗板后加入100 μl以HRP标记的抗小鼠IgA抗体,混匀,20℃ ×30分钟;洗板后加入TMB底物溶液,混匀,20℃ ×15分钟;加入100 μl终止液,混匀,可见样品颜色由蓝转黄。于450 nm波长处以酶标仪测定试样OD值。根据标准品的标准曲线换算IgA浓度。
1.3 统计学方法 用SPSS18.0软件进行数据间的统计学处理,所测数据以±s表示。IgA、肺指数采用单因素方差分析(ANOVA)。P<0.05为差异有统计学意义。
2 结果
2.1 中药预防给药对H1N1甲型流感病毒感染小鼠的抑制作用 见表1,流感病毒滴鼻感染小鼠可导致病毒性肺炎,肺部表现为炎症、出血等肺炎病变。肺组织由此增重,体重下降。病毒对照组与正常小鼠肺重相比明显增加,肺指数上升,差别有统计学意义(P<0.01)。银翘散制剂、玉屏风散制剂、冰香散均有不同程度的抑制作用,肺指数抑制率达到25.46%~41.61%。其中银翘散制剂、玉屏风散制剂、冰香散雾化给药与病毒对照组相比,差别有显著统计学意义(P<0.05)。与病毒对照组相比,冰香散滴鼻给药虽然在肺重与肺指数上有一定程度的下降,但差别没有统计学显著性意义(P>0.05)。
表1 中药预防给药对H1N1甲型流感病毒感染小鼠的抑制作用(±s)Tab.1 The inhibitory effect of preventive herbs on mice infected with influenza A virus(±s)

表1 中药预防给药对H1N1甲型流感病毒感染小鼠的抑制作用(±s)Tab.1 The inhibitory effect of preventive herbs on mice infected with influenza A virus(±s)
Note:Compared with virus control group,1)P <0.05,2)P <0.01;3)Lung index=(lung weight of mice/body weight of mice) ×100;4)Inhibition rate of lung index=(mean of lung index of Virus control group-mean of lung index of trial drug groups)/mean of lung index of Virus control group×100.
Groups Dosage(g/kg)Number(n)Lung weight(mg)Lung index3)(g/g)Inhibition rate of lung index4)(%)Blank control - 10 0.146±0.0182) 0.71±0.052)-Virus control - 10 0.226±0.041 1.61±0.36 -Ribavirin 0.1 10 0.177±0.038 1.08±0.391) 32.91 Yinqiao Powder Preparation 40 11 0.191±0.044 1.04±0.421) 35.40 Jade Screen Powder Preparation 60 11 0.177±0.039 0.94±0.412) 41.61 Bing-xiang Powder Preparation/Nasal drops 0.03 9 0.197±0.025 1.20±0.33 25.46 Bing-xiang Powder Preparation/Nebulised inhalation 0.6 9 0.175±0.049 1.09±0.431)32.29
表2 不同预防方药对正常小鼠黏膜免疫的影响(±s)Tab.2 Effect of several different preventive herbs on mucosal immunity of normal mice(±s)
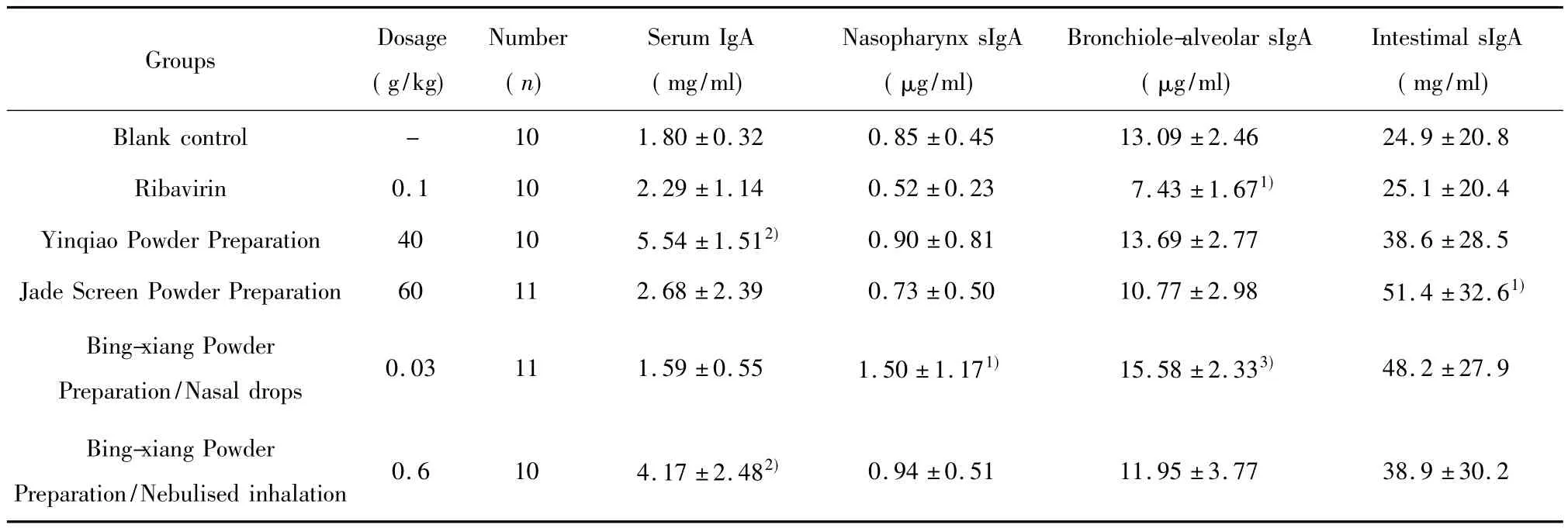
表2 不同预防方药对正常小鼠黏膜免疫的影响(±s)Tab.2 Effect of several different preventive herbs on mucosal immunity of normal mice(±s)
Note:Compared with Blank control group,1)P<0.05,2)P <0.01;3)P=0.065.
Groups Dosage(g/kg)Number(n)Serum IgA(mg/ml)Nasopharynx sIgA(μg/ml)Bronchiole-alveolar sIgA(μg/ml)Intestimal sIgA(mg/ml)2.46 24.9±20.8 Ribavirin 0.1 10 2.29±1.14 0.52±0.23 7.43±1.671) 25.1±20.4 Yinqiao Powder Preparation 40 10 5.54±1.512) 0.90±0.81 13.69±2.77 38.6±28.5 Jade Screen Powder Preparation 60 11 2.68±2.39 0.73±0.50 10.77±2.98 51.4±32.61)Bing-xiang Powder Preparation/Nasal drops 0.03 11 1.59±0.55 1.50±1.171) 15.58±2.333) 48.2±27.9 Blank control - 10 1.80±0.32 0.85±0.45 13.09±Bing-xiang Powder Preparation/Nebulised inhalation 0.6 10 4.17±2.482)0.94±0.51 11.95±3.77 38.9±30.2
2.2 中药预防给药对正常小鼠黏膜免疫的影响见表2,正常小鼠连续给予不同预防方药12天,银翘散制剂口服与冰香散雾化给药血清IgA水平显著提高,较之空白对照差异明显(P<0.01)。玉屏风散、利巴韦林、冰香散滴鼻给药血清IgA水平与空白对照组差别不明显(P>0.05)。说明银翘散和冰香散雾化给药有提升机体免疫力的作用。
冰香散滴鼻给药能提升鼻咽部sIgA水平,较之空白对照组差异明显(P<0.05)。其余各组药物鼻咽部sIgA水平与空白对照组差别不明显(P>0.05)。
利巴韦林组给药,支气管-肺泡sIgA水平下降,较之空白对照组差异明显(P<0.05),说明利巴韦林100 mg/kg剂量长期给药对机体免疫有一定的抑制作用。冰香散滴鼻给药,支气管-肺泡sIgA水平有一定的提升,较之空白对照组有一定的差异,但未达到P<0.05的水平(P=0.065),说明冰香散滴鼻对呼吸道sIgA水平有一定的提升作用。
银翘散制剂、玉屏风散制剂、冰香散长期给药对于肠道sIgA水平有一定的提升作用,其中玉屏风散制剂作用明显,较之空白对照组差异明显(P<0.05)。
2.3 中药预防给药对流感病毒感染小鼠黏膜免疫的影响 不同预防方药给药7天,继之感染流感病毒,继续同时给药5天,病毒感染小鼠黏膜免疫情况见表3。
表3 不同预防方药对流感病毒感染小鼠黏膜免疫的影响(±s)Tab.3 Effect of several different preventive herbs on mucosal immunity of mice infected with influenza virus(±s)

表3 不同预防方药对流感病毒感染小鼠黏膜免疫的影响(±s)Tab.3 Effect of several different preventive herbs on mucosal immunity of mice infected with influenza virus(±s)
Note:Compared with virus control group,1)P <0.05,2)P <0.01.
Groups Dosage(g/kg)Number(n)Serum IgA(mg/ml)Nasopharynx sIgA(μg/ml)Bronchiole-alveolar sIgA(μg/ml)Intestimal sIgA(mg/ml).68 90.2±46.8 Ribavirin 0.1 10 1.12±0.352) 0.29±0.16 4.40±1.181) 72.4±23.9 Yinqiao Powder Preparation 40 10 1.92±0.34 0.35±0.26 8.99±1.19 89.9±32.0 Jade Screen Powder Preparation 60 10 1.91±0.41 0.34±0.30 10.38±1.202) 130.1±40.91)Bing-xiang Powder Preparation/Nasal drops 0.03 11 1.82±0.32 0.55±0.381) 9.53±2.25 86.0±24.7 Virus control - 10 1.74±0.42 0.33±0.14 8.19±1 Bing-xiang Powder Preparation/Nebulised inhalation 0.6 11 2.45±0.662) 0.29±0.13 9.99±2.471) 199.6±78.22)
血清IgA水平方面:利巴韦林组呈下降作用,冰香散雾化给药则表现为提升作用,与病毒对照组相比差异明显(P<0.01)。其余各组与病毒对照组差别不明显(P>0.05)。
鼻咽部sIgA水平方面:冰香散滴鼻给药能提升鼻咽部sIgA水平,较之病毒对照组差异明显(P<0.05)。其余各组药物鼻咽部sIgA水平与病毒对照组差别不明显(P>0.05)。
支气管-肺泡sIgA水平方面:利巴韦林组呈降低作用,玉屏风散与冰香散雾化给药表现为提升作用,与病毒对照组差异明显(P<0.05)。银翘散口服与冰香散滴鼻给药支气管-肺泡灌洗液sIgA水平虽有一定程度的提升,但与病毒对照组相比,差异不明显(P>0.05)。
肠道黏液sIgA水平方面:玉屏风散制剂与冰香散雾化表现一定的提升作用,与病毒对照组相比,差异明显(P<0.05~0.01)。其余各组差异不明显(P>0.05)。
3 讨论
黏膜免疫是机体抗感染的第一道免疫屏障,IgA是黏膜免疫系统的主要效应分子[7]。体内IgA按其免疫功能大致可分为血清型IgA和分泌型IgA。血清型IgA存在于血清中,其含量占总IgA的85%左右。血清型IgA介导调理吞噬ADCC作用[8],有类似IgG和IgM的某些功能。分泌型IgA存在于分泌液中(如唾液、泪液、初乳、鼻和支气管分泌液、胃肠液、尿液、汗液等),是机体黏膜局部抗感染免疫的主要抗体,故又称黏膜局部抗体[9]。
流感是一种呼吸道传染病,病毒首先侵袭呼吸道黏膜。病毒感染之初,黏膜上的病毒载量较低,在此阻断病毒的侵袭是最有效的。sIgA通过覆盖在病毒表面,使其不能附着在易感细胞上,从而阻止它们进入或破坏细胞;不需要补体参与就可起到中和病毒的作用,附着在细菌的鞭毛上,让其活动性减弱,并且更容易被巨噬细胞吞噬[10]。呼吸道分泌液中sIgA含量的高低直接影响呼吸道黏膜对病原体的抵抗力,两者呈正相关[11]。
中医药在预防流感方面有较好的效果[12]。本研究表明,银翘散制剂、玉屏风散制剂口服给药及冰香散外用对流感病毒感染鼠有较好的预防作用,能一定程度上减轻感染鼠肺病变程度。
外来抗原(包括病毒、细菌、药物等)进入呼吸道或消化道,局部免疫系统受到刺激后,无需中央免疫系统的参与,自身就可进行免疫应答,产生分泌型抗体,即sIgA。中药预防的三种给药方式:口服、烟薰、芳香佩戴等均可作用于呼吸道或消化道黏膜,激发局部黏膜免疫产生分泌型sIgA,从而起到预防和治疗的效果。
黏膜免疫是区别于全身免疫的局部免疫,黏膜免疫的基础是胃肠道、呼吸道等处存在着大量的淋巴样组织构成完整而普遍的黏膜免疫系统[13]。机体95%以上的感染发生在黏膜或由黏膜入侵机体;同时黏膜既存在局部免疫又存在共同免疫系统,使黏膜免疫细胞相对独立于系统免疫。中药口服、经肠道、喷鼻给药均可诱导共同黏膜免疫应答,有较好的刺激产生呼吸道黏膜免疫的作用[14],这是中药预防流感的主要机制之一。
呼吸道和胃肠道黏膜都是机体黏膜免疫系统的一部分,当一处黏膜发生病变时,可以通过黏膜免疫归巢迁移的途径影响传变到另一处。肠道相关淋巴样组织(GALT)与支气管相关淋巴样组织(BALT)和其他部位黏膜的淋巴样组织一起,形成一个相对独立的免疫应答网络,共同调节人体黏膜的免疫应答[15]。呼吸道黏膜与肠黏膜通过免疫细胞的定向归巢迁移建立起了密切的联系。胃肠道是产生sIgA的主要器官,肠黏膜B细胞分泌的免疫球蛋白中70% ~90%是IgA[16]。肠道发生免疫后,B细胞产生大量的IgA,并由肠道向呼吸道和其它效应部位归巢迁移,这是口服黏膜免疫疫苗及药物口服预防流感的作用原因之一。
本研究表明:玉屏风散制剂对正常小鼠灌胃给药12天可使肠道IgA分泌增加,能使流感病毒感染鼠肠道sIgA分泌增加,支气管肺泡IgA分泌增加。冰香散雾化给药对正常小鼠血清IgA水平有明显的提升作用,对呼吸道及肠道黏膜IgA分泌的影响作用较弱;对流感病毒感染小鼠,除提升血清IgA水平外,对下呼吸道黏膜及肠道黏膜的IgA分泌有明显的促进作用。说明玉屏风散与冰香散雾化能较大提升肠道sIgA水平,同时上调呼吸道分泌型免疫球蛋白A分泌。上述药物能通过共同黏膜免疫途径激活肠道黏膜免疫,进而提升呼吸道黏膜的IgA水平,达到预防流感病毒的作用。有研究表明玉屏风总多糖是玉屏风散免疫干预作用的主要有效成分,能通过肠道过程使免疫低下模型小鼠肠道和呼吸道IgA的分泌增加,玉屏风总多糖通过作用于肠道黏膜,进而影响呼吸道黏膜,乃至整个黏膜免疫系统,并最终表现为全身免疫功能的改变[17]。这为中医临床玉屏风散用于体弱体质人群预防流感提供了黏膜免疫机制上的依据[18]。
鼻腔黏膜免疫IgA抗体对于鼻黏膜及呼吸道病原体感染具有重要意义[19]。鼻部血管分布度高;覆盖鼻部上皮的大量微绒毛细胞为抗原吸附提供了丰富的表面积;鼻腔免疫能同时诱导黏膜和系统免疫应答[20]。药物口服、滴鼻和气雾给药可作用于呼吸道与肠道黏膜下层淋巴系统,被摄取、递呈,激活T细胞,辅助B细胞进行IgA类型转化[21]。由于共同黏膜免疫系统的存在,当特异性B淋巴细胞和T淋巴细胞激活后从NALT迁移至区域淋巴结然后进入血液或胸淋巴循环,这些淋巴细胞归巢并作用于远程呼吸道黏膜部位,产生sIgA抗体作为预防这些部位病原体引起的感染。本研究表明,冰香散滴鼻给药对正常小鼠呼吸道黏膜IgA分泌有明显增加,但对肠道黏膜分泌IgA无明显作用。对流感病毒感染小鼠鼻咽黏膜的IgA分泌有明显的提升作用,但对下呼吸道及肠道黏膜IgA分泌作用不明显。冰香散采用超声波雾化吸入治疗是将药液置于超声波雾化器中,利用电藕合产生震荡,经药液瓶底的薄膜超声作用于药液瓶中的水溶性药物使药液产生直径1~5 μm的气雾出口,鼻吸入气管、支气管、肺泡内直接作用于呼吸道黏膜而激活黏膜免疫系统[22]。从药物组成及成分看,冰香散系含有各种芳香性挥发性精油,可直接作用鼻腔部黏膜,激活产生sIgA,而sIgA抗体形成细胞主要进入血循环,归巢至系统淋巴结或组织炎症部位,可阻止流感病毒在鼻黏膜处的粘附感染与增殖扩散,以切断病毒传播途径,增加局部抵抗力,预防流感的发生,这是中医药芳香疗法“辟疫”、“防瘟”的可能机理所在。
利巴韦林(病毒唑)为广谱的核苷类药物,对多种RNA或DNA病毒体内外都有抑制作用,在体外对金刚烷胺敏感株和耐药株甲型流感病毒均有显著的抑制作用[23,24]。利巴韦林在抑制病毒 DNA 或RNA合成过程中,也可能抑制宿主细胞的DNA或RNA合成,故临床上利巴韦林的副作用往往随药物总量和疗程的增加而逐渐增大。本研究发现:正常小鼠口服给予利巴韦林100 mg/kg剂量,12天,支气管-肺泡分泌的IgA水平下降;对病毒感染小鼠的血清IgA及支气管-肺泡分泌的IgA水平也表现出降低作用,说明利巴韦林对黏膜免疫IgA的分泌有一定的抑制作用,这可能与利巴韦林较大剂量(100 mg/kg)及较长时间给药(12天)有关。亦有研究表明,利巴韦林有明显的免疫抑制作用:利巴韦林可抑制细胞免疫反应,使小鼠脾脏T细胞对ConA的增殖反应明显降低[25];还可使幼鼠胸腺发育受抑制、胸腺萎缩、重量减轻;对非特异性免疫功能也有抑制作用。表明利巴韦林用于流感病毒的治疗除与其干预病毒的复制环节外,还有可能与它的免疫抑制作用减轻了病毒感染的炎症反应有关[26]。从预防的角度而言,利巴韦林对黏膜免疫的抑制作用似乎不宜推荐作为流感病毒的预防性长期用药。
银翘散制剂给予正常小鼠口服给药12天,血清IgA水平增加,但呼吸道及肠道黏膜IgA分泌未见明显增加。对流感病毒感染鼠呼吸道及肠道黏膜IgA分泌亦未见明显影响,说明银翘散对流感病毒感染鼠的黏膜免疫作用较弱,其预防流感的作用可能通过其他免疫途径而实现。
实际上IgA表达的每一步都是受细胞因子控制的。IgA的产生需要T细胞的帮助,来自黏膜相关淋巴组织(MALT)的T细胞对IgA的产生起非常重要的作用,但是,仅有T细胞并不能有效诱导IgA的产生,这一过程还受Th1/Th2细胞因子的调节。此外,T细胞能直接调节IgA应答。在呼吸道黏膜中还分布有大量的树突状细胞(DC),其活化与否对黏膜的免疫应答也有调节作用[27-29]。因此,中药通过干预调节黏膜免疫来预防流感的具体机制尚有待于进一步的研究。
1 杨晓昀.从中医学试论甲型H1N1流感的防治[J].中国医学创新,2010;7(6):136-137.
2 Clements M L,Betts R F,Tierney E L et al.Serum and nasal wash antibodies associated with resistance to experimental challenge with influenza A wild-type virus[J].J Clin Microbiol,1986;24:157-161.
3 Reneagar K B,Amall P A.Immunoglobulin A mediation of murine nasal anti-influenza virus immunity [J].J Virol,1991;65:2146-2150.
4 孙翠娥,杨笃然,丁正琪et al.中草药烟熏对空气消毒及预防呼吸道传染病作用的研究[J].现代生物医学进展,2007;7(12):1884-1885.
5 徐培平,刘 妮,丁 伟 et al.中药预防流感的作用及其机制[J].热带病与寄生虫学,2011;4(9):246-248.
6 陈 奇.中药药理研究方法学[M].第3版.北京:人民卫生出版社,2011:1103-1105.
7 曾常茜.分泌型IgA在黏膜抗感染中的作用[J].北华大学学报(自然科学版),2005;6(1):33-35.
8 Tagliabue A,Nencioni L,Villa L et al.Antibody-dependent cell mediated antibacterial activity of intestinal lymphocytes with secretory IgA [J].Nature,1983;306(5959):184-186.
9 Bomsel M.Transcytosis of infectious human immunodeficiency virus across a tight human epithelial cell line barrier[J].Nat Med,1997;3:42-47.
10 张宝中,冉多良,童贻刚.分泌型免疫球蛋白A的研究进展[J].生物技术通讯,2009;20(2):263-265.
11 Mazanec M B,Nedrud J G,Kaetzel C S et al.A three-tiered view of the role of IgA in mucosal defense[J].Immunol Today,1993;14:430-435.
12 苏惠萍,沈 蔷,武维屏et al.中医预防方案干预社区流感的随机对照研究[J].北京中医药大学学报,2010;33(10):690-694.
13 黄孝文.上呼吸道黏膜免疫和免疫病理[J].国外医学·耳鼻咽喉科学分册,1999;23(5):274-276.
14 李清艳,史书军,翟向和 et al.气雾免疫在禽病防治中的应用[J].兽医导刊,2007;21(3):30-32.
15 靳文学,杨 宇.从黏膜免疫系统看“肺与大肠相表里”[J].四川中医,2005;23(12):1-3.
16 MacDonald T.The mucosal immune system [J].Parasite Immunol,2003;25(5):235-238.
17 张 磊,李东晓,吴 瑕et al.玉屏风散总多糖影响肠道黏膜损伤小鼠肠-呼吸道分泌研究[J].中药药理与临床,2007;23(5):43-45.
18 闰跃龙,姜惠明.中医方剂玉屏风散预防流感[J].中国社区医师·医学专业半月刊,2010;12(12):23-24.
19 Ichinohe T,Watanabe I,Ito S et al.Synthetic double-stranded RNA poly(I:C)combined with mucosal vaccine protects against influenza virus infection [J].J Virol,2005;79(5):2910-2919.
20 陈怡婷,曹 炬,李岱容et al.ClpP黏膜免疫预防小鼠发生肺炎链球菌性肺炎和败血症[J].中国免疫学杂志,2009;25(6):556-560.
21 Wu H Y,Nguyen H H,Russell M W.Nasal lymphoid tissue(NALT)as a mucosal immune inductive site[J].Scand J Immunol,1997;46:506-513.
22 郭玉环,孔 丽,付桂才et al.中药雾化吸入治疗毛细支气管炎临床研究[J].济宁医学院学报,2001;24(4):49-50.
23 占扬清,关文达,王玉涛et al.金刚烷胺与利巴韦林对不同甲型流感病毒株的体外作用敏感性比较[J].热带医学杂志,2010;10(9):1058-1061.
24 高荣梅,李兴琼,何维英et al.利巴韦林注射液体内外抗流感病毒作用研究[J].药学学报,2010;45(3):403-407.
25 陈其御,杨建勤.利巴韦林在体外对小鼠脾细胞NK活性的影响[J].药学学报,1995;30(6):417-421.
26 南景一,孙晓兰,高 梅et al.利巴韦林对幼鼠免疫功能的影响[J].中国医院药学杂志,1997;17(7):299-300.
27 Neurath M F,Finotto S,Glimcher L H.The role of TH1/TH2 polarization in mucosal immunity[J].Nat Med,2002;8:567-573.
28 Oman S,Jansen H M,Out T A et al.Interleukin-4 and interferongamma synergistically increase secretary component gene expression,but are additive in stimulating secretary immunoglobulin A release by calu-3 airway epithelial cells[J].Immunology,1999;96(4):537-543.
29 Heystek H C,Moulon C,Woltrnun A M et al.Human immature dendritic cells efficiently bind and take up secretory IgA without the induction of maturation[J].J Immunol,2002;168(1):102-107.

