可溶性死亡受体5在化疗前后肺癌患者外周血中的检测①
朱诗白 杨永杰 刘瑞敏 张爱红 孙颍川 白慧玲
(河南大学医学院免疫学研究所河南大学细胞与分子免疫学重点实验室,开封475004)
随着细胞凋亡研究的深入,发现凋亡参与了许多疾病的病理损伤。肿瘤坏死因子相关的凋亡诱导配体(TNF-related apoptosis-inducing ligand,TRAIL)是新近发现的TNF家族新成员,由于其能够诱导肿瘤细胞凋亡,而对正常细胞无影响[1],从而成为国际上的研究热点。而其主要受体DR5是肿瘤坏死因子受体超家族成员,在多种肿瘤组织中高度表达。在调节细胞增殖、凋亡中发挥重要作用,与肿瘤的发生发展密切相关[2]。目前的研究多集中在DR5抗体的制备及其诱导细胞凋亡的作用机制等方面[3]。但TRAIL受体-DR5脱落或分泌与体液后的消退情况与肿瘤的发生、发展及预后是否有关,尚未见报道,该方面将会是TRAIL研究中值得探讨的新领域。
基于以上原因我们利用基因工程技术制备人TRAIL受体DR5,进而制备抗DR5的单克隆抗体和抗DR5多可隆抗体[4-5]。建立了检测可溶性 DR5(sDR5)的双抗夹心ELISA法[6],为检测肿瘤患者体液中sDR5量提供一种简单、特异的检测方法。并且检测了肺癌病人治疗前后血清中sDR5的含量变化,发现肿瘤病人血清中sDR5的含量高于正常人群,而治疗后病人血清中sDR5含量明显降低,希望此发现为我们探讨肿瘤的发生机制、肿瘤预后,提供新的思路和新的指标。
1 材料与方法
1.1 研究对象 本研究中所有研究对象健康人群组和肺癌患者组来自河南大学淮河医院及安阳市肿瘤医院,其中肿瘤患者组79例,健康人群组106例,均为男性,年龄分布见表1。
肿瘤患者组:肿瘤病例均来源于2008年5月~2011年3月在淮河医院及安阳市肿瘤医院确诊的肿瘤患者。正常人群组:选择同期年龄相匹配的在门诊健康体检者作为正常人群组,正常人群组所有入选者均无肿瘤病史、症状及体征。经均衡性检验,肿瘤组和健康组的年龄均无显著差异(P=0.14,P=0.25),见表2。表明本研究所收集资料偏差小,可信度高,数据可靠。
1.2 血样采集 取住院后肺癌患者手术化疗一个疗程前后及健康体检者清晨空腹全血3 ml,及时分离血清,避免溶血及高血脂标本,密闭冻存于-20℃,集中测定。
1.3 材料与试剂 DR5纯品(由宾夕法尼亚大学医学院陈有海惠赠的重组毕氏酵母通过同源重组分泌高水平sDR5,经用Ni-NTA纯化);鼠抗人DR5单克隆抗体、兔抗人 DR5多克隆抗体均为本室制备[4,5];辣根过氧化物酶标记的羊抗兔 IgG、96 孔微孔板(购于上海基因生物工程有限公司);酶联免疫分析仪:model354,芬兰Labsystems公司生产;酶联微量反应板:丹麦Nunc公司生产;TMB显色液:Sigma公司;碳酸盐包板液、ELISA封闭液、PBS洗板液自行配制。
1.4 检测sDR5夹心ELISA方法的建立 用2.5 μg/ml抗DR5单抗包被酶标板,4℃孵育24小时,PBS洗涤后加5%小牛血清封闭,4℃孵育24小时,洗涤,加倍比稀释的DR5标准品,100 μl/孔,37℃孵育1 小时洗涤,加兔抗 DR5 多抗(5 μg/ml),100 μl/孔,37℃孵育1小时,充分洗涤,加入1∶2 000稀释的HRP标记的羊抗兔 IgG,100 μl/孔,37℃孵育1小时,洗涤8次后加入TMB底物(Sigma),37℃孵育15分钟,2 mol/L H2SO4终止反应,酶联免疫分析仪:model354测定A450。以DR5标准浓度为横坐标,A值为纵坐标,绘制标准曲线[6]。

表1 研究对象、年龄Tab.1 Objects studied,age distribution

表2 病例组与对照组的均衡性检验Tab.2 Balanced test of cases and control groups
1.5 血清中sDR5的检测 根据上述建立的检测DR5的方法,加入100 μl正常人或肺癌患者治疗前后血清标本(每个血清标本3个复空),余步骤相同,通过标准曲线查到相应标本中的DR5含量,重复3次,取平均值。
1.6 统计学分析 所有统计分析使用SPSS13.0软件。正常人群及肺癌患者之间血清DR5抗体OD值差异使用One Way ANOVA方法进行分析。
2 结果
2.1 正常人群中血清sDR5的检测 通过对这106名健康人群的血清样本进行ELISA夹心测定,发现正常人群血清中sDR5含量近正态分布,为(6.25±3.09)μg/L,大部分正常人血清中sDR5含量均在10 μg/L 以下(图1)。
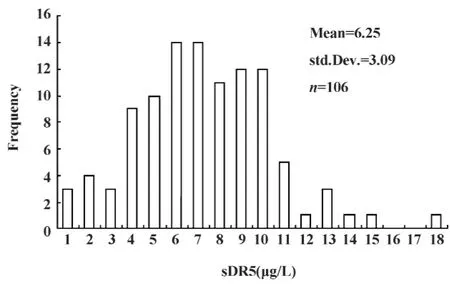
图1 正常人群中血清sDR5含量Fig.1 The content of sDR5 in normal serum crowd
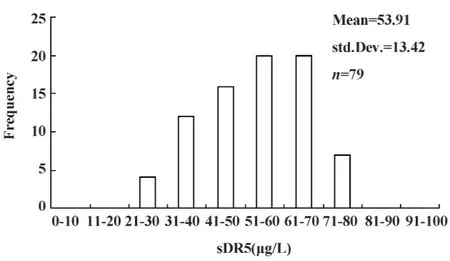
图2 肺癌患者血清中sDR5含量Fig.2 The content of sDR5 in lung cancer serum crowd
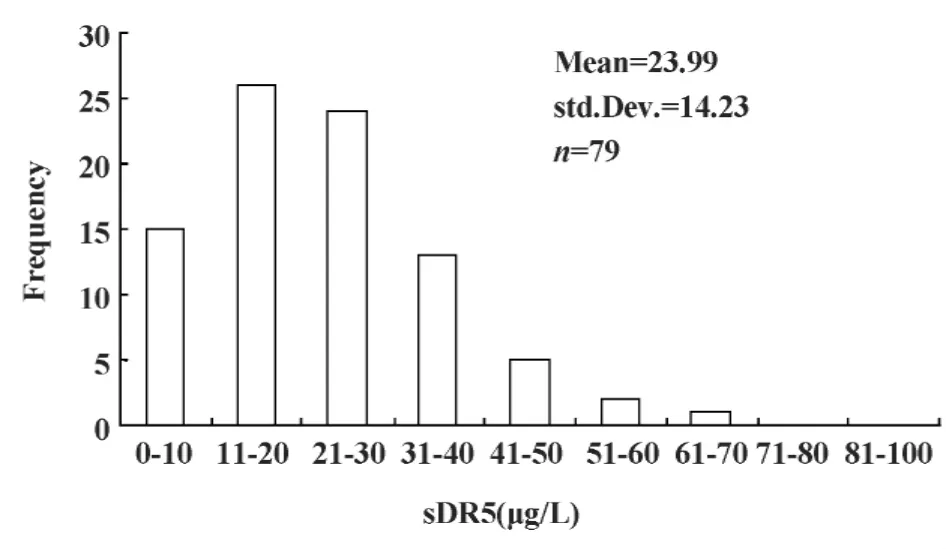
图3 肺癌患者治疗后血清中sDR5含量Fig.3 The content of sDR5 in lung cancer serum crowd after treatment
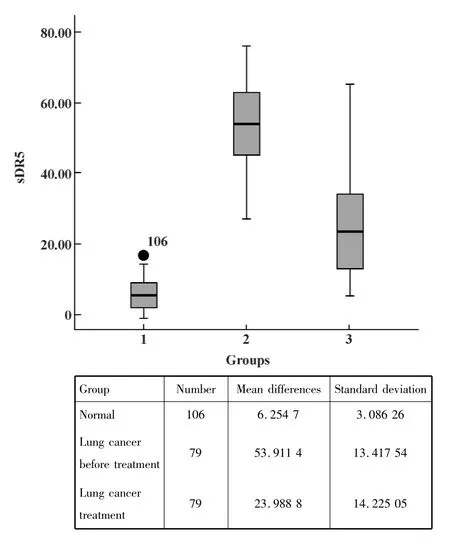
图4 肺癌患者与正常人群血清中sDR5含量的比较Fig.4 Comparison of value of sDR5 in patients with lung cancer and normal serum crowd
2.2 肺癌患者中sDR5的检测 肺癌患者治疗前血清中sDR5的水平近正态分布,所有肺癌患者血清中sDR5的水平均高于10 μg/L,明显高于正常人群,为(53.91±13.42) μg/L,见图2。79例肺癌患者化疗后肺癌患者血清中sDR5水平明显降低,呈偏态分布,为(23.99±14.23) μg/L,见图3。
2.3 肺癌患者与正常人群血清中sDR5的比较正常人群与肺癌患者的血清中sDR5的水平存在差异,肺癌患者的sDR5含量在(53.91±13.42)μg/L明显高于正常人群(6.25±3.09)μg/L,P<0.001,见图4。肺癌患者手术后化疗一疗程后血清中sDR5水平明显比治疗前降低(23.99±14.23)μg/L,P<0.01,见图4。
3 讨论
肿瘤形成及转移是一复杂的多阶段连续过程,受多种因素的影响[7,8],由于免疫系统的监视和清除,使大部分的恶性细胞在早期被体内正常的免疫系统清除[9]。
死亡受体5(DR5)属于肿瘤坏死因子受体超家族,主要表达于肿瘤细胞,而在正常细胞不表达或者表达低,其配体TRAIL与其结合启动细胞内的信号转导,诱导细胞凋亡[10]。DR5为Ⅰ型跨膜蛋白,表达于胎儿肝脏、肺脏,成人外周血、卵巢、脾脏、肝脏、肺脏等[11]。很多研究发现TRAIL分子不但在肿瘤患者血清升高,在高血压、冠心病、心肌病等引起的心衰患者血清亦升高[12]。而TRAIL受体-DR5脱落或分泌与体液后的消退情况与肿瘤的发生、发展及预后是否有关,尚未见报道,该方面将会是TRAIL研究中值得探讨的新领域。为此我们采用基因工程技术制备大量的DR5,进而制备抗DR5的两株特异性单克隆抗体,旨在建立一种检测可溶性DR5的夹心ELISA方法,为检测肿瘤患者体液中DR5量提供一种简单、特异的检测新方法,为sDR5的基础和临床应用研究提供了有力的手段。
我们的检测结果显示,正常人群与肺癌患者的血清中sDR5的水平存在差异,肺癌患者的sDR5含量在(53.91±13.42)μg/L明显高于正常人群(6.25±3.09) μg/L,P<0.001。肺癌患者手术后化疗一疗程后血清中sDR5水平明显比治疗前降低(23.99±14.23)μg/L,P<0.01。一定程度上揭示了肿瘤细胞可能会通过细胞表面DR5脱落方式阻止或延缓凋亡的发生,以利于其自身的生存。大量的肿瘤细胞死亡,DR5被清除,所以肿瘤化疗后血清中sDR5水平明显降低。所以sDR5水平在肿瘤病人不同时期含量不同,进行血清DR5的检测有可能作为判断肿瘤的发生、发展及预后的一个指标。希望此发现能为我们探索肿瘤新的诊断指标提供新思路[13]。
1 Wiley S R,Schooley K,Smolak P J et al.Identification and characterization of a new member of the TNF family that induces apoptosis[J].Immunity,1995;3:673-682.
2 Link H,Xiao B G.Rat models as tool to develop new immunothera-pies[J].Immunol Rev,2001;184(1):117-128.
3 Poulas K,Tsouloufis T,Tzartos S J.Treatment of passively transferred experim ental autoimmune myasthenia gravis using papain[J].Clin Exp Immunol,2000;120(2):363-368.
4 白慧玲,赵粤萍,刘广超et al.抗死亡受体-5单克隆抗体的制备及特性鉴定[J].细胞与分子免疫学杂志,2006;22(4):514-520.
5 白慧玲,裴景堂,杜耀武et al.兔抗人DR5分子多克隆抗体的制备与初步应用[J].免疫学杂志,2008;24(6):634-637.
6 白慧玲,刘广超,赵粤萍et al.检测DR5双抗体夹心ELISA方法的建立及应用[J].河南大学学报(医学版),2007;26(1):21-24.
7 Kaplan D H,Shankaran V,Dighe A S et al.Demonstration of an interferon gamma-dependent tumor surveillance system in immunocompetent mice[J].Proc Natl Acad Sci USA,1998;95(13):7556-7561.
8 Shankaran V,Ikeda H,Bruce A T et al.IFNgamma and lymphocytes prevent primary tumour development and shape tumour immunogenicity[J].Nature,2001;410(6832):1107-1111.
9 Ellyard J I,Avery D T,Phan T G et al.Antigen-selected,immunoglobulin-secreting cells persist in human spleen and bone marrow[J].Blood,2004;103(10):3805-3812.
10 Radbruch A,Muehlinghaus G,Luger E O et al.Competence and competition:the challenge of becoming a long-lived plasma cell[J].Nat Rev Immunol,2006;6(10):741-750.
11 Sheriden J P,Marsters S A,Pitti R M et al.Control of TRAIL-induced apoptosis by a family of signaling and decoy receptors[J].Science,1997;277(5327):818-821.
12 洪 燕,李 源,王晓明et al.老年心力衰竭患者血浆可溶性TRAIL和受体DR5水平的变化[J].心脏杂志,2003;15(2):118-120.
13 王艳鸽,李燕杰,都景芳et al.正常人群中DR5天然自身抗体的分布特点及与肿瘤患者的差异分析[J].中国免疫学杂志,2010;26(9):797-809.

