氨氯地平对ox-LDL诱导人单核巨噬细胞MMP-9表达的影响1)
宋海彬,高 振,申晓彧
冠状动脉粥样硬化斑块由稳定转为不稳定,继而破裂导致血栓形成,是急性冠脉综合征(ACS)最主要的发病机制[1]。基质金属蛋白酶-9(matrix metalloproteinase 9,MMP-9)是 MMPs家族中的重要成员,是细胞外基质(extracellular matrix,ECM)代谢的关键酶之一,在动脉粥样斑块处的血管重构、斑块的不稳定及破裂诱发的ACS中都起着十分重要的作用[2]。
氨氯地平(Amlodipine)是广泛用于临床的第三代新型长效二氢吡啶类钙通道阻滞剂(calcium channel blockers,CCB),临床上主要应用于高血压治疗的一线用药。
1 材料与方法
1.1 研究对象 健康成人静脉血液来自山西医科大学第二临床医院体检中心;人淋巴细胞分离液(Lymphocytes Separation Medium1077)为上海华精生物高科技有限公司产品;RPMI-1640培养液;胎牛血清为杭州四季青公司产品;佛波酯购自美国SIGMA公司;氧化低密度脂蛋白(ox-LDL)为北京协生生物科技有限公司产品;FITC-CD14抗体购自日本Beckman Coulter公司。RNA提取试剂盒(TransZol)购自北京全式金生物技术公司;逆转录-多聚酶联反应(RT-PCR)试剂盒购自北京全式金生物技术公司;引物序列由上海生工生物有限公司合成;酶联免疫(ELISA)试剂盒购自美国R&D公司;氨氯地平为辉瑞公司馈赠。
1.2 巨噬细胞分离、培养、诱导和鉴定 取肝素抗凝静脉血30 mL分装到10个离心管,用RPMI-1640液稀释1倍并充分混匀,分别缓慢加入等比例淋巴细胞分离液于离心管中,2 000 r/min离心20min后,吸取中间环状云雾状淋巴细胞层,再以3 mLPBS液充分混匀,1 500r/min离心洗涤2次;用含10%胎牛血清的RPMI-1640各5mL将细胞吹开混匀,取细胞悬液至培养瓶,每瓶4mL,于37℃、5%CO2培养箱中孵育,培养至4代后于细胞指数生长期进行诱导转化实验。诱导转化时,以40 ng/mL的PAM无胎牛血清RPMI-1640培养液继续培养48h~72 h,待细胞转化为巨噬细胞后以RPMI-1640培养液洗涤3次,置于10%胎牛血清的RPMI-1640培养液中继续培养48h。台盼蓝染色法测定细胞存活率。用特异性荧光素标记的CD14细胞表面抗体行流式细胞术进行单核细胞源性巨噬细胞鉴定。
1.3 试验分组 试验共分5个组。空白对照组,不进行任何干预,仅单独培养单核巨噬细胞24h;ox-LDL对照组,只加入ox-LDL 100mg/mL孵育24h;试验三组分别加入100mg/mL ox-LDL孵育2h后,再分别加入氨氯地平低剂量0.1μmol/L;中剂量1.0μmol/L;高剂量10.0μmol/L培养24h。
1.4 半定量RT-PCR检测MMP-9mRNA的表达水平
1.4.1 RNA提取 弃培养瓶中的培养液,每瓶加入1.0mL Trizol,依次加入氯仿、异丙醇沉淀,75%乙醇洗涤后略晾干,溶于25μL DEPC中。核酸紫外分析仪检测,根据260/280比值,所有样品A260/A280比值1.9~2.0。并根据260nm的吸光度值对样品的总RNA进行初步定量,确定样品中RNA纯度和含量。
1.4.2 反转录反应 反转录反应在20μL体系中进行:含1μg RNA,20mg/L 的 oligo(dT)引 物,1.0mml/L dNTP,20U Rnase抑制剂,1×Buffer,200UM-MLV反转录酶。于PCR仪上42℃反应1h,72℃灭活10min后保存于-20℃冰箱中。
1.4.3 PCR扩增反应 MMP-9上游引物序列为:5′-TCCCTGGAGACCTGAGAACC-3′; 下 游 引 物 序 列 为:5′-GGCAAGTCTTCCGAGTAGTTT-3′。PCR反应条件:95℃预变性5min,94℃变性30s,58℃退火60s,72℃延伸60s,循环29次;末次延伸7min,产物长度为307bp。B-actin上游引物序列:5′-CCTGAGGCACTCTTCCAG-3′,下 游 引 物 序 列:5′-TCACACTTCATGATGGA-3′,产物大小100bp。
1.4.4 凝胶电泳 取PCR产物10μL在琼脂糖凝胶上电泳,计算机凝胶成像系统扫描拍照,Toptal软件分析灰度值,以各条带与β-actin内参条带灰度比值,代表 MMP-9mRNA转录水平。
1.5 酶联免疫吸附双抗体夹心法测定MMP-9蛋白含量 取六孔培养板上清液进行酶联免疫吸附双抗夹心法(enzyme linked immuno-sorbent assay,ELISA)测定,每组重复6次。
1.6 统计学处理 计量资料以均数±标准差(x±s)表示,用SPSS 13.0建立数据库,采用单因素方差分析,组间两两比较采用LSD-t检验。
2 结 果
2.1 ox-LDL诱导的单核巨噬细胞MMP-9mRNA表达 与空白对照组比较,ox-LDL各组MMP-9mRNA表达明显增加(P<0.05);与ox-LDL对照组比较,不同剂量氨氯地平组MMP-9 mRNA表达明显降低(P<0.05);ox-LDL诱导后,不同剂量氨氯地平各组之间比较,随着氨氯地平剂量增加,MMP-9mRNA表达逐渐降低(P<0.05)。详见表1。
2.2 ox-LDL诱导的单核巨噬细胞MMP-9蛋白表达 与空白对照组比较,ox-LDL对照组MMP-9蛋白表达明显增加(P<0.05);与ox-LDL对照组比较,不同剂量氨氯地平组MMP-9蛋白表达明显降低(P<0.05)。ox-LDL诱导后的不同剂量氨氯地平组之间比较,随着氨氯地平剂量增加MMP-9蛋白表达逐渐降低(P<0.05)。详见表1。
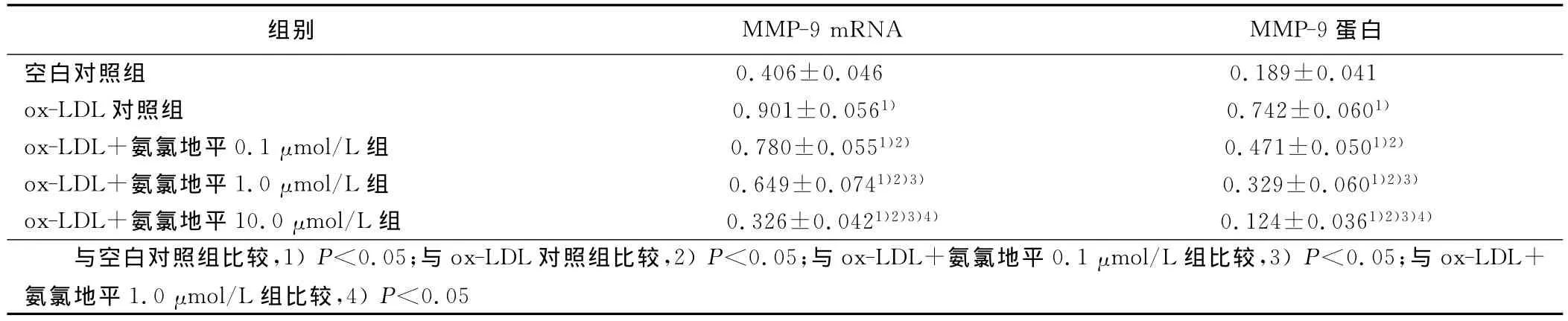
表1 各组MMP-9mRNA和蛋白水平(x±s)
3 讨 论
心血管疾病病理基础是动脉粥样硬化,而血栓的形成与炎症反应在动脉粥样硬化的形成和发展过程中的作用非常重要。冠状动脉粥样硬化斑块由稳定转为不稳定,继而破裂导致血栓形成,是急性冠脉综合征最主要的发病机制[1]。粥样硬化斑块破裂以及血栓介导的急性心肌梗死最重要的决定因素是斑块的组成成分,单核巨噬细胞的聚集,以及合成MMPs的增多和/或内源性基质金属蛋白酶抑制物减少,是造成粥样斑块纤维帽厚度和抗损伤强度降低,斑块稳定性下降的重要因素[3]。
基质金属蛋白酶降解细胞外基质致纤维帽变薄破裂,是急性冠脉综合征临床事件发生的重要原因,MMP-9是其中重要一员[4]。MMP-9由活化的巨噬细胞、T淋巴细胞、中性粒细胞等以蛋白酶原前体的形式从细胞内分泌到细胞外,MMP-9的作用底物有明胶、Ⅳ型和Ⅴ型胶原、蛋白聚糖、弹性蛋白。MMP-9活性增强可导致胶原裂解增加[5]。在动脉粥样硬化斑块局部,MMPs主要来源于激活的巨噬细胞和泡沫细胞。近年来有研究发现,在人动脉粥样硬化斑块容易发生破裂的部位(尤其是斑块肩部和脂质核处),MMP-1、MMP-2、MMP-9和MMP-3活性均有增高[6]。
氧化低密度脂蛋白作为独立的危险因素在动脉粥样硬化的发生发展及急性冠脉综合征形成中占有重要的地位,在动脉粥样硬化中ox-LDL除了直接导致内皮损伤外,还可以引起单核细胞趋化、巨噬细胞源泡沫细胞形成和细胞毒性产生 ,并且可以调节粥样斑块内血管内皮细胞、平滑肌细胞和巨噬细胞等多种细胞和生长因子的合成[7]。ox-LDL可增加单核细胞源巨噬细胞MMP-9的蛋白表达并增强其活性,是细胞功能和基因表达的主要调节因子[8]。
氨氯地平可能机制有抗氧化、抗炎、改善内皮功能、抑制血管平滑肌增殖与迁移、保持斑块稳定性等[9]。
本研究用ox-LDL诱导人单核巨噬细胞24h后,与单核巨噬细胞组相比,MMP-9mRNA及其蛋白表达增加,与文献报道一致;ox-LDL诱导人单核巨噬细胞2h后,加入不同剂量的氨氯地平,与ox-LDL空白对照组相比,MMP-9的表达减少且与氨氯地平的剂量有浓度剂量依赖关系。氨氯地平可通过抑制ox-LDL诱导的人单核巨噬细胞MMP-9的表达,发挥稳定粥样斑块和抗炎的作用,减少急性冠脉事件的发生,但其通过何种途径减少MMP-9的表达,还有待进一步研究。
[1] Libby P,Theroux P.Pathophysiology of coronary artery disease[J].Circulation,2005,111:3487-3488.
[2] Yla-Hrttuala S,Lipton BA,Rosenfeld ME,et al.Expression of monocyte chemoattractan protein-1in maceophage-rich areas of human and rabbit atherosclerosis lesions[J].Proc Natl Acad Sci USA,1991,88(12):5252-5256.
[3] Newby AC.Dual role of matrix metalloproteinases(matrixins)in intimal thickening and atherosclerotic plaque rupture[J].Physiol Rev,2005,85(1):1-31.
[4] Shah PK,Falk E,Badimon JJ,et al.Human monocyte derived macrophages induce collagen breakdown in fibrous caps of atherosclerotic plaques.Potential role of matrix-degrading metalloproteinases and implications for plaque rupture[J].Circulation,1995,92(6):1565-1569.
[5] Nonoto K,Oguchis W,Alanabn,et al.Involvement of inflamrnation in acute coronary syndormes assessed by levels of high-sensitive C-reactive protein,matrix metalloproteinase-9and soluble vascular-cell adhesion molecule-1 [J].J Cardio1,2003,42(5):201-206.
[6] Galis ZS,Sukhova GK,Lark MW,et al.Increase expression of matrix metalloproteinases and matrix degrading activity in vulnerable regions of human atherosclerotic plaques[J].J Clin Invest,1994,94(6):2493-2503.
[7] Steinberg D.Oxidative modification of LDL and atherogenesis[J].Circulation,1997,95(4):1062-1071.
[8] Xu XP,Meial SR,Ong JM,et al.Oxidized low density lipoprotein regulates matrix metalloproteinase-9and its tissue inhibition in human monocyte-derived macrophages[J].Circulation,1999,99(8):993-998.
[9] 徐丽梅,涂玉林.氨氯地平抗动脉粥样硬化研究进展[J].中国动脉粥样硬化杂志,2008,3(15):241-243.

