平菇原生质体单核化菌株的制备及其培养特征分析
努尔孜亚·亚力买买提,赵梦然,罗 影,郝敬喆,魏 鹏,贾文捷,贾培松,温切木·阿布列孜
(1. 新疆农业科学院植物保护研究所/农业部西北荒漠绿洲作物有害生物综合治理重点实验室,乌鲁木齐 830091;2. 中国农业科学院农业资源与农业区划研究所/国家食用菌产业技术研发中心,北京 100081 ;3. 阿勒泰市菜篮子工程办公室,新疆阿勒泰 836500)
0 引 言
【本研究意义】平菇(oyster mushroom)隶属于真菌界、担子菌门 、蘑菇纲、蘑菇目、侧耳科、侧耳属(Pleurotus),其肉质肥厚,味道鲜美,营养丰富,具有很高食用和保健价值[1]。平菇栽培具有显著的经济效益,2002 年我国平菇年总产量 100 ×104t以上,社会产值超过 30 ×108元。2006 年全国平菇总产量达 397 ×104t,平菇具有较强的木质素和纤维素分解能力,年产量长年在500×104t左右。目前平菇产业发展面临着品种由于长期无性繁殖而菌种退化明显、产量不稳、育种手段单一等实际问题,亟待选育新的平菇优良品种,加速品种更新换代[2-3]。【前人研究进展】原生质体技术是现代农业生物技术的一个重要分支[4-5],研究担子菌的原生质体制备技术,将此技术应用于平菇、香菇、金针菇等多种食用菌中发现,单核原生质体是异宗结合食用菌菌丝制备原生质过程中的一个普遍现象[6]。选用食用菌野生资源或具有优良性状的栽培种质资源,利用原生质体单核化技术制备单核体,使用再生获得的单核菌株进行杂交育种已经成为多种食用菌新品种选育普遍采用的一种手段[7-8]。【本研究切入点】原生质单核化现象是原生质体技术在食用菌遗传和育种研究中的一个重要分支,由于单核原生质体具有特殊的遗传背景,在理论上是研究其基因定位和遗传性状的重要材料,在育种上形成以单核原生质体为材料的新方向,具有广阔的应用和推广前景,从细胞水平上探索一条食用菌育种新途径,为发展和完善食用菌新菌株选育提供依据[9-11]。【拟解决的关键问题】采用原生质体单核化技术进行平菇新菌株的选育,对平菇原生质体制备及再生条件进行优化,将得到的原生质体单核菌株与出发菌株在菌落形态、菌丝长速和长势等方面的差异进行比较,评价供试菌株的多样性水平,为平菇新品种选育提供创制材料及基础数据支撑。
1 材料与方法
1.1 材 料
1.1.1 菌株
平菇菌株4453、4062、4072、457、504、1105、1118、3780、3778、4010、4100、1709、4117、4131、4159、4181、4440、4146、338均由中国农业科学院农业资源与农业区划研究所提供,所有菌株均保藏于国家食用菌标准菌株库(CCMSSC)。
1.1.2 供试培养基
(1) PDA(Potato Dextrose Agar)培养基:马铃薯 200 g,葡萄糖 20 g,琼脂 20 g,补水至 1 L,pH自然(约为7.0);121℃,高压蒸汽灭菌30 min。
(2)PDA 液体培养基:马铃薯 200 g,葡萄糖 15 g,补水至 1 L,pH自然(约为7.0);121℃高压蒸汽灭菌30 min。
(3)MYG 再生培养基:麦芽糖 10 g,葡萄糖 4 g,酵母膏 4 g,0.6 M甘露醇,琼脂粉 20 g,补水至1 L,121℃高压蒸汽灭菌30 min,用于原生质体菌丝培养。
1.1.3 供试试剂
(1)0.6 M甘露醇:称取Journal of fungus甘露醇,补水至1 L,121℃高压蒸汽灭菌30 min。
(2)2%溶壁酶:20 mL的0.6 M甘露醇溶液加入0.4 g溶壁酶,摇匀,0.22 μm微孔滤膜过滤除菌。
1.2 方 法
1.2.1 菌丝体培养
将保存菌株接种至PDA 综合培养基平板活化,纯化后,取豆粒大小菌块接种至PDA培养基,25℃黑暗静置培养5 d备用。
1.2.2 原生质体的制备
将菌丝体接入PDA 液体培养基,25℃静止培养 5~6 d,待长出菌丝球后在无菌操作条件下,将液体培养基与菌丝经筛子过滤,去除培养基。筛子中菌丝体用无菌水冲洗,再用0.6 M甘露醇冲洗离心(2 000 r/min,5 min)2次。然后用滤纸吸干水分,将菌丝体转移至10 mL无菌离心管中,加入3 mL 2%的溶壁酶,30℃水浴锅中酶解,每隔30 min摇动1次,加快酶解速度。酶解结束后,将菌丝体/溶壁酶混合液倒入加有棉塞的灭菌注射器,过滤除去断裂菌线,将滤液于3 000 r/min离心10 min,用移液枪吸掉上部液体(不要吸光,留少许),收集沉淀,用0.6 M甘露醇稀释。
1.2.3 原生质体制备最适酶解时间检测
选取13个菌株进行最适酶解时间检测,原生质体制备过程中,设定取样镜检时间:1、1.5、2、2.5、3、3.5和4 h,镜检测得各时间节点原生质体数量,根据各菌株原生质体释放量曲线,分析确定最适酶解时间,每个菌株设3个重复。
1.2.4 原生质体再生
吸取 100 μL原生质体稀释液均匀涂布于再生培养基平板上,于25℃黑暗培养,从而获得原生质体再生菌株。
1.2.5 原生质体再生菌株镜检
在显微镜下,从再生培养基上生长的菌落中挑选菌落小、生长缓慢的单个菌落,接种至PDA斜面培养基,待菌丝长到 1 cm 左右时进行镜检,根据菌丝形态、有无锁状联合等特征,判断和挑选目标菌株。
1.2.6 菌丝培养特征
将出发菌株和筛选的原生质体单核菌株分别接种至PDA培养基平板活化,待菌落长至5~7 cm大小时,使用打孔器沿菌落边缘取相同菌龄直径为5 mm的菌饼接种至PDA平板中央,于25℃暗培养。每天观察菌丝生长情况,定期统计菌丝培养特征,包括:菌丝长速、菌丝浓密度、气生菌丝浓度和菌丝长势等指标。采用“十字”交叉法测量菌落直径,计算菌丝生长速度,每种菌株设3个重复。
1.3 数据处理
应用Excel 2010,SPSS 19.0软件对数据进行数据处理、单因素方差分析(AVNOA)。
2 结果与分析
2.1 原生质体制备最适酶解时间
研究表明,各菌株原生质体释放量随酶解时间延长呈先升高再降低的趋势,11个菌株在酶解处理3.5 h时原生质体释放量最大,占总数的的84.6%,2个菌株(4 131,4 146)在4 h时达最大;各菌株原生质体释放量存在一定差异,处理3.5 h时,菌株4 146原生质体释放量最大,可达2.12×107个/ml,其次为菌株4 131和1 118,其他菌株差异不明显。酶解处理3.5 h是原生质体取样的最佳时间。图1~2
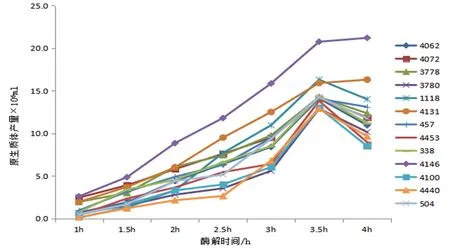
图 1 原生质体产量随酶解时间变化
Fig. 1 The curve of protoplast yield with different enzymolysis time
图 2 平菇释放出原生质体(10×400)
Fig. 2 The protoplasts released by Ganoderma Lucidum(10×400)
2.2 原生质体再生菌株统计分析
研究表明,共提取菌落2 026个,萌发1 427个,占总数的70.43%,获得单核菌株81个,占萌发总数的5.67%;各菌株原生质体萌发率和单核率均具有较大差异,原生质体萌发率在 56.00 ~76.40 ,平均萌发率为69.62%,表明原生质体萌发率较高;原生质体单核率在1.16 ~ 16.00 ,单核率为5.74%,其中菌株4 062的获得单核数量最多,占再生菌株的16%;菌株4 181、4 159、4 072、1 105单核数量最少,都仅获得1个单核。供试菌株原生质体单核率较低。表1,图3~4

图3 有锁状联合的双核菌丝
Fig. 3 Dikaryocyte with clamp connection
表1 单核菌株的数量以及单核获得比例
Table 1 The quantity of monocytic strains and the rate of monokaryogenesis

序号Num.菌种Strain挑取数量Picking number萌发数量Germination number萌发率Germination rate (%)单核数量Mononuclear number单核获得率Mononuclear Acquisition rate (%)1338896876.4034.4124571108072.7333.7535041299674.4244.1741 105996969.7011.4551 118967275.0056.94461 7091348059.70810.0073 7801168169.8344.9483 7781257056.0068.5794 0101188471.1933.57104 0621237560.981216.00114 0721238669.9211.16124 1001077469.1656.76134 117946670.2123.03144 131966567.71710.77154 146836072.2946.67164 1591087771.3011.29174 181976567.0111.54184 4401047875.00810.26194 4531098174.3133.70总计 Total2 0261 4271 322.8681108.98平均 Average108.4275.1169.624.265.74

图4 无锁状联合的单核菌丝
Fig.4 Monokaryotic mycelia that have no clamp connection
2.3 出发菌株与单核菌株菌落培养特征比较
研究表明,单核菌株与出发菌株在菌丝长速方面均具有显著差异,但不具有一定的规律性,有12个单核菌株的菌丝长速显著高于其出发菌株,占单核菌株的29.27%,有9个单核菌株的菌丝长速与其出发菌株相当,占单核菌株的21.95%,有20个单核菌株的菌丝长速显著低于其出发菌株,占单核菌株的48.78%;单核菌株与出发菌株在菌丝形态方面均具有显著差异,但不具有一定的规律性,有20个单核菌株的菌丝形态优于其出发菌株,占单核菌株的48.78%,有10个单核菌株的菌丝形态与其出发菌株相似,占单核菌株的24.39%,有11个单核菌株的菌丝形态劣于其出发菌株,占单核菌株的26.83%;单核菌株与出发菌株在菌丝长势方面均具有一定差异,且不具有一定的规律性,有6个单核菌株的菌丝长势优于其出发菌株,占单核菌株的14.63%;有23个单核菌株的菌丝长势与其出发菌株相当,占单核菌株的56.10%,有12个单核菌株的菌丝形态劣于其出发菌株,占单核菌株的29.27%。表2,图2~5。
表 2 出发菌株与单核菌株菌丝培养特征
Table 2 The results of variance analysis about starting strains and mononuclear strains

序号No.菌株Strain菌丝长速Growth rate (mm/d)菌落形态Colony morpology菌丝长势Growth vigor13389.39a菌丝浓白,边缘整齐++2338-175.95b菌丝浓白,边缘不整齐++3338-184.12c菌丝浓白,边缘不整齐+4338-203.50d菌丝浓白,边缘不整齐+54575.96c菌丝较浓白,边缘较整齐++6457-376.68b菌丝浓白,边缘整齐++7457-306.94a菌丝浓白,边缘整齐++85044.06b菌丝浓白,边缘整齐++9504-633.23b菌丝浓白,不整齐++10504-415.44a菌丝稀疏,边缘不整齐++11504-433.69b菌丝浓白,边缘较整齐++121 1185.37a菌丝稀疏,边缘较整齐++131 118-275.22a 菌丝稀疏,边缘较整齐++141 118-483.39b菌丝稀疏,边缘较整齐+151 118-335.02a菌丝稀疏,边缘较整齐++161 7099.19a菌丝稀疏,边缘不整齐+++171 709-747.74b菌丝浓白,边缘较整齐+++181 709-1036.82c菌丝稀疏,边缘整齐+++191 709-597.72b菌丝浓白,边缘整齐+++203 7788.93b菌丝浓白,边缘整齐++++213 778-869.41a菌丝浓白,边缘整齐++++223 778-816.17d菌丝浓白,边缘整齐++233 778-477.02c菌丝浓白,边缘整齐+++243 7809.21b菌丝浓白,边缘整齐+++253 780-209.69a菌丝较浓白,边缘整齐++++263 780-319.29b菌丝浓白,边缘较整齐++++273 780-246.76c菌丝浓白,边缘较整齐+++284 0105.43c菌丝稀疏,边缘较整齐+++294 010-917.73a菌丝浓白,边缘整齐+++304 010-134.97d菌丝稀疏,边缘较整齐++314 010-886.94b菌丝浓白,边缘整齐++324 0624.95b菌丝稀疏,边缘不整齐++334 062-683.46c菌丝稀疏,边缘不整齐+344 062-507.08a菌丝浓白,边缘整齐++354 062-822.98d菌丝稀疏,边缘不整齐+364 1006.11b菌丝较浓白,边缘不整齐++374 100-233.68d菌丝浓白,边缘整齐++384 100-526.80a菌丝稀疏,边缘较整齐+++394 100-545.40c菌丝较浓白,边缘不整齐++404 1319.75a菌丝较浓白,边缘不整齐++++
续表 2 出发菌株与单核菌株菌丝培养特征
Table 2 The results of variance analysis about starting strains and mononuclear strains

序号No.菌株Strain菌丝长速Growth rate (mm/d)菌落形态Colony morpology菌丝长势Growth vigor414 131-258.96b菌丝浓白,边缘整齐++++424 131-247.85c菌丝浓白,边缘整齐+++434 131-299.41a菌丝浓白,边缘整齐+++444 1467.69a菌丝较浓白,边缘较整齐+++454 146-393.83b菌丝稀疏,边缘不整齐++464 146-267.67a菌丝浓白,边缘整齐+++474 146-347.65a菌丝浓白,边缘整齐+++484 4402.69a菌丝浓白,菌落有退化现象+494 440-172.10c菌丝浓白,边缘不整齐+504 440-992.33b菌丝浓白,边缘不整齐+514 440-232.61a菌丝浓白,边缘不整齐+524 4537.60d菌丝稀疏,边缘较整齐+++534 453-309.37b菌丝浓白,边缘整齐++++544 453-368.94c菌丝浓白,边缘整齐++++554 453-879.84a菌丝浓白,边缘整齐++++
注:* 菌丝长速后面的小写字母代表显著性差异(P=0.05)
Note: * The lower case letters behind the hypha growth rate represent significant differences(P=0.05)

图5 出发菌株与单核菌株菌丝生长
Fig. 5 Mycelium growth of starting strains and mononuclear strains
3 讨 论
研究表明,原生质体分离和再生过程本身可作为提高变异的手段,从而在食用菌品种改良和选育上发挥一定的作用[11-13]。原生质体单核是食用菌育种的重要材料,也是直接利用野生资源和栽培种植的重要途径。研究通过比较发现,相同条件下,供试菌株在原生质体释放速率、再生能力和单核菌株得率方面存在明显不同,这可能与供试材料本身所具有的生物学特征特性不同有关,如细胞壁厚度不同、细胞壁疏密度不同、胞壁再生能力不同等。此外,在原生质体制备过程中,机械震荡、化学试剂处理均可能导致控制生长性状的基因丢失或发生变异,从而导致了再生菌株菌落形态、生长速度和其它生物学特性的改变[14]。研究通过分析比较单核菌株与其出发菌株菌落培养特征发现,来自同一出发菌株的各个单核化菌株之间以及不同出发菌株的各个单核化菌株间,菌落培养特征在形态、长速、长势等方面均表现出了丰富的多样性。虽然有关供试菌株分子水平的遗传多样性还有待进一步研究,但研究进行野生平菇原生质体制备和再生的规律,并对再生菌株的生物学特性进行研究,为野生平菇原生质体再生后代的遗传多样性研究提供丰富的材料。为了推动平菇产业持续健康的发展,必须加强平菇优良品种的选育研究[15-16]。
4 结 论
各菌株原生质体释放量随酶解时间延长呈先升高再降低的趋势,11个菌株在酶解处理3.5 h时原生质体释放量最大,占总数的的84.6%;不同菌株原生质体再生能力存在差异,其中菌株4 453的原生质体再生率最高;供试的19株平菇菌株共获得单核菌株81个,其中菌株4 062获得的单核数量最多;菌株4 181、4 159、4 072、1 105单核得率最低,都仅获得1个单核,结果表明供试菌株原生质体单核率较低,有待提高;比较分析出发菌株与其单核菌株的菌丝培养特征发现,单核菌株与出发菌株在菌丝长速、形态、长势等方面均具有一定差异,但不具有一定的规律性,12个单核菌株的菌丝长速显著高于其出发菌株,有20个单核菌株的菌丝形态优于其出发菌株,有6个单核菌株的菌丝长势优于其出发菌株。所有供试菌株在原生质体释放速率、单核得率以及菌丝长速、长势、菌落形态等方面具有丰富的遗传多样性。

