二苯醚水解耦合苯酚氧化羰基化合成碳酸二苯酯的热力学分析
杜治平,林志坤,黄丽明,袁 华,吴元欣
(武汉工程大学 绿色化工过程教育部重点实验室
湖北省新型反应器与绿色化学工艺重点实验室,湖北 武汉 430073)
二苯醚水解耦合苯酚氧化羰基化合成碳酸二苯酯的热力学分析
杜治平,林志坤,黄丽明,袁 华,吴元欣
(武汉工程大学 绿色化工过程教育部重点实验室
湖北省新型反应器与绿色化学工艺重点实验室,湖北 武汉 430073)
以碳酸二甲酯和碳酸二乙酯的热力学数据为基础,结合Benson、Joback和马沛生基团贡献法估算了碳酸二苯酯(DPC)的热力学性质,进而计算了苯酚氧化羰基化合成DPC反应和二苯醚水解反应的焓变、熵变、吉布斯自由能变和平衡常数。计算结果表明,两个反应均为放热反应;在5 MPa、353~413 K下,两个反应均为自发过程,其中苯酚氧化羰基化反应的平衡常数较大,且随温度的升高而降低;二苯醚水解反应的平衡常数较小,且随温度的升高而增大。为达到耦合除水的目的,两个反应的反应速率需维持合适的比例。
碳酸二苯酯; 苯酚;氧化羰基化; 二苯醚; 水解; 耦合;热力学分析
碳酸二苯酯(DPC)是一种重要的有机化工原料,其合成方法有光气法、碳酸二甲酯酯交换法、草酸二苯酯脱羰法和苯酚氧化羰基化法等[1-4]。苯酚氧化羰基化法是以CO、O2和苯酚为原料一步合成DPC,它具有原子利用率高、理论上水是惟一的副产物和无污染等优点,但副产物水对催化剂有毒害作用,催化剂的活性较低且寿命较短;另外,水也能促进DPC水解。当前主要采用分子筛脱水[5-6],但分子筛脱水存在如下缺陷:(1)分子筛自身的吸水能力有限,而在反应温度(一般为353 K)下分子筛的吸水能力会因升温而进一步削弱,脱水效果不理想;(2)分子筛表面的酸、碱中心对DPC的水解有促进作用。因此必须探寻新的脱水方法。
苯酚由于酚羟基的碳氧键比较牢固,一般不能通过苯酚的分子间直接脱水制备二苯醚(DPE),而是通过酚钠与卤代芳烃在Cu的催化作用下,经高温反应合成。由于DPE的合成较为困难,因此经水解生成苯酚的过程可能更为容易。因此,能否通过二苯醚的原位水解以消耗苯酚氧化羰基化反应中生成的水,在不引入杂质的情况下,实现水解反应与羰基化反应的耦合,从而提高DPC的合成收率。
本工作从热力学的角度对DPE水解和苯酚氧化羰基化反应进行了热力学计算和分析,以期对实验研究提供理论支持。
1 反应原理和热力学计算
1.1 反应原理
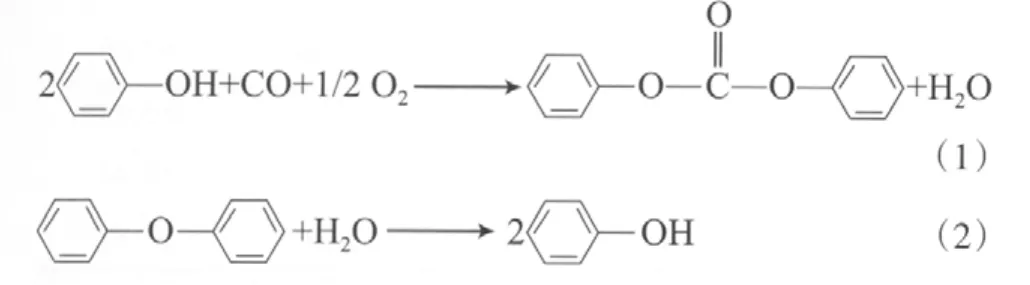
苯酚氧化羰基化和DPE水解反应如下:用—OCOC—的气态定压热容替代—OCOO—的气态定压热容等[7],这样很难保证数据的可靠性。因此,本工作以文献报道的相关碳酸酯的热力学数据为基础,通过计算—OCOO—的相关热力学数据,进而求解DPC的相关热力学性质。
1.2.1 298.15 K下气态DPC的热力学数据
1.2.1.1 气态DPC的标准摩尔生成焓和标准摩尔熵
298.15 K下,晶体DPC的标准摩尔生成焓和标准摩尔熵分别为-401.66 kJ/mol和278.60 J/(mol·K)[8],而相同温度下DPC的升华焓为90 kJ/mol[9],因此,由相平衡可计算298.15 K下,气态DPC的标准摩尔生成焓和标准摩尔熵分别为-311.66 kJ/mol和580.46 J/(mol·K)。
1.2.1.2 气态DPC的摩尔定压热容
由于缺少DPC的摩尔定压热容数据,而Benson基团贡献法考虑了临近基团的影响[10],具有较高的精度,因此采用Benson基团贡献法估算DPC的摩尔定压热容。计算公式见式(3)。

1.2 热力学计算
关于DPC热力学数据的计算已见报道,但由于缺少碳酸酯基(—OCOO—)的相应数据,多采用类似—OCOO—的其他基团数据进行替代,如采
由于缺少—OCOO—的定压热容数据,因此,由碳酸二乙酯(DEC)的摩尔定压热容[11],采用Benson基团贡献法求取,进而估算DPC的相应热力学参数,估算结果见表1。
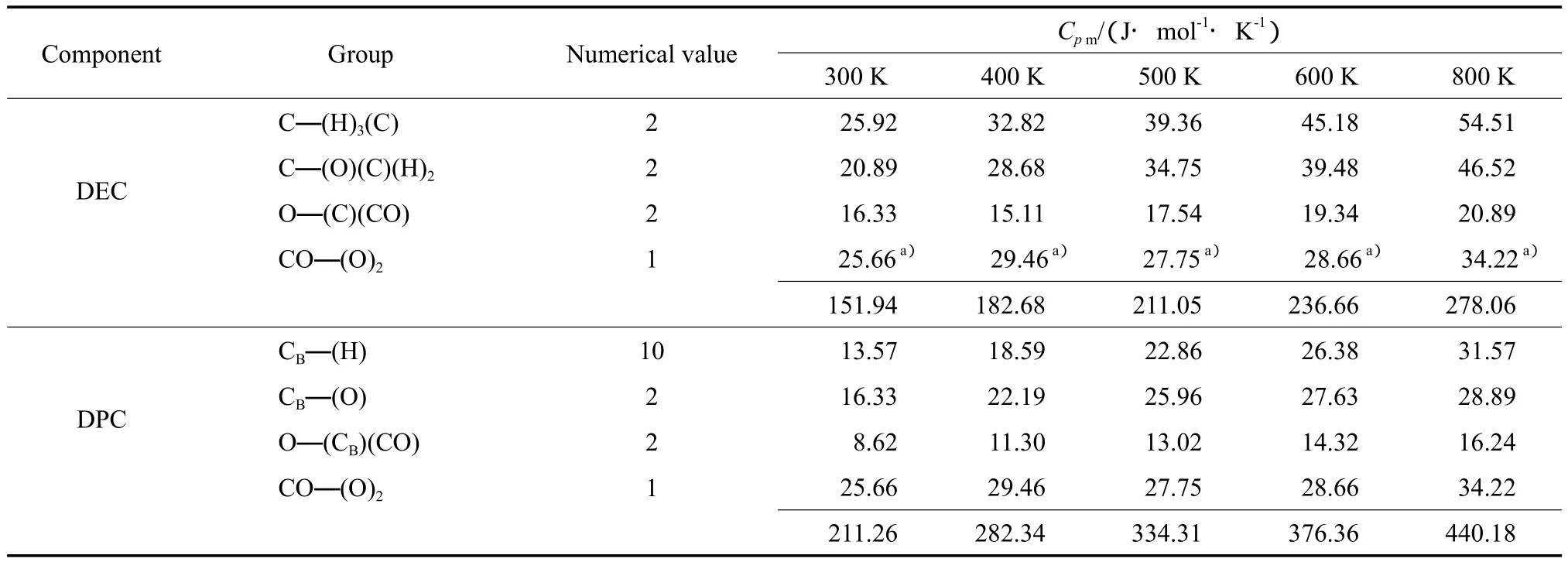
表1 DEC和DPC的基团贡献值Table 1 Thermodynamic data of group contribution of diethyl carbonate(DEC) and diphenyl carbonate(DPC)
根据表1中的数据,进一步通过线性回归得到DPC的摩尔定压热容与温度(T)的关系,关系式见式(4)。
Cpm=-43.267+1 006.300×10-3T-500.000×10-6T2(4)
1.2.1.3 DPC的临界温度和沸点下的蒸发焓
依据Joback对基团的划分原则[12],并根据DEC的临界温度(575.98 K)和沸点(400.00 K)[11]计算 —OCOO—的基团贡献值(见表2),进而根据DPC的沸点(574.7 K)估算出DPC的临界温度为794.16 K。计算公式见式(5)。
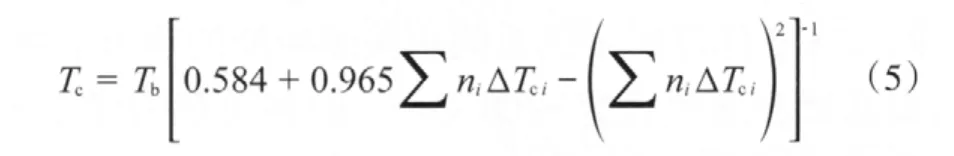
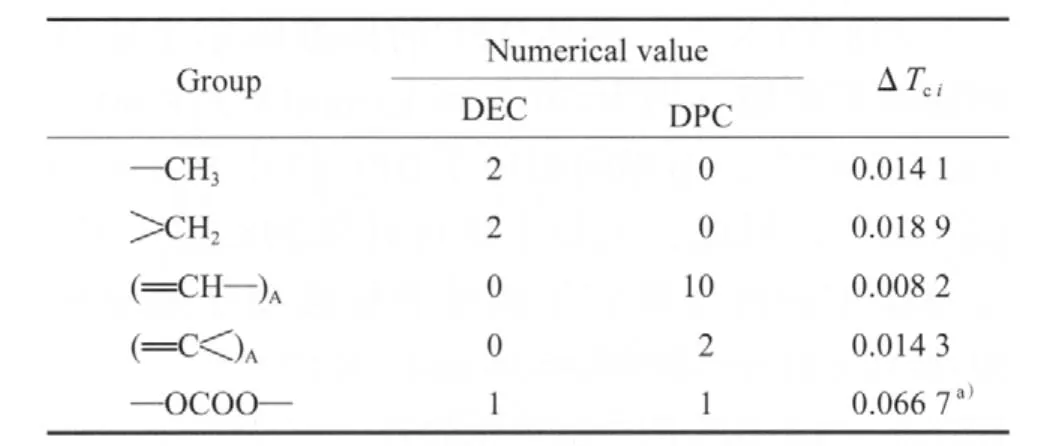
表2 Joback法估算Tc的基团贡献值Table 2 Group contribution values of Tc calculated based on Jaback method
苯酚氧化羰基化反应为液相反应,但缺少DPC的蒸发焓数据。由于马沛生基团贡献法采用了双官能团划分法[13],相比常用的单官能团,Joback和Reid基团贡献法具有更高的准确度,因此采用该法计算DPC的蒸发焓。计算公式见式(6)。
由于缺少完整的—OCOO—的贡献值,所以选取沸点下的DMC蒸发焓(33.82 kJ/mol)[14]和DEC蒸发焓(36.31 kJ/mol)[11],计算—OCOO—沸点下的基团贡献值(见表3),进而求得DPC沸点下的蒸发焓为51.88 kJ/mol。
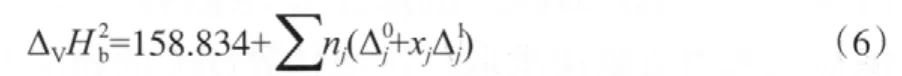
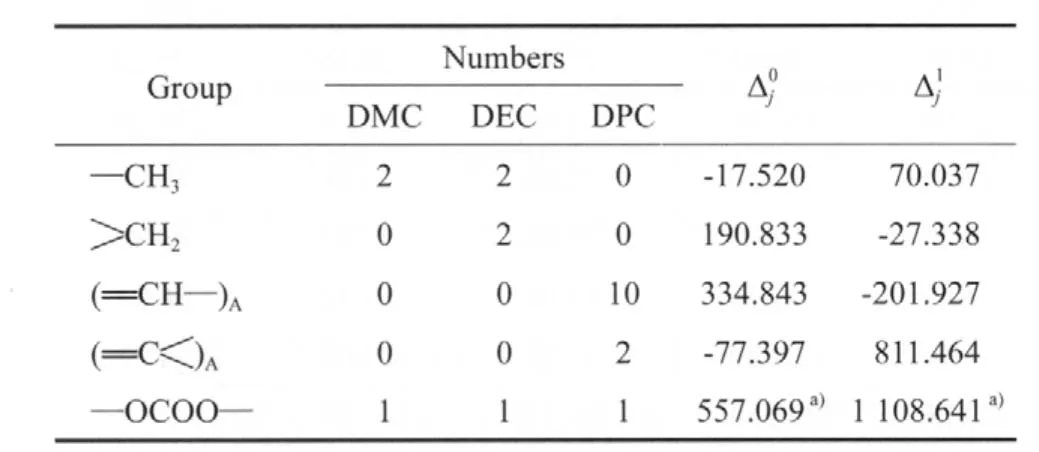
表3 马沛生基团贡献法估算ΔVHb的基团贡献值Table 3 The group contribution value of calculating ΔVHb based on the Ma Peisheng method
1.2.2 各组分的蒸发焓
由各组分的沸点、临界温度和沸点下的蒸发焓(见表4),采用Watson公式[15](式(7))估算它们在不同温度下的蒸发焓,估算结果见表5。
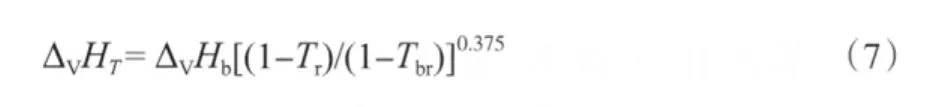
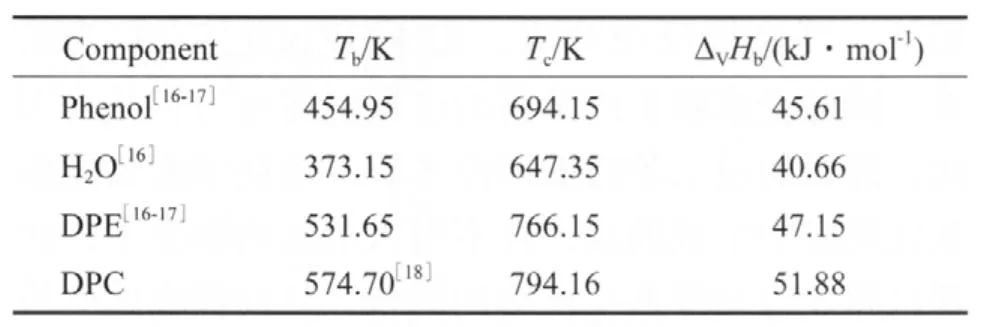
表4 各组分的沸点、临界温度和沸点下的蒸发焓Table 4 Tb,Tc and ΔVHb of different components
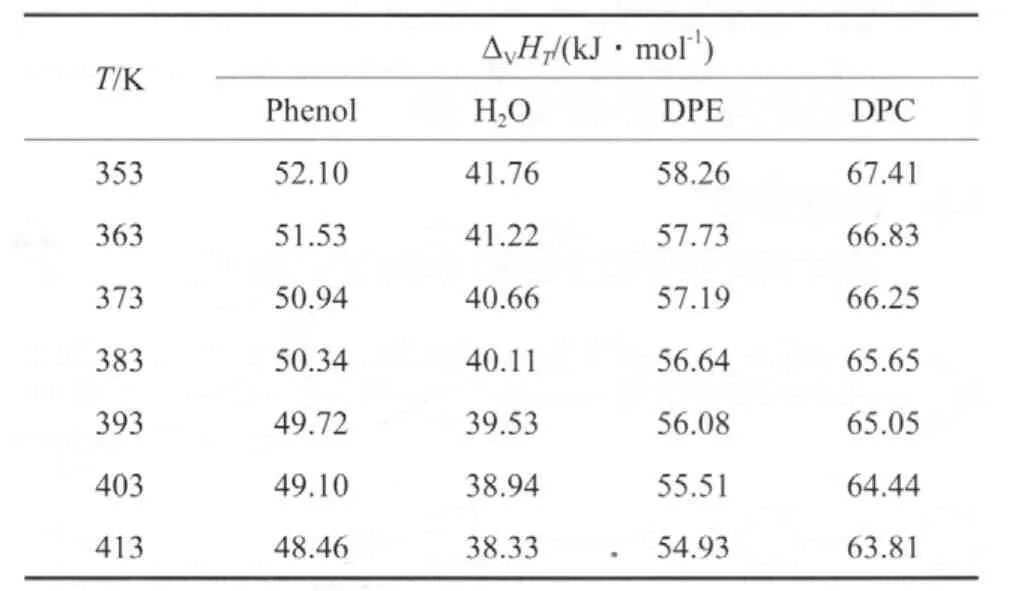
表5 各组分在不同温度下的蒸发焓Table 5 The vaporization enthalpies of the components at different temperatures
1.2.3 各组分的液体生成焓
根据各组分在不同温度下的气态摩尔定压热容(见表6),用式(8)计算各组分的气态摩尔生成焓,计算结果见表7。
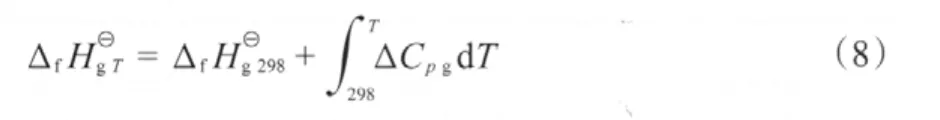
表6 不同温度下各组分的气态摩尔定压热容Table 6 The gaseous molar heat capacity at constant pressure of different components at different temperatures
根据各组分在不同温度下的气态摩尔生成焓和摩尔蒸发焓,用式(9)计算各组分的液态摩尔生成焓,计算结果见表7。

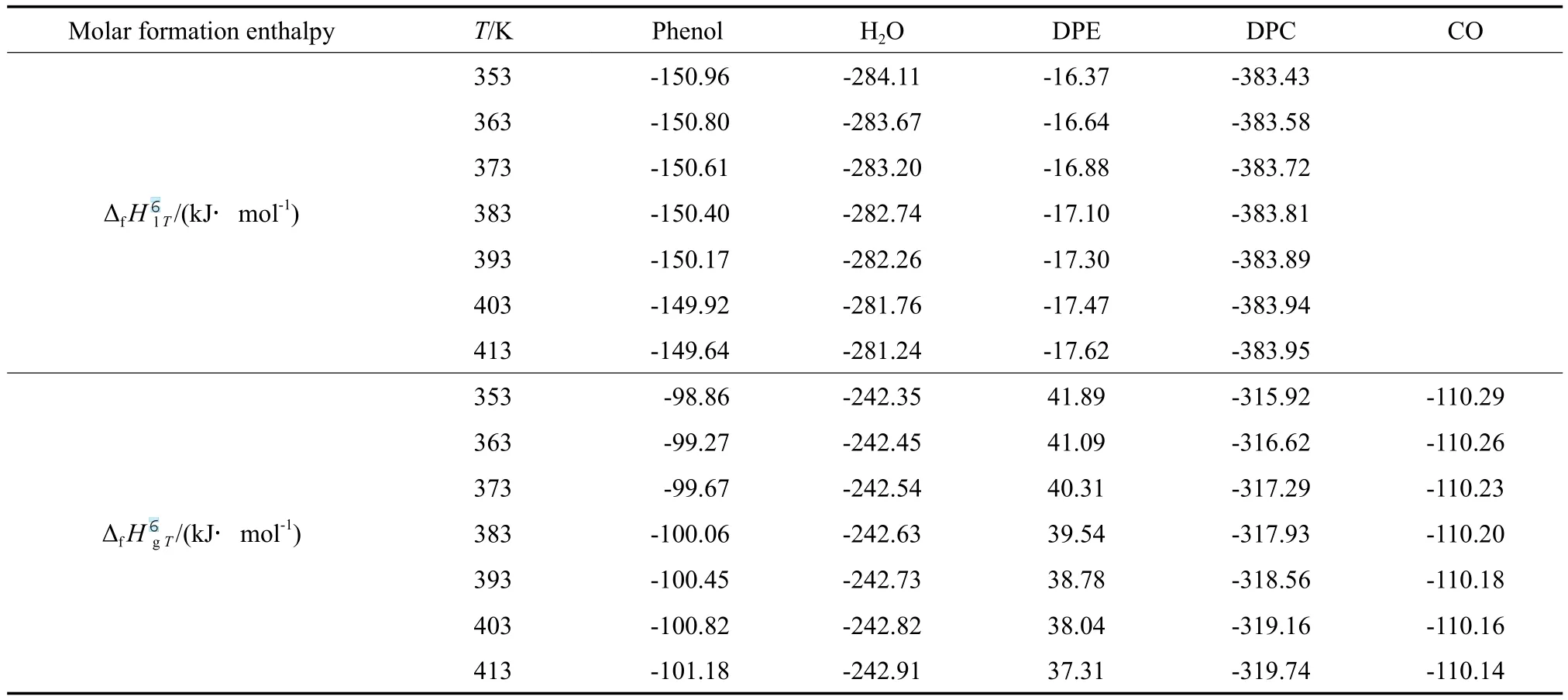
表7 各组分在不同温度下的气态和液态标准摩尔生成焓Table 7 The gaseous and liquid molar formation enthalpy of the components at different temperatures
1.2.4 各组分的液态标准摩尔熵
根据理想气体等压变化时的熵变计算公式(式(10)),计算不同温度下气态物质的标准摩尔熵,再根据该物质发生相变时的摩尔蒸发焓,用式(11)计算该物质的液态标准摩尔熵,计算结果见表8。
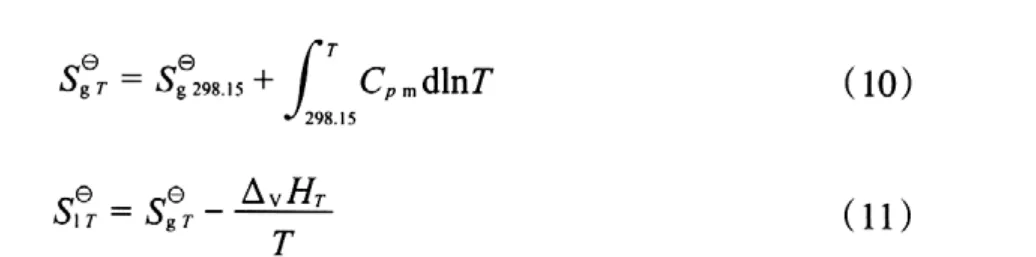
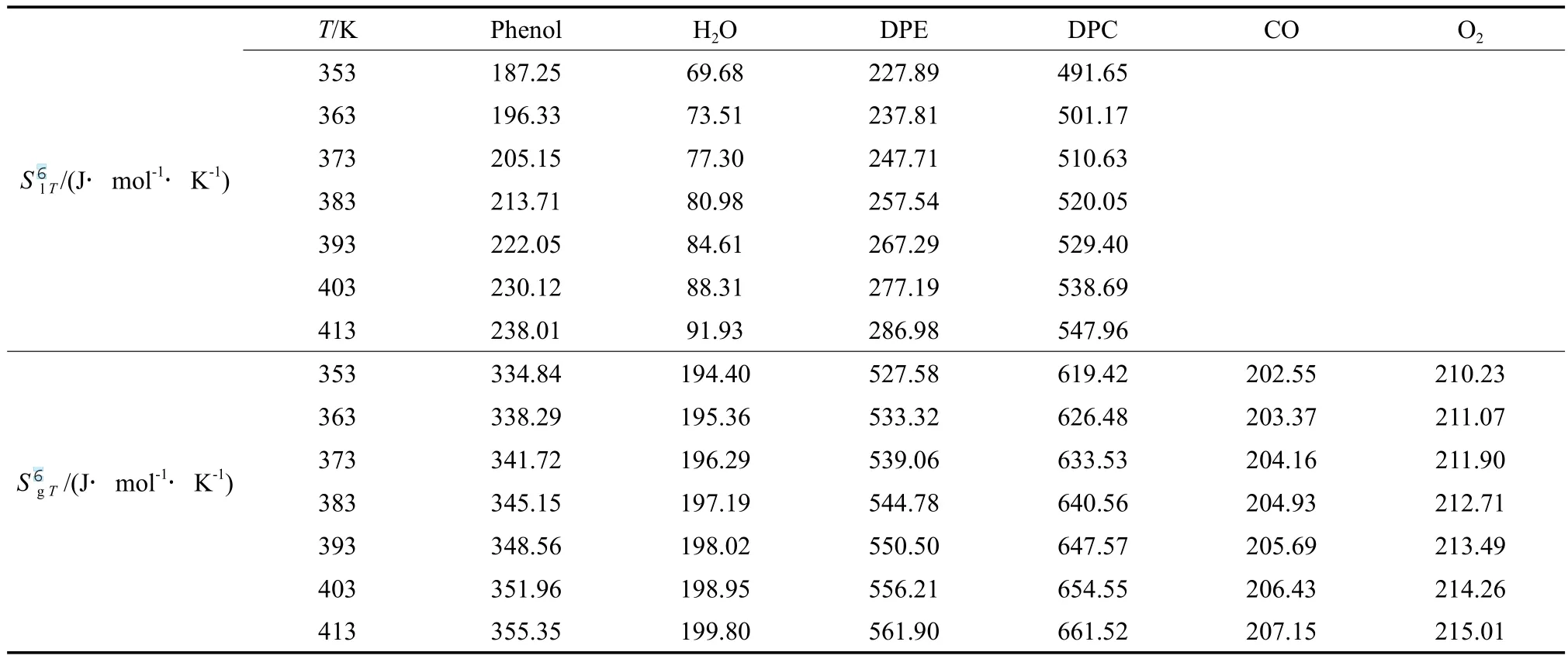
表8 各组分在不同温度下的气态和液态标准摩尔生成熵Table 8 The gaseous and liquid molar formation entropy of the components at different temperatures
2 结果与讨论
苯酚氧化羰基化反应为分子数减少的反应,为促进DPC的生成,一般需要加压。根据文献[4]报道的结果,选取典型工艺条件为压力5 MPa、温度353~413 K进行计算。根据反应中各组分所处的状态,分别设计了如图1所示的状态变化过程计算苯酚氧化羰基化反应和二苯醚水解反应的焓变(ΔrHm)、反应的吉布斯自由能变(ΔrGm)、反应的熵变(ΔrSm)和反应平衡常数(K6)(忽略各组分混合以及压力变化对液体的影响)。
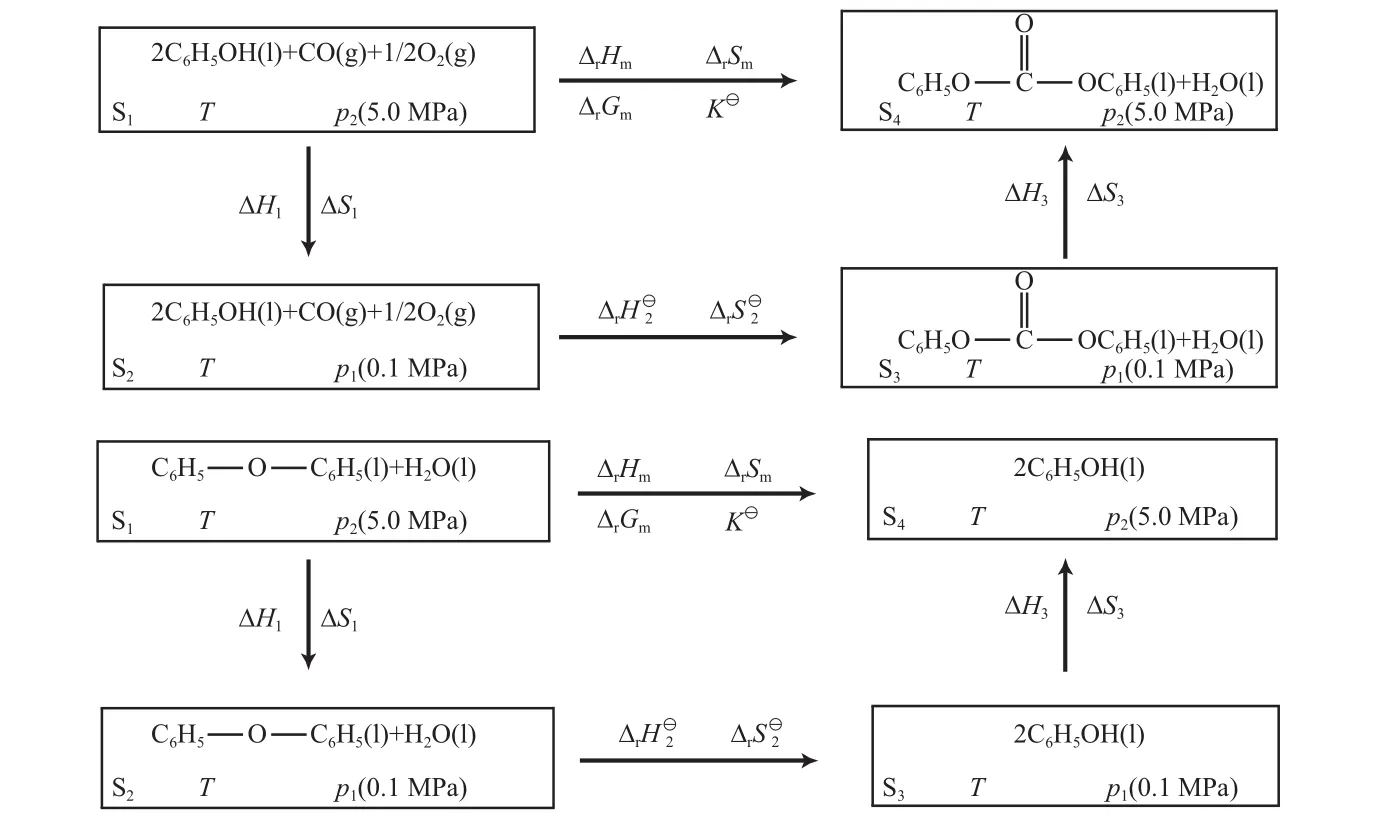
图1 苯酚氧化羰基化反应和二苯醚水解反应的状态设计Fig.1 State design of the oxidative carbonylation of phenol and the hydrolysis of DPE.
2.1 反应焓变的计算
2.1.1 等温变压过程(S1→S2)ΔH1的计算
苯酚氧化羰基化反应中,苯酚为液态,忽略压力对其焓的影响;同时,CO和O2近似为理想气体,由于反应过程的温度不变,所以该过程的焓变近似为0。二苯醚水解反应中,二苯醚、水和苯酚均为液态,压力对其焓的影响可忽略,所以该过程的焓变也可近似为0。即ΔH1≈0。
2.1.2 标准状态下反应过程(S2→S3)ΔrH62的计算
根据表7中的数据,用式(12)计算标准状态下苯酚氧化羰基化反应和二苯醚水解反应的ΔrH62。
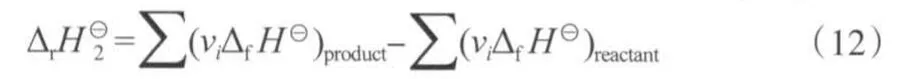
2.1.3 等温变压过程(S3→S4)ΔH3的计算
反应过程中DPC、苯酚和水均为液态,忽略压力对其焓的影响,所以该过程的焓变近似为0。即ΔH3≈0。
2.1.4 不同温度下反应过程(S1→S4)ΔrHm的计算
在5 MPa下,用式(13)计算不同温度下苯酚氧化羰基化反应和二苯醚水解反应的ΔrHm,计算结果见表9。从表9可知,苯酚氧化羰基化反应和二苯醚水解反应的焓变均为负值,表明两个反应都是放热反应,其中前者的热效应较大,在所计算的温度范围内放热量均在255 kJ/mol以上,且随温度的变化较小;后者呈现微弱的放热效应,且随温度的升高放热量逐渐减小。在所计算的温度范围内,二苯醚水解反应的焓变与苯酚氧化羰基化反应的焓变的比值在0.16%~0.56%之间,因此,从热力学角度来看,当两反应耦合进行时,二苯醚水解反应对苯酚氧化羰基化反应的影响很小。

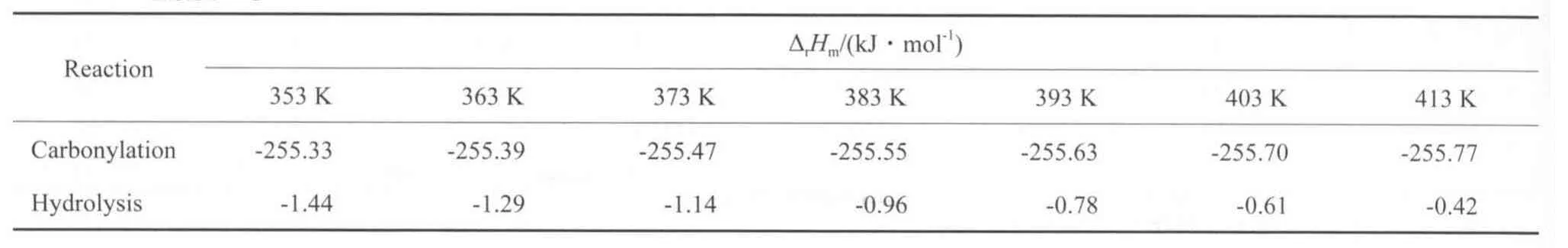
表9 不同温度下苯酚氧化羰基化反应和二苯醚水解反应的焓变Table 9 The enthalpy changes in the carbonylation of phenol and the hydrolysis of diphenyl ether at different temperatures
2.2 反应吉布斯自由能变的计算
忽略压力对液相组分熵的影响,用式(14)计算气相组分的熵变,用式(15)计算标准状态下的反应熵变ΔS6,用式(16)计算5 MPa下的反应熵变
r2ΔrSm。结合ΔrHm和ΔrSm,用式(17)计算5 MPa下的反应吉布斯自由能变ΔrGm,计算结果见表10。
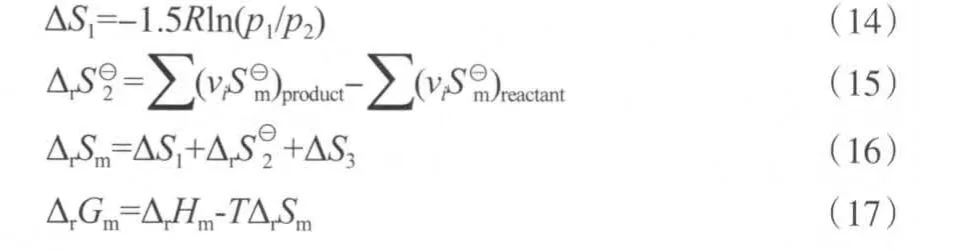
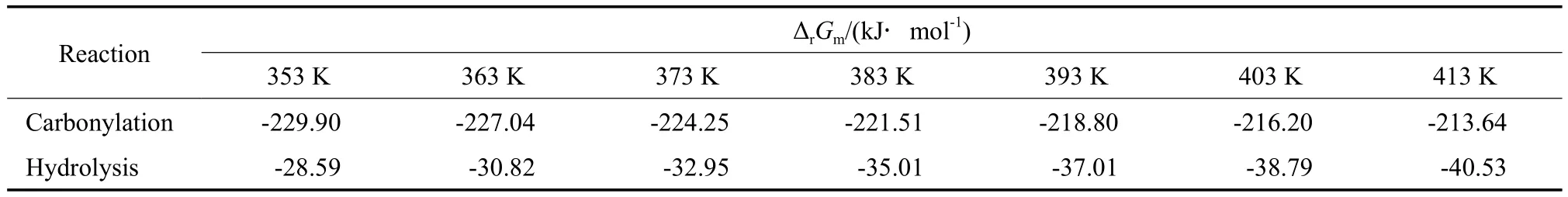
表10 不同温度下苯酚氧化羰基化反应和二苯醚水解反应的吉布斯自由能变Table 10 The Gibbs free energy changes in the carbonylation of phenol and the hydrolysis of diphenyl ether at different temperatures
从表10可知,苯酚氧化羰基化反应和二苯醚水解反应的吉布斯自由能变均为负值,说明两个反应在计算的温度范围内可以自发进行。在等温等压下,根据De Donder提出的反应耦合的判据[20]:(ΔrGm1)Tpr1+(ΔrGm2)Tpr2≤0(式中,下角标1和2分别代表参与耦合的两个反应),结合表10的数据,苯酚氧化羰基化反应和二苯醚水解反应的耦合在热力学上能够自发进行。
2.3 反应平衡常数的计算
采用式(18)分别计算了0.1 MPa、不同温度下的苯酚氧化羰基化反应和二苯醚水解反应的标准平衡常数(K6) ,计算结果见表11。

表11 不同温度下苯酚氧化羰基化反应和二苯醚水解反应的平衡常数Table 11 The equilibrium constants of the carbonylation of phenol and the hydrolysis of diphenyl ether at different temperatures

从表11可知,苯酚氧化羰基化反应的平衡常数较大,说明该反应较容易进行;但由于该反应为强放热反应,所以随温度的升高,平衡常数降低。从热力学角度分析,升高温度不利于DPC的生成;但在动力学上,当反应温度过低时,反应速率较慢,同样不利于DPC的合成。相比苯酚氧化羰基化反应,二苯醚水解反应的平衡常数要小得多,说明反应虽能自发进行,但反应的自发程度不如苯酚氧化羰基化反应的大。另外,二苯醚水解反应的平衡常数随温度的升高而增加,表明升高温度是有利于二苯醚水解反应的进行。结合表9和表11,二苯醚水解反应的热效应较小,基本不影响苯酚氧化羰基化反应,而苯酚氧化羰基化反应释放的大量热量又有利于二苯醚水解反应,因此,两者的耦合能很好地相互促进;此外,引入二苯醚水解反应的目的在于消耗反应中的副产物水,由于苯酚氧化羰基化反应比二苯醚水解反应容易进行,如果苯酚氧化羰基化反应进行得过快,那么生成的水量将远远超出二苯醚水解反应所消耗的水量,则水对催化剂活性和DPC水解的影响依然存在。因此,在催化剂的设计中,要使两个反应的反应速率维持合适的比例。
3 结论
(1)苯酚氧化羰基化反应和二苯醚水解反应均为放热反应,且后者释放出的热量仅为前者的0.16%~0.56%;当两个反应耦合时,二苯醚水解反应对苯酚氧化羰基化反应的影响很小。
(2)在5 MPa、353~413 K下,苯酚氧化羰基化反应和二苯醚水解反应的吉布斯自由能变均为负值,两个反应均可自发进行。
(3)苯酚氧化羰基化反应的平衡常数较大,且随温度的升高而降低;与苯酚氧化羰基化反应相比,二苯醚水解反应的平衡常数较小,且随温度的升高而增大,两个反应的耦合能很好地相互促进。
(4)为达到二苯醚水解而消耗反应中副产物水的目的,在催化剂的设计中,要使两个反应的反应速率维持合适的比例。
符 号 说 明


[1] 马新宾,黄守莹,王胜平,等. 氧化羰基化法合成有机碳酸酯的研究进展[J]. 石油化工,2010,39(7):697 - 705.
[2] Du Zhiping,Xiao Yanhua,Chen Tong,et al. Catalytic Study on the Transesterification of Dimethyl Carbonate and Phenol to Diphenyl Carbonate[J].Catal Commun,2008,9(2):239 -243.
[3] 曹平,石卫兵,杨先贵,等. 酯交换法合成碳酸二苯酯的技术分析[J]. 石油化工,2010,39(3):346 - 352.
[4] Yang Xiaojun,Han Jinyu,Du Zhiping,et al. Effects of Pb Dopant on Structure and Activity of Pd/K-OMS-2 Catalysts for Heterogeneous Oxidative Carbonylation of Phenol[J].Catal Commun,2010,11(7):643 - 646.
[5] 杨小俊,吴元欣,韩金玉,等. Pd/锰氧化物催化苯酚氧化羰基化合成碳酸二苯酯:Ⅰ. 载体晶型结构和表面氧物种的影响[J]. 石油化工,2009,38(7):728 - 732.
[6] Zhao Yueqing,Liang Yinghua,Jia Qianyi,et al. Preparation of CuO-CoO-MnO/SiO2Nanocomposite Aerogels as Catalyst Carriers and Their Application in the Synthesis of Diphenyl Carbonate[J].J Wuhan Univ Technol,Mater Sci Ed,2011,26(4):595 - 599.
[7] 杜治平,王越,王公应. 碳酸乙烯酯与苯酚酯交换反应的热力学分析[J]. 天然气化工,2005,30(1):21 - 25.
[8] Sinke G C,Hildenbrand D L,McDonald R A,et al. The Heat,Entropy and Free Energy of Formation of Diphenyl Carbonate[J].J Phys Chem,1958,62(11):1461 - 1462.
[9] 王胜平. 苯酚和草酸二甲酯酯交换反应合成碳酸二苯酯[D].天津:天津大学,2003.
[10] Cohen N,Benson S W. Estimation of Additivity Methods,Heat Formation of Organic Compounds by Additivity Methods[J].Chem Rev,1993,93(7):2419 - 2438.
[11] 马沛生. 石油化工基础数据手册:续编[M]. 北京:化学工业出版社,1993:1012 - 1013.
[12] 徐煜,衣守志,吴家全. 纯物质蒸发焓估算方法的进展[J].石油化工,2009,38(7):801 - 807.
[13] 马沛生,许文,刘贻胜,等. 用官能团法估算沸点下的蒸发焓[J]. 石油化工,1992,21(9):613 - 617.
[14] 邢爱华,张敏卿,何志敏,等. 碳酸二甲酯与苯酚酯交换合成碳酸二苯酯热力学分析[J]. 化学工程,2006,34(11):40 - 43.
[15] 波林 B E,普劳斯尼次 J M,奥康奈尔J P. 气液物性估算手册[M]. 第5版. 赵红玲,王风坤,陈圣坤,等译. 北京:化学工业出版社,2005:45 - 182.
[16] 时钧,汪家鼎,余国宗,等. 化学工程手册:上册[M]. 第2版. 北京:化学工业出版社,1996:31 - 41.
[17] 卢焕章,毕兰云,伍章平,等. 石油化工基础数据手册[M].北京: 化学工业出版社,1984:584 - 585,866 - 867.
[18] 徐克勋. 精细有机化工原料及中间体手册[M]. 北京:化学工业出版社,1998:381.
[19] 天津大学物理化学教研室. 物理化学:上册[M]. 第4版. 北京:高等教育出版社,2002:310 - 314.
[20] Prigogine I,Delay R. Chemical Thermodynamics[M]. London:Longmans Green,1954:38 - 42.
Thermodynamic Analysis of Coupling of Oxidative Carbonylation of Phenol with Hydrolysis of Diphenyl Ether
Du Zhiping,Lin Zhikun,Huang Liming,Yuan Hua,Wu Yuanxin
(Key Laboratory for Green Chemical Process of Ministry of Education,Hubei Key Laboratory of Novel Chemical Reactor and Green Chemical Technology,Wuhan Institute of Technology,Wuhan Hubei 430073,China)
Based on the thermodynamic data of dimethyl carbonate and diethyl carbonatethe,thermodynamic properties of diphenyl carbonate were estimated by using Benson,Joback and Ma Peisheng group contribution methods,and then the enthalpy changes,entropy changes,Gibbs free energy changes and equilibrium constants in the oxidative carbonylation of phenol to diphenyl carbonate and the hydrolysis of diphenyl ether were calculated. The results show that the two reactions are exothermic and spontaneous under the conditions of 5 MPa and 353-413 K. The equilibrium constant of the oxidative carbonylation of phenol is larger than that of the hydrolysis of diphenyl ether. With the rise of temperature,the former decreases but the latter increases. It is necessary for the rates of the two reactions to maintain an appropriate proportion to remove water by the hydrolysis.
diphenyl carbonate;phenol;oxidative carbonylation;diphenyl ether;hydrolysis;coupling;thermodynamic analysis
1000 - 8144(2012)08 - 0894 - 07
TQ 225.52
A
2012 - 02 - 22;[修改稿日期]2012 - 06 - 08。
杜治平(1971—),男,湖北省仙桃市人,博士,副教授,电话 027 - 87195671,电邮 dzpxyhry@163.com。
国家自然科学基金重点项目(20936003);湖北省自然科学基金重点项目(2008CDA009)。
(编辑 安 静)

