胡椒碱减轻H2O2引起的兔心房肌细胞内向整流钾电流及超速激活延迟整流钾电流的异常改变*
刘 岩, 李 泱, 林 琨, 田 苗, 王玉堂, 单兆亮△
(解放军总医院 1心内科, 2老年心血管病研究所,北京 100853)
1000-4718(2012)05-0839-07
2011-11-24
2012-03-08
国家自然科学基金资助项目(No. 30772886)
△通讯作者 Tel: 010-55499312; E-mail:shanzl301@sina.com
胡椒碱减轻H2O2引起的兔心房肌细胞内向整流钾电流及超速激活延迟整流钾电流的异常改变*
刘 岩1, 李 泱2, 林 琨1, 田 苗1, 王玉堂1, 单兆亮1△
(解放军总医院1心内科,2老年心血管病研究所,北京 100853)
目的研究胡椒碱对H2O2引起的兔单个心房肌细胞内向整流钾电流(IK1)及超速激活的延迟整流钾电流(IKUr)异常的影响。方法采用全细胞膜片钳技术分析50 μmol/L H2O2对兔单个心房肌细胞IK1和IKUr的影响,并研究预先应用7 μmol/L胡椒碱对其的保护作用。结果7 μmol/L胡椒碱对正常兔心房肌细胞IK1和IKUr及其通道动力学无显著影响。在50 μmol/L H2O2作用下,兔心房肌细胞IK1峰值由(-148.2±16.7)pA/pF降低至(-64.2±9.8)pA/pF (P<0.05),电流-电压曲线上移;而IKUr峰值由(16.0±2.1)pA/pF降低至(6.1±1.4)pA/pF (P<0.05),电流-电压曲线下移,通道稳态激活曲线右移,通道稳态失活曲线左移及恢复时间减慢,而且存在频率依赖性特征。预先给予7 μmol/L胡椒碱,明显减轻H2O2对IK1和IKUr的抑制作用(P<0.01),并可减少H2O2对超速激活延迟整流钾通道动力学的异常影响。结论胡椒碱可减轻氧化应激对心房肌细胞IK1和IKUr的影响。
胡椒碱; 过氧化氢; 心房肌细胞; 内向整流钾电流; 超速激活延迟整流钾电流
胡椒碱(piperine, PIP)在胡椒科植物中广泛存在,属中、蒙、藏医常用药物。胡椒碱通过抑制自由基和活性氧簇的产生,能够降低脂质过氧化反应,对细胞内的巯基、抗氧化分子及抗氧化酶类有显著保护作用[1]。研究显示,胡椒碱对H2O2诱导的心房肌细胞氧化应激损伤有保护作用[2],而H2O2对心房肌细胞电生理的影响,胡椒碱是否有保护作用尚未见报道。本文拟用全细胞膜片钳技术观察H2O2对兔心房肌细胞内向整流钾电流(inward rectifier potassium current,IK1)及超速激活延迟整流钾电流(ultra rapid delayed rectifier potassium current,IKUr)的影响,以及胡椒碱的保护作用。
材 料 和 方 法
1溶液与试剂
胶原酶II 、胰蛋白酶、牛血清白蛋白、天冬氨酸钾、丙酮酸钠、Mg-ATP、HEPES、CaCl2、CdCl2、BaCl2和4-氨基吡啶(4-aminopyridine,4-AP)均购自Sigma;EGTA购自Fluka Biochemika;其它试剂均为分析纯。
1.1Tyrode液的组成成份(mmol/L) NaCl 135,KCl 5.4,CaCl21.8,MgCl21.0,NaH2PO40.33,HEPES 10,glucose 10,用NaOH 调pH值至7.3;无钙Tyrode液和0.2 mmol/L Ca2+Tyrode液,分别为Tyrode 液中不加CaCl2和加0.2 mmol/L CaCl2。
1.2记录钾电流的细胞外液(mmol/L)N-methyl-D-glucamine(NMG) 149,MgCl25,CaCl20.65,HEPES 5,用HCl调pH值至7.4。
1.3细胞内液(mmol/L) KCl 45,天冬氨酸钾 85,丙酮酸钠 5,Mg-ATP 5.0,EGTA 10,HEPES 10,glucose 11,用KOH调pH值至7.4。
1.4细胞保护液(KB液,mmol/L) KOH 110,taurine 10,oxalic acid 10,glutamic acid 70,KCl 25,KH3PO410,EGTA 5,HEPES 5,glucose 10,用KOH调 pH至7.4。
2兔单个心房肌细胞分离
成年新西兰大耳白兔(约1.0~1.5 kg) 购自中国人民解放军实验动物中心,动物实验方法符合动物伦理学要求。按文献[3-5]采用酶解法制备心房肌单细胞并进行了改进。取新西兰白兔(约1.0~1.5 kg) 经腹腔20%水合氯醛(2 mL/kg)麻醉,迅速取心脏,在37 ℃和通氧条件下行Langendorff 灌流。用无Ca2+Tyrode液灌流3~5 min,用含II型胶原酶70 mg、胰蛋白酶12 mg无Ca2+Tyrode液灌流(50 mL) 25~30 min以消化心房肌。沿房室间沟取心房肌,剪碎入KB液中并吹打使细胞脱落,-4 ℃保存,1 h后进行实验。取保存液加于1 mL灌流槽中,待细胞贴壁后,于倒置显微镜下选择边缘整齐、表面无颗粒、横纹清晰、无收缩的细胞,在37 ℃下进行实验。
3细胞的处理及药物的应用
细胞共分4组:(1)不经任何处理,为对照组,直接进行钳制并记录电流;(2) 经50 μmol/L H2O2培养0.5 h后钳制并记录电流;(3)预先经7 μmol/L胡椒碱培养1 h后再加入50 μmol/L的H2O2培养0.5 h钳制并记录电流;(4) 经7 μmol/L胡椒碱培养1.5 h后钳制并记录电流。
4干扰电流的排除
4.1记录IK1于细胞外液加入多非利特(dofetilide,Dof) 5 nmol/L阻断IKr,CdCl2100 μmol/L阻断ICa,L,河豚毒素(tetrodotoxin,TTX) 100 μmol/L阻断INa。
4.2记录IKUr于细胞外液加入BaCl2200 μmol/L阻断IK1,加入Dof 5 nmol/L阻断IKr,CdCl2100 μmol/L阻断ICa,L,TTX 100 μmol/L阻断INa。
5膜片钳全细胞记录
采用全细胞膜片钳记录方法,在电流钳模式下记录动作电位;在电压钳制下记录电流。膜片钳放大器(AXON-700B,USA)同计算机连接。刺激信号及电压输入信号的采集均由pCLAMP软件控制。玻璃毛坯(GG-17) 经微电极拉制仪(Narishige, pp-83) 拉制成电阻为2.0 ~ 4.5 MΩ的电极。调节三维操纵器进行封接, 使封接电阻达1 GΩ 以上, 吸破细胞膜形成全细胞记录模式。测定电容时,施以0.4 V/s 的斜坡刺激,测电流并按方程Cm=I/ (dV/dt) 计算,其中Cm为膜电容,I为电流值,dV/dt即电压斜率。为消除细胞间误差, 电流值以电流密度(pA/pF) 表示。信号经截止频率为1 kHz 的四阶贝塞尔低通滤波器滤波, 采样率为5 kHz。
6诱发电流参数的设定
6.1IK1的峰值电流测定 保持电位-80 mV,给予-190 mV~+10 mV、300 ms脉冲,记录IK1。
6.2IK1电流-电压曲线测定 保持电位-80 mV,给予-190 mV~+10 mV、300 ms的脉冲,记录IK1。以电流密度与测试电压作图,得IK1的电流-电压曲线。
6.3IKUr的峰值电流测定 保持电位-80 mV,施予-40 mV、20 ms预刺激失活钠通道,随即给予-50~ +50 mV、2 000 ms的脉冲,记录IKUr。
6.4IKUr电流-电压曲线测定 保持电位-80 mV,施予-40 mV、20 ms预刺激失活钠通道,随即给予-50~+50 mV、2 000 ms的脉冲,记录IKUr。以电流密度与测试电压作图,得IKUr的电流-电压曲线。
6.5IKUr稳态激活曲线测定 保持电位-80 mV,施予-40 mV、20 ms预刺激失活钠通道,随即给予-60~+70 mV、2 000 ms脉冲,记录IKUr。标准化各电流幅值,以相对电流对各膜电位作图得稳态激活曲线,并用Boltzmann 方程I/Imax={1+exp[-(V1/2-Vm)/k]}-1进行曲线拟合,其中V1/2为半激活电压,k为激活曲线斜率。
6.6IKUr稳态失活曲线测定 采用典型的双刺激模式,保持电位-80 mV,施予-40 mV、20 ms的预刺激失活钠通道,紧接着给予+60 mV、5 000 ms的条件刺激,紧接着给予-50 ~+45 mV、 阶跃5 mV的系列测试刺激,记录IKUr。标准化各电流幅值,以相对电流对各膜电位作图得稳态失活曲线。用Boltzmann方程I/Imax={1+exp[-(V1/2-Vm)/k]}-1进行曲线拟合求出半失活电压 (V1/2) 和曲线斜率(k)。
6.7IKUr失活后恢复曲线测定 采用典型的双刺激模式,保持电位-80 mV,施予-40 mV、20 ms的预刺激失活钠通道,紧接着给予+60 mV、2 000 ms刺激,间隔1.5、3.0、6.0、12.5、25、50、100、200、400、800 ms 不同时间,给予+60 mV、2 000 ms测试刺激,记录IKUr。标准化各电流幅值,以相对电流对间隔时间作图,得失活后恢复曲线。
6.8IKUr作用频率依赖性测定 保持电位-80 mV,给予+60 mV、200 ms重复刺激,每个刺激串为20个刺激脉冲,刺激频率分别为1 Hz和3 Hz。
7统计学处理
结 果
1胡椒碱和(或)H2O2对兔心房肌IK1峰值电流密度的影响
当细胞暴露于50 μmol/L H2O2时,IK1电流密度明显降低,从对照组的(-148.2±16.7) pA/pF 降低至(-64.2±9.8)pA/pF,而事先用7 μmol/L 胡椒碱处理细胞,其电流密度恢复到(-113.8±15.4)pA/pF,与对照组相比无显著差异,而与H2O2组比差异极其显著(P<0.01,n=16),而单用胡椒碱组IK1为(-135.5±16.1)pA/pF,与对照组相比无显著差异,见图1。


图1胡椒碱和(或)H2O2对兔心房肌细胞IK1峰值电流密度的影响
2胡椒碱和(或)H2O2对兔心房肌IK1电流-电压曲线的影响
从图2可见,该电流在超极化时被激活,随着超极化电压的增加,电流幅值显著增大,该电流呈现出明显的内向整流特征,即随着刺激脉冲向正方向移动,电流幅值由于内向整流而降低。当细胞暴露于50 μmol/L H2O2时,IK1在个电压下电流密度明显降低,随着电压向着更负的方向移动,这种效应更加明显,在超极化时尤甚。应用7 μmol/L胡椒碱后,电流密度的改变得到缓解,随着电压向超极化方向移动,药物效应增大,见图2。
3胡椒碱和(或)H2O2对兔心房肌IKUr峰值电流密度的影响
当细胞暴露于50 μmol/L H2O2时,IKUr电流密度明显降低,从对照组的(16.0±2.1 )pA/pF 降低至(6.1±1.4)pA/pF(P<0.01,n= 18),而事先用7 μmol/L 胡椒碱处理细胞,其电流密度恢复到(11.3±1.8)pA/pF,与H2O2组比差异极其显著(P<0.01,n=18)。虽然电流密度有所恢复,但与对照组相比,仍有明显差异(P<0.05,n= 18),见图3。


图2胡椒碱和(或)H2O2对兔心房肌细胞IK1电流-电压曲线的影响
4胡椒碱和(或)H2O2对兔心房肌IKUr电流-电压曲线的影响
由图4所示,该电流随着电压向去极化方向增加,电流密度增大,且呈一定的外向整流特征。当细胞暴露于50 μmol/L H2O2时,IKUr在各电压下电流密度明显降低,随着电压向着去极化的方向移动,这种效应更加明显,在-30 mV时,作用基本达到稳态,之后随着电压正移,电流密度不再增加,电流-电压曲线近乎直线。应用7 μmol/L胡椒碱后,电流密度的改变得到缓解,尤其是在-50 mV~0 mV的范围内,电流-电压曲线恢复尤其明显,之后随着电压向去极化方向移动,电流密度虽然有所恢复,但仍呈一定的稳态特征。这提示胡椒碱在电压正移至0 mV后作用的电压依赖性不明显,见图4。


图3胡椒碱和(或)H2O2对兔心房肌细胞IKUr峰值电流密度的影响
5胡椒碱和(或)H2O2对兔心房肌细胞IKUr激活曲线的影响
细胞暴露于50 μmol/L H2O2时,激活曲线右移,即向去极化方向移动(图5A),V1/2从对照的(-11.55±0.78)mV移到(-1.07±0.08)mV(n=18,P<0.01),提示H2O2使通道的激活阈值和通道的充分开放电压右移。应用胡椒碱后得以部分恢复,V1/2变为(-3.67±0.26)mV(图5B)。但无论是应用H2O2或加用胡椒碱,k变化不大,4组的k分别为:control:(11.27±1.03)mV;H2O2:(12.71±1.05)mV;H2O2+ PIP:(11.96±0.97)mV,PIP:(11.57±1.13)mV(图5C)。
6胡椒碱和(或)H2O2对兔心房肌细胞IKUr失活曲线的影响
应用50 μmol/L H2O2后,失活曲线左移,即向超极化方向移动(图6A),V1/2从对照的(-6.76±0.94)mV移到(-15.87±0.62)mV(n= 18,P< 0.01),同时应用胡椒碱后,此移动效应得到缓解半失活电压为(-11.23±1.17)mV(图6B)。同样仅用H2O2时,稳态失活曲线斜率增加,从对照组的(9.83±0.57)mV升高到(12.46±0.42)mV(n=18,P< 0.05),应用胡椒碱后则升高至(11.27±0.57)mV,提示H2O2可通过使通过失活负移以及升高失活曲线斜率而加速其失活过程,从而降低电流密度(图6C)。


图4胡椒碱和(或)H2O2对兔心房肌细胞IKUr电流-电压曲线的影响
7H2O2对兔心房肌IKUr失活恢复动力学的影响及胡椒碱的作用
从图7可见,50 μmol/L H2O2可使恢复曲线明显减慢,即在同一时间间隔下,通道恢复降低,电流幅值减少,此现象在钳夹100 ms时表现尤甚,加用胡椒碱后此现象得到缓解。
8H2O2对兔心房肌IKUr作用频率依赖性的影响及胡椒碱的作用
对照组的电流在1 Hz和3 Hz不同频率刺激下变化不大。而应用50 μmol/L H2O2后,无论是1 Hz还是3 Hz频率的刺激,均使电流明显降低,且在3 Hz频率的刺激时,电流降低更显著。同时灌流H2O2和胡椒碱后,也发生类似于H2O2的作用结果,只是电流改变的幅度相对较小而已,同时H2O2对IKUr的抑制作用存在着频率依赖性或使用依赖性特征,见图8。


图5胡椒碱和(或)H2O2对兔心房肌细胞IKUr激活曲线的影响


图6胡椒碱和(或)H2O2对兔心房肌细胞IKUr失活曲线的影响

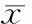
图7H2O2和(或)胡椒碱对兔心房肌细胞IKUr失活恢复动力学的影响


图8H2O2和(或)胡椒碱对兔心房肌细胞IKUr作用频率依赖性的影响
讨 论
胡椒碱可以对抗H2O2诱导的心肌细胞损伤,而且3种浓度(7 μmol/L、0.7 μmol/L和0.07 μmol/L) 均有保护作用,但7 μmol/L效果较好,且对心肌细胞无损伤作用[6],故本文采用7 μmol/L这一浓度。
本研究结果表明,在H2O2的作用下,兔心房肌细胞IK1电流密度明显降低,使I-V曲线上移;而使IKUr电流密度明显降低,电流-电压曲线下移,通道稳态激活曲线右移,通道稳态失活曲线左移及恢复时间减慢,而且存在频率依赖性特征。预先给予7 μmol/L胡椒碱,明显减轻H2O2对IK1和IKUr的抑制作用,并可减轻H2O2对超速激活的延迟整流钾通道动力学的异常影响。
IK1主要参与维持心肌细胞的静息电位(RP)和动作电位(AP)3期快速复极化过程,本实验在H2O2的作用下,其抑制兔心房肌细胞的IK1,H2O2对IK1的影响国内外鲜有报道,徐长庆等[7]研究显示H2O2明显抑制IK1,而Ward等[8]报道H2O2对IK1无明显影响,但他们的研究均是在心室肌水平。在心房肌水平,本文第一次揭示了H2O2对心房肌细胞IK1的抑制作用。这种抑制作用必然导致其RP降低,使阈刺激变小,可导致心房肌细胞兴奋性增强;另外IK1是背景钾电流,其抑制也会造成心房肌细胞自律性增强,上述两种作用必然导致在H2O2抑制IK1的情况下,心房肌细胞的兴奋性、自律性增强,从而更容易引起心律失常特别是心房颤动(房颤)的发生。大量研究显示,氧化应激与房颤关系密切[9-11]。而H2O2对IK1的这种抑制作用,可能就是氧化应激与房颤相关的一部分机制。
IKUr是近年来发现的一种仅在心房肌细胞特异表达的离子通道电流[12],主要是心房肌细胞复极Ⅱ期的外向离子流,能促进动作电位3期复极,是有效不应期和动作电位时限的决定因素之一[13],同时IKUr对信号传递、心肌细胞兴奋性、不应性、传导性稳态的维持有重要作用[9]。本实验在H2O2的作用下,兔心房肌细胞IKUr电流密度明显降低,电流-电压曲线下移。H2O2对心房肌细胞IKUr的影响国内外报道较少,仅张光伟等[14]报道H2O2对IKUr的影响存在浓度依赖性,H2O2在0.1~0.75 μmol/L,表现为促进作用,而在0.75~10 μmol/L,表现为抑制作用,本文浓度为50 μmol/L,与其一致。H2O2对心房肌细胞IKUr的抑制,其机制可能为:通道稳态激活曲线右移,使得在相同电压条件下,通道激活的数量减少,电流减小;通道稳态失活曲线左移,使得在相同电压条件下,通道失活的数量增多,电流减小;恢复时间减慢,使得通道的恢复时间延长,电流减小,以上3种IKUr通道动力学的变化最终导致在H2O2的作用下,IKUr减小。大量研究显示:氧化应激与心房颤动关系密切[9-11]。所以,H2O2对IKUr的这种抑制作用可能就是氧化应激导致心房肌细胞发生电重构的机制。
本实验显示胡椒碱可以部分对抗H2O2对IK1和IKUr的抑制作用,使得IK1和IKUr部分恢复,其机制可能为:胡椒碱可以增加内源性抗氧化剂的含量,并且可以减轻氧自由基对多不饱和脂肪酸的攻击,减轻脂质过氧化损伤,从而达到减少氧化应激反应对细胞造成伤害的目的[2,15]。另外,胡椒碱还可以直接清除氧自由基,具有直接对抗H2O2的作用[16]。我们前期研究显示[2],在低浓度H2O2的作用下兔左心房肌细胞超氧化物歧化酶(SOD)的活力和谷胱甘肽(GSH)的含量降低,丙二醛(MDA)生成增加;而加入胡椒碱组的上述指标显著改善,SOD能催化超氧化物阴离子发生歧化反应,是一种重要的抗氧化酶;GSH是大多数活细胞中巯基的主要来源,对于维护蛋白巯基适当的氧化还原状态具有重要作用;MDA是一种脂质过氧化物,可以通过多不饱和脂肪酸的过氧化反应引起细胞损伤。胡椒碱能够在细胞受到氧化损伤过程中增强抗氧化酶的活性,减轻氧自由基对多不饱和脂肪酸的攻击,减轻脂质过氧化损伤。从而达到减少氧化应激反应对细胞造成伤害的目的。另外,线粒体是细胞内氧化磷酸化和形成ATP的主要场所,同时也是氧自由基产生的重要部位,有自身的DNA和遗传体系。mtDNA为闭合环状双链结构,在高活性氧自由基的环境中,极易受到氧化损伤并进一步导致突变[17]。当损伤到线粒体调控基因及mtDNA间的协调机制时,细胞氧化磷酸化能力受损,线粒体合成ATP的能力下降。由于机体的需要,mtDNA代偿性上调,从而导致线粒体mRNA表达增加[18]。我们的前期研究发现[2]:和对照组比较,H2O2组线粒体mRNA的表达明显增高,而胡椒碱组则无显著变化。这提示在细胞受到H2O2的损伤时由于功能代偿的需要,mtDNA的拷贝数增加,而胡椒碱能够增强抗氧化酶的活性,减少氧自由基的产生,减弱脂质过氧化对线粒体膜损伤,使得氧化损伤时线粒体氧化磷酸化的功能得到一定程度的保护。
所以,本研究从另一个侧面提示:胡椒碱可以通过对抗过氧化氢来减轻氧化应激对心房肌的损伤,进而阻断或延缓心房肌细胞电流的重构,进而防止或延缓房颤的发生及维持。
[1] Srinivasan K. Black pepper and its pungent principle-piperine: a review of diverse physiological effects[J]. Crit Rev Food Sci Nutr, 2007, 47(8):735-748.
[2] 田 苗, 刘 屏, 王自玲, 等. 胡椒碱减轻兔原代左心房肌细胞氧化应激损伤的作用[J]. 心脏杂志, 2011, 23(4):426-428.
[3] 张 然, 余志斌, 王云英. 成年小鼠心肌细胞分离技术[J]. 生理学报, 2004, 56(5):656-660.
[4] 刘忠保, 杨晓丽, 张苏丽, 等. 抗心脏AT1受体抗体对大鼠心室肌细胞离子电流的影响[J]. 中国病理生理杂志, 2010, 26(11):2118-2123.
[5] 巫少荣, 李自成, 余 健, 等. 大蒜素对心室肌细胞膜钠通道电流的影响[J]. 中国病理生理杂志, 2011, 27(4):658-661.
[6] 王 波, 孙 艳, 刘 屏,等. 回心草单体成分对H2O2诱导心肌细胞损伤的保护作用研究[J]. 解放军药学学报, 2006, 22(3):164-167.
[7] 徐长庆, 李玉荣, 杨宝峰. 氧自由基致豚鼠心室肌细胞跨膜电位变化的离子电流基础[J]. 中国应用生理学杂志, 2000, 16(2):121-123.
[8] Ward CA, Giles WR. Ionic mechanism of the effects of hydrogen peroxide in rat ventricular myocytes[J]. J Physiol, 1997, 500(Pt 3):631-642.
[9] Nattel S, Burstein B, Dobrev D. Atrial remodeling and atrial fibrillation: mechanisms and implications[J]. Circ Arrhythmia Electrophysiol, 2008, 1(1):62-73.
[10]Lin YK, Lin FZ, Chen YC, et al. Oxidative stress on pulmonary vein and left atrium arrhythmogenesis[J]. Circ J, 2010, 74(8):1547-1556.
[11]Huang CX, Liu Y, Xia WF, et al. Oxidative stress: A possible pathogenesis of atrial fibrillation[J]. Med Hypothese, 2009, 72 (4):466-467.
[12]Wang Z, Fermini B, Nattel S. Sustained depolarization-induced outward current in human atrial myocytess. Evidence of a novel delayed rectifier K+current similar to Kv 1.5 cloned channel currents[J]. Circ Res, 1993, 73(6):1061-1076.
[13]Van Wagoner DR. Pharmacologic relevance of K+channel remodeling in atrial fibrillation[J]. Mol Cell Cardiol, 2000, 32(10):1763-1766.
[14]张光伟, 谷天祥, 王 春, 等. H2O2对人心房肌细胞IKUr和ICa,L的浓度依赖性双向影响[J]. 生理学报, 2008, 60(6):695-703.
[15]Hu Y, Guo DH, Liu P, et al. Antioxidant effects of a Rhodobryum roseum extract and its active components in isoproterenol-induced myocardial injury in rats and cardiac myocytess against oxidative stress-triggered damage[J]. Pharmazie, 2009, 64(1):53-57.
[16]Mittal R, Gupta RL.Invitroantioxidant activity of piperine[J]. Methods Find Exp Clin Pharmacol, 2000, 22(5):271-274.
[17]Wallace KB. Doxorubicin induced cardiac mitochondrionopathy[J]. Pharmacol Toxicol, 2003,93(3):105-115.
[18]Chang JC, Kou SJ, Lin WT, et al. Regulatory role of mitochondria in oxidative stress and atherosclerosis[J]. World J Cardiol, 2010, 2(6):150-159.
Effectsofpiperineonabnormalitiesofinwardrectifierpotassiumcurrentandultrarapiddelayedrectifierpotassiumcurrentinducedbyhydrogenperoxideinrabbitatrialmyocytes
LIU Yan1, LI Yang2, LIN Kun1, TIAN Miao1, WANG Yu-tang1, SHAN Zhao-liang1
(1DepartmentofCardiology,2InstituteofGeriatricCardiology,ChinesePLAGeneralHospital,Beijing100853,China.E-mail:shanzl301@sina.com)
AIM: To study the protective effect of piperine on abnormalityies of inward rectifier potassium current (IK1) and ultra rapid delayed rectifier potassium current (IKUr) induced by hydrogen peroxide (H2O2) in single rabbit atrial myocytes.METHODSThe technique of whole-cell patch-clamp was used to study the effect of H2O2at concentration of 50 μmol/L onIK1andIKUrin single rabbit atrial myocytes. The protective effect of pretreatment with piperine (7 μmol/L) was also observed.RESULTSThe piperine at concentration of 7 μmol/L had no significant effect onIK1andIKUrand their channel dynamics. In the presence of H2O2at concentration of 50 μmol/L, the peak currents ofIK1andIKUrreduced significantly (P<0.05).The steady-state activation curve ofIKUrwas shifted right, the steady-state inactivation curve ofIKUrwas shifted left, and the recovery from inactivation ofIKUrwas shifted downward. TheIKUrshowed frequency-dependent characteristics. Piperine at concentration of 7 μmol/L significantly alleviated the inhibitory effect of H2O2onIK1andIKUr(P<0.01). In addition, piperine protected against the changes ofIKUrdynamics induced by H2O2.CONCLUSIONPiperine alleviates the abnormalities ofIK1andIKUrinduced by oxidative stress in atrial myocytes.
Piperine; Hydrogen peroxide; Atrial myocytes; Inward rectifier potassium current; Ultra rapid delayed rectifier potassium current
R363
A
10.3969/j.issn.1000-4718.2012.05.013

