我国自身免疫性胰腺炎共识意见(草案 2012,上海)
《中华胰腺病杂志》编委会
·标准与讨论·
我国自身免疫性胰腺炎共识意见(草案 2012,上海)
《中华胰腺病杂志》编委会
本共识意见(草案)依据我国自身免疫性胰腺炎的最近研究,并参考国际相关指南和研究进展,由《中华胰腺病杂志》编委会组织消化、内镜、影像、风湿免疫、病理、检验、内分泌、外科等多学科专家集体讨论形成。希望同道们参考并提出宝贵意见,以期提高我国自身免疫性胰腺炎的诊治水平。
自身免疫性胰腺炎(autoimmune pancreatitis,AIP)是一种以梗阻性黄疸、腹部不适等为主要临床表现的特殊类型的胰腺炎。AIP由自身免疫介导,以胰腺淋巴细胞及浆细胞浸润并发生纤维化、影像学表现胰腺肿大和胰管不规则狭窄、血清IgG4水平升高、类固醇激素疗效显著为特征。AIP是IgG4相关性疾病(IgG4-related disease,IgG4-RD)在胰腺的局部表现,除胰腺受累外,还可累及胆管、泪腺、涎腺、腹膜后、肾、肺等,受累器官也可见大量淋巴细胞、浆细胞浸润及IgG4阳性细胞。由于AIP易被误诊为胰腺癌而导致不必要的手术,近年来逐渐引起重视。此外,与IgG4无关的AIP亚型也渐得到公认,据此将AIP分为1型和2型。因我国2型AIP少见,本文如无特别说明,所述AIP均指1型AIP。
一、概述
历经几十年研究,对AIP的认识逐渐清晰。1961年Sarles等首次报道慢性胰腺炎(chronic pancreatitis,CP)患者合并高γ-球蛋白血症,认为这种胰腺炎与自身免疫相关,并将其称为原发性硬化性胰腺炎;上世纪70年代有研究者报道干燥综合征(Sjögren′s syndrome,SjS)合并的胰腺炎及胰腺肿块经类固醇激素治疗后好转;1992年Toki等报道4例CP患者主胰管弥漫性不规则狭窄,与一般的CP胰管扩张不同;1995年Yoshida等正式提出AIP的命名,至今已被广泛接受。近年来,AIP病例报道不断增多,对AIP的认识逐渐深入,两种AIP亚型的异同更加明确(表1),各国AIP诊断标准相继问世,为AIP的临床诊治及基础研究提供了重要依据。
二、流行病学
AIP在全球各地区散在分布,目前日本报道AIP最多,欧美、韩国也有较多报道。我国近年来关于AIP的报道逐渐增多,已有300余例,大陆、台湾均见报道,香港、澳门迄今尚无报道。AIP在全球人群的发病率尚不清楚。2007年日本的全国调查估计其年发病率为0.9/10万。目前全球所报道AIP以1型为主,亚洲2型AIP少见,欧美2型AIP相对多见(20%~30%)。国外报道的AIP病例数约占同期CP的2%~10%,我国报道的这一比例为3.6%~9.7%。AIP的男女患者比例约为2∶1,多见于老年人,大部分患者初次发病年龄超过50岁,但也可于青少年期发病。AIP易被误诊为胰腺癌,为因疑诊胰腺癌而行手术切除最常见的良性病变,约占所有胰十二指肠切除术的2.5%左右。

表1 1、2型AIP的比较
三、发病机制
AIP患者常伴血清γ-球蛋白、IgG或IgG4水平升高,组织病理学可见胰管周围大量淋巴细胞、浆细胞浸润,激素治疗有效,提示AIP的发生与自身免疫机制有关,但其病因及具体发病机制尚不清楚。
(一)体液免疫
AIP患者常出现胰腺外器官受累且病理所见相似,提示胰腺与这些器官(涎腺、胆管以及肾小管等)之间可能存在共同抗原。基于胰腺、涎腺、胆管以及远端肾小管均有碳酸酐酶Ⅱ(carbonic anhydraseⅡ,CA-Ⅱ)及乳铁蛋白(lactoferrin,LF)分布,且抗碳酸酐酶Ⅱ抗体(ACA-Ⅱ)和抗乳铁蛋白抗体(ALF)在AIP患者中阳性率较高,有研究者认为CA-Ⅱ及LF是AIP可能的靶抗原。此外,部分患者抗核抗体(ANA)、类风湿因子(RF)等自身免疫抗体阳性,也提示AIP发病机制与体液免疫相关。
尽管AIP患者血清IgG4水平常升高且受累器官可见大量IgG4阳性浆细胞浸润,但IgG4在AIP发病中的意义仍不清楚。现在普遍认为,持续、大量的IgG4阳性浆细胞浸润可能是机体对AIP未知触发因素的一种继发性反应。
(二)细胞免疫
尽管AIP的效应细胞尚不清楚,但与酒精性CP及胆源性胰腺炎相比,AIP患者胰腺组织以及外周血中激活的、携带HLA-DR的CD4+及CD8+T细胞显著增加。CD4+T细胞根据其分泌的细胞因子又可分为Th1及Th2细胞。Th1细胞分泌IL-2、TNF-α、γ干扰素以介导细胞免疫、巨噬细胞活化、细胞毒性及辅助B细胞产生补体;Th2细胞产生IL-4、5、6、10以促进体液免疫和过敏反应。在SjS和原发性硬化性胆管炎(primary sclerosing cholangitis,PSC)中,主要的浸润细胞为CD4+HLA-DR+Th1细胞,而CD8+T细胞及B细胞较少,而某些AIP中的CD4+Th1细胞与SjS中发现的浸润细胞类似,提示可能是由Th1细胞产生的细胞因子参与诱发AIP的发病和(或)疾病状态的维持,而Th2细胞产生的细胞因子则与病程进展有关。一项动物实验用CA-Ⅱ或LF免疫切除胸腺的BALB/c小鼠,结果发现CD4+Th1细胞在AIP的早期发病中起主要作用。
最近,Seleznik等报道了淋巴毒素(lymphotoxin,LT)β受体信号通路在AIP发病中的作用。与对照组相比,AIP患者胰腺组织中LTα和β的mRNA水平升高,胰腺和血清标本的趋化因子表达(CXCL13、CCL19、CCL21、CCL1和B细胞活化因子)增加,应用激素治疗没有影响上述因子的表达上调。腺泡特异性的过表达LTαβ导致小鼠(Ela1-LTab)胰腺呈AIP表现,并伴有系统性自身免疫疾病表现。淋巴细胞缺陷小鼠(Ela1-LTab/Rag1-/-)未表现腺泡特异性的LTαβ过表达;缺乏促炎单核细胞(Ela1-LTab/Ccr2-/-)不能阻止AIP发生,但可避免早期胰腺组织损伤。使用激素可降低胰腺炎症程度,但不影响自身抗体的产生(如Ela1-LTab小鼠分泌型胰蛋白酶抑制物抗体)。相反,抑制LTβR信号通路可减少趋化因子表达、肾脏免疫复合物沉积以及Ela1-LTab小鼠的AIP表现。因此,研究者认为腺泡特异性地过表达LTαβ是AIP发病机制中的促进因素,中和LTβR配体可作为AIP潜在的治疗方法。
(三)遗传因素
目前有证据支持AIP与遗传因素相关。有研究报道,主要组织相容性复合体Ⅱ抗原与人类的AIP易感性相关。AIP易感因素在不同种族、不同地域之间有所不同,这种多样性提示可能存在某种内在抗原触发了AIP易感者的发病。Kawa等报道了人类白细胞抗原HLA DRB1*0405-DQB1*0401单倍体基因型是日本人群AIP的易感基因。Umemura等报道Fc受体样3基因(FCRL3)的多态性与日本人群的AIP发病有关。
(四)微生物感染
Guarneri等报道,幽门螺旋杆菌(Hp)感染可触发AIP易感者的发病。该研究发现,人类CA-Ⅱ和Hp在胃内赖以生存及增殖的重要酶α-CA在分子结构上具有高度同源性,且两者的同源片段均包含DRB1*0405的结合位点,提示Hp可能通过对宿主CA-Ⅱ结构的分子模拟,诱导宿主免疫细胞发生旁观者激活,从而导致易感者发生AIP。
(五)补体系统
Muraki等发现活动期AIP患者血清中循环免疫复合物水平增高,经过激素治疗后可显著降低。这些AIP患者循环免疫复合物水平的增高与血清IgG1水平升高、补体C3及C4水平降低显著相关,提示AIP患者高水平的循环免疫复合物可能通过激活补体系统而导致组织器官损伤。
四、组织病理学
(一)大体特征
肉眼观察AIP胰腺肿胀增大、切面呈灰黄色、质硬,疾病后期由于胰腺实质广泛纤维化从而导致胰腺萎缩和硬化。根据胰腺病变范围可分为弥漫性增大与局灶性肿块两种(图1)。弥漫性增大较常见,一般无钙化或囊性病变;局灶性AIP肿块多位于胰头部,也可位于体尾部。切面呈灰黄色或黄白色,正常小叶结构消失,纤维化明显,病变处胰管狭窄或阻塞。主胰管可呈弥漫性或节段性不规则狭窄,管腔横断面呈星形或不规则形。病程后期导管周围显著纤维化从而使管壁增厚、管腔狭窄甚至闭塞。如炎症累及胆总管胰腺段,则可见此段胆总管壁纤维化,大量淋巴细胞、浆细胞浸润使管壁增厚、管腔狭窄,上段胆总管扩张。与一般的CP不同,AIP少有胰腺钙化、结石、假性囊肿及胰管扩张。少数病程较长患者可形成胰管结石,可能与主胰管不规则狭窄导致胰液积聚有关。
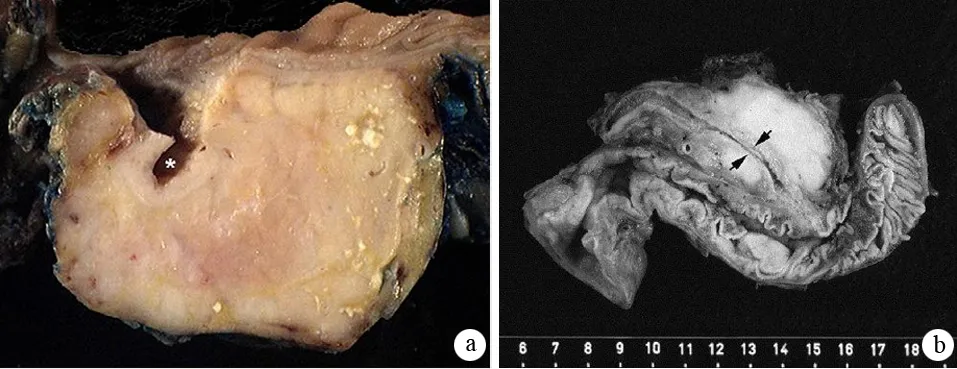
图1a:弥漫性AIP,全胰弥漫性增大;b:胰头部局灶性AIP,箭头示狭窄胰管(Krasinskas AM, et al. Gastroenterol Clin North Am, 2007; Klöppel G, et al. Pancreas, 2003)
(二)组织学特征
根据组织病理学镜下特征将AIP分为1、2两型:(1)1型AIP,其病理特征为不伴有粒细胞性上皮损害(granulocyte epithelial lesion,GEL)的淋巴浆细胞硬化性胰腺炎(lymphoplasmacytic sclerosing pancreatitis,LPSP);(2)2型AIP,其病理特征为伴有GEL的特发性导管中心性胰腺炎(idiopathic duct-centric pancreatitis,IDCP)。这两种亚型均有胰腺导管周围淋巴细胞、浆细胞浸润及纤维化,但又存在不同之处。LPSP的特征性表现包括以下4条(图2):(1)胰管周围弥漫性淋巴细胞、浆细胞浸润,无粒细胞浸润,炎症细胞浸润于导管上皮下,导管上皮未受浸润及损害;(2)胰管及静脉周围弥漫性席纹状纤维化(storiform fibrosis),尤其是胰周脂肪组织纤维化显著;(3)静脉周围大量淋巴细胞、浆细胞浸润导致闭塞性静脉炎;(4)免疫组化显示大量IgG4阳性浆细胞(>10个/高倍视野)。1型AIP在病程后期胰腺实质显著纤维化,小叶结构破坏,腺泡萎缩,偶尔可见残存的腺泡;小叶间隔增厚,受累胰腺导管狭窄或闭塞。1型AIP常可累及胆管、泪腺、涎腺、肺、肾等胰腺外器官,这些受累器官表现出与胰腺相似的炎症改变,如显著淋巴细胞及浆细胞浸润、弥漫性纤维化、有大量IgG4阳性浆细胞等。与LPSP相比,IDCP的席纹状纤维化和闭塞性静脉炎少见,IDCP的特征性表现包括以下2条(图3):(1)存在GEL,即中、小胰管的管腔及导管上皮内有大量粒细胞浸润,导致导管上皮毁损、管腔闭塞,有时可见小叶内导管有微脓肿形成,腺泡内也可有粒细胞浸润;(2)免疫组化显示没有或仅有少量IgG4阳性浆细胞(≤10个/高倍视野)。2型AIP部分合并炎症性肠病,一般不累及胰腺外器官。
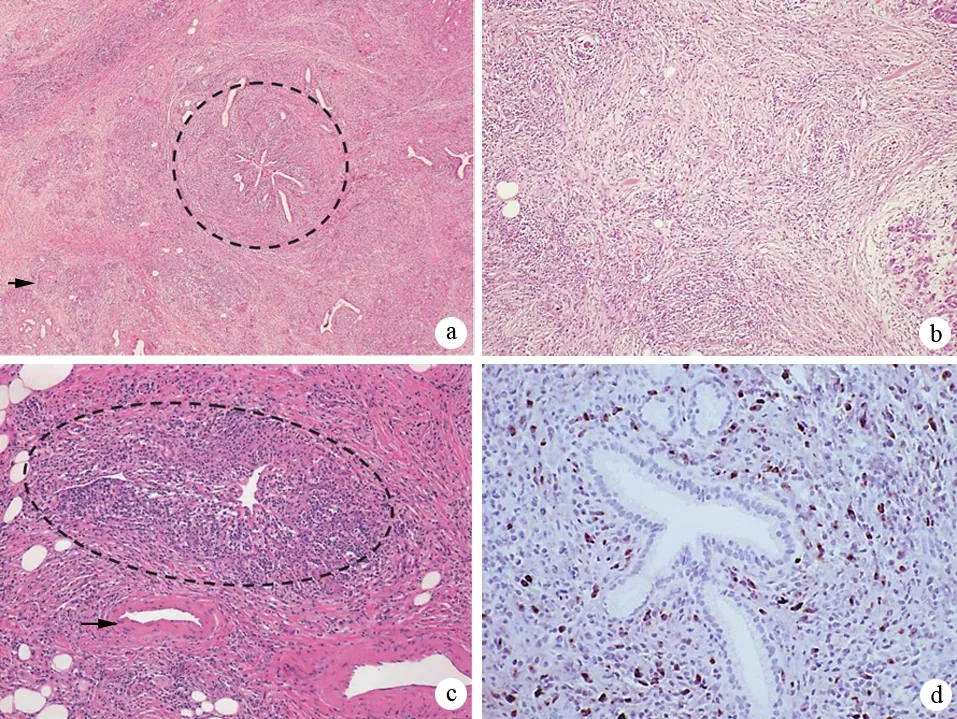
图21型AIP典型的组织病理学所见 a:低倍镜下示LPSP改变:胰腺导管周围显著淋巴细胞、浆细胞浸润(圆圈所示),伴席纹样纤维化和闭塞性静脉炎(箭头所示);b:席纹样纤维化表现:较短的胶原纤维在各个方向随机分布,填充炎性细胞和成纤维细胞;c:闭塞性静脉炎(圆圈所示),而附近的动脉没有受累(箭头所示);d:免疫组化显示导管周围大量IgG4阳性浆细胞(>30个/高倍视野)(Chari ST, et al. Pancreas, 2010)
五、临床表现
1型和2型AIP的临床表现既有相似之处,也存在不同。
1型AIP多见于中老年男性,平均发病年龄60岁,起病隐匿,临床表现多样,包括胰腺表现及胰腺外表现。
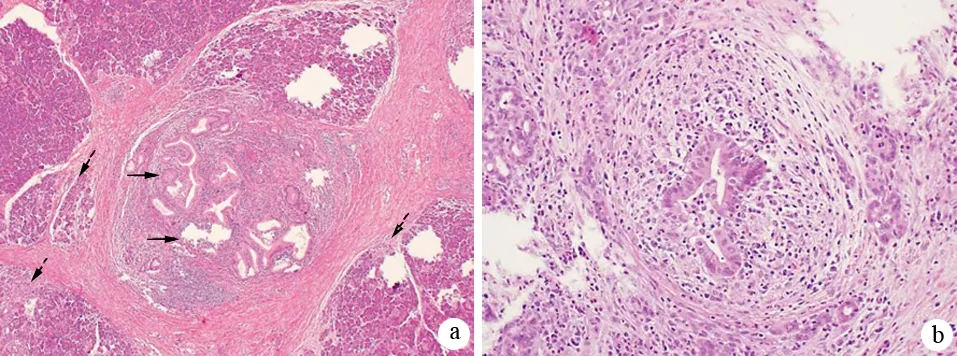
图32型AIP典型的胰腺组织病理学所见 a:低倍镜下显示导管周围淋巴细胞、浆细胞和中性粒细胞浸润,伴有上皮内炎症和小导管破坏(实箭头)以及小叶内的淋巴细胞、浆细胞和中性粒细胞浸润(虚箭头),未见LPSP中显著的席纹样纤维化表现;b:粒细胞性上皮损害(GEL),导管周围和上皮内中性粒细胞浸润,破坏导管上皮,常形成微脓肿(Chari ST, et al. Pancreas, 2010)
(一)胰腺表现
约3/4患者出现梗阻性黄疸,多为轻中度,也可为重度,可呈进行性或间歇性;约1/3患者有体重减轻;约1/2患者可有糖尿病;约2/5患者有非特异性的轻度上腹痛或上腹不适,可向背部放射。这些临床表现与胰腺癌相似。还有部分患者(约15%)表现为腹痛甚至是急性胰腺炎,或因体检时发现胰腺肿大来就诊。另外,患者可伴有腹泻以及全身不适、乏力、恶心、呕吐等非特异性症状,症状可持续数周至数月。体格检查可有皮肤、巩膜黄染,部分有上腹部轻压痛,也可无阳性体征。
(二)胰腺外表现
AIP的胰腺外表现可与胰腺病变程度不平行,可在胰腺表现之前、同时或之后出现,患者可出现相应体征,体格检查应予以重视。
1.硬化性胆管炎:即IgG4相关性胆管炎(IgG4-associated cholangitis,IAC)。胆管是最易受累的胰腺外器官,约60%~74%AIP患者伴有IAC,可出现梗阻性黄疸。胆总管胰腺段受累时,易被误诊为胰腺癌;肝门及肝内胆管受累时易被误诊为PSC。
2.涎腺炎和泪腺炎:亚洲人多见,可表现为涎腺或泪腺肿大,临床症状与干燥综合征相似。与干燥综合征不同的是,AIP累及的涎腺或泪腺表现为大量IgG4阳性浆细胞浸润,且很少出现血清抗SSA/SSB阳性,提示二者的发病机制不同。
3.腹膜后纤维化:AIP伴发腹膜后纤维化的比例为8%~16%。患者多无明显临床症状,少数患者因纤维组织压迫大血管和输尿管导致下肢水肿或肾积水。
4.淋巴结病:AIP可伴有腹腔、肺门及颈部等淋巴结肿大,表现为淋巴滤泡增生、免疫母细胞及浆细胞浸润,IgG4+/IgG+比例高于其他原因引起的淋巴结肿大,但无典型的席纹状纤维化及静脉炎。该类患者血清血管紧张素转化酶正常,没有结节病的典型表现,大多数激素治疗有效。
5.其他:AIP还可伴有间质性肺炎、肾小管间质性肾炎、眶周肿物、肝脏炎性假瘤等,表现相应临床症状,激素疗效明显。
与1型AIP相比,2型AIP发病年龄更年轻(平均50岁左右)、男女比例无差异、腹痛及急性胰腺炎比例较高、胰腺外器官很少受累。20%~30%的2型AIP患者合并炎症性肠病,尤其是溃疡性结肠炎。
六、影像学
影像学检查是诊断AIP的重要依据,常用检查包括腹部超声、计算机断层扫描(CT)、核磁共振成像(MRI)、超声内镜(EUS)、内镜下逆行性胰胆管造影术(ERCP)、正电子发射断层显像(PET)等。
(一)腹部超声
弥漫性AIP的腹部超声征象为胰腺弥漫性增大,呈“腊肠样”,回声减低,伴有散在斑点状高回声,胰腺周边可伴有低回声“包膜样边缘(capsule-like rim)”。局灶性AIP的腹部超声征象为局部低回声团块,易与胰腺癌混淆。腹部超声可作为AIP的初筛检查,但诊断的敏感性不高。
(二)CT
弥漫性AIP的CT典型征象为胰腺弥漫性增大呈“腊肠样”;胰腺实质密度降低,动态增强扫描可见均匀、延迟强化;部分患者胰周出现界限清晰、平整的低密度包膜样边缘,是AIP的特征性表现。局灶性AIP的典型征象为低密度肿块,易与胰腺癌混淆;动态增强后肿块可出现延迟、均质强化,有助于与胰腺癌鉴别。AIP少见胰管扩张、胰管结石和假性囊肿等一般CP的CT征象(图4)。
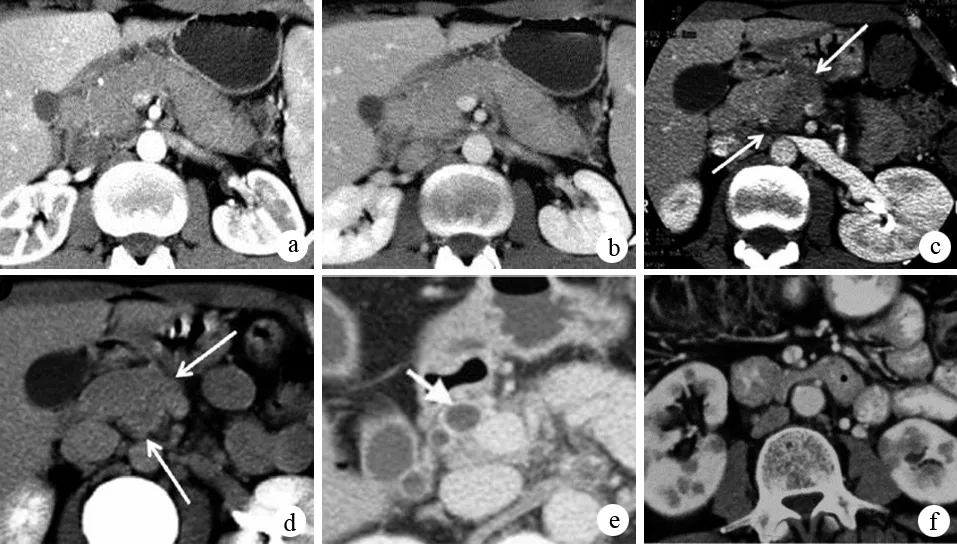
图4AIP在CT征象 a、b:胰腺弥漫性增大,呈腊肠样改变,增强早期仅轻度强化(a),延迟期明显强化(b),胰周有低密度包膜样边缘;c、d:局灶性AIP表现为胰头低密度肿块,在增强早期仅轻度强化(c),延迟期明显强化(d);e:胆总管扩张,管壁明显增厚;f:两肾皮质多发楔形低强化病灶,为AIP合并肾小管间质性肾炎表现(Takahashi N, et al. Radiology, 2007; Sahani DV, et al. Radiology, 2009)
(三)MRI和MRCP
MRI T1加权显示胰腺弥漫增大或局灶性肿块,呈略低信号,T2加权呈稍高信号,可见胰周低信号包膜样边缘;MRI动态增强扫描动脉期无强化或轻度强化,门脉期或延迟期出现强化(图5)。典型MRCP征象为主胰管较长、多发的不规则狭窄,可伴有胆管狭窄,呈硬化性胆管炎表现。MRCP对胰管成像的准确性尚不及ERCP。有研究认为,MRI与CT对AIP胰腺形态改变具有同等价值,但对早期灌注降低、胰周包膜样边缘、胰管不规则狭窄、胆管受累等征象,MRI优于CT。
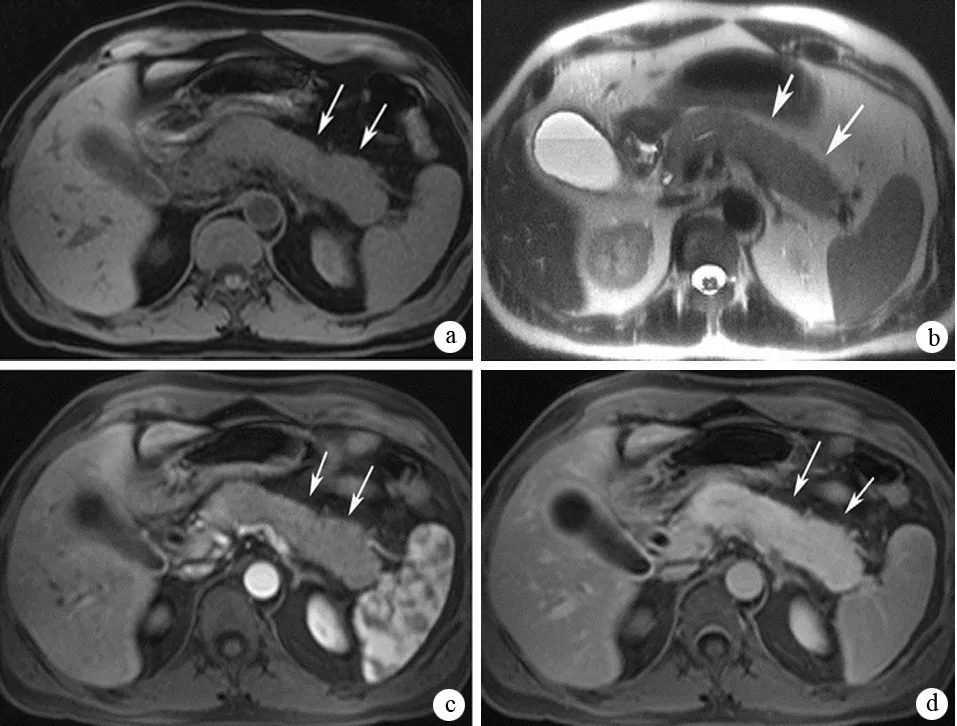
图5AIP的MRI征象 a:T1加权见腊肠样胰腺,较肝脏、脾脏呈低信号,正常小叶结构消失;b:T2加权见胰腺较肝脏高信号,与脾脏等信号;c、d:动态增强MRI显示胰腺实质延迟增强(Manfredi R, et al. 2011, Radiology)
(四)EUS及IDUS
EUS可较好地观察胰腺实质和胰、胆管,并可获取细胞学或组织学标本,对AIP的诊断和鉴别诊断具有重要价值。EUS主要征象为胰腺弥漫性增大或局部肿块,多呈低回声伴内部高回声光点,边缘呈波浪样改变,可见“导管穿透征”;胆管受累者呈管壁增厚、回声减低,可有内外高回声、中间低回声的“三明治状”征象;部分患者可见胰周淋巴结肿大(图6)。近年来,造影增强EUS的应用逐渐广泛,AIP患者注射声学造影剂后可见胰腺肿块均匀的血流信号增强,具有一定的诊断价值。EUS-FNA细胞学检查有助于AIP与胰腺癌的鉴别诊断,但FNA所得标本量少,难以做出AIP的组织病理学诊断。Trucut针穿刺更有助于组织病理学诊断。IDUS主要征象为受累胆管壁呈均匀的、同心圆性增厚,外层光滑。
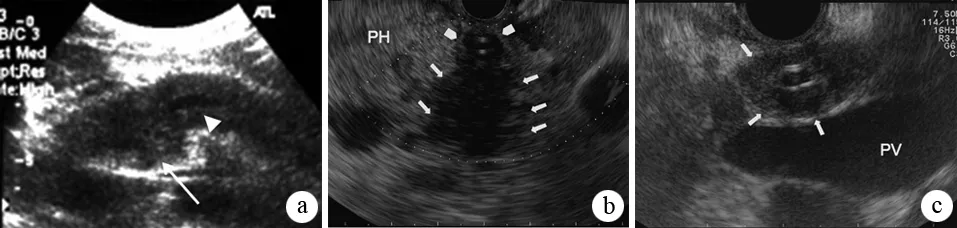
图6AIP的典型EUS征象 a:长箭头显示胰头低回声肿块,短箭头显示主胰管穿透肿块;b:长箭头显示胰腺低回声肿块,短箭头显示增厚的胆总管;c:增厚的胆总管呈内外高回声、中间低回声的“三明治状”(Ohtsubo K, et al. J Pancreas, 2008; Buscarini E, et al. Dig Liver Dis, 2010)
(五)ERCP
ERCP典型征象为胰管纤细和狭窄(>1/3全长)、狭窄胰管的近端(upstream)无显著扩张(<5 mm)、胰管可呈多处狭窄、狭窄段可见分支胰管等(图7)。累及胆管者可见胆管不同水平狭窄,少数患者呈PSC样表现。
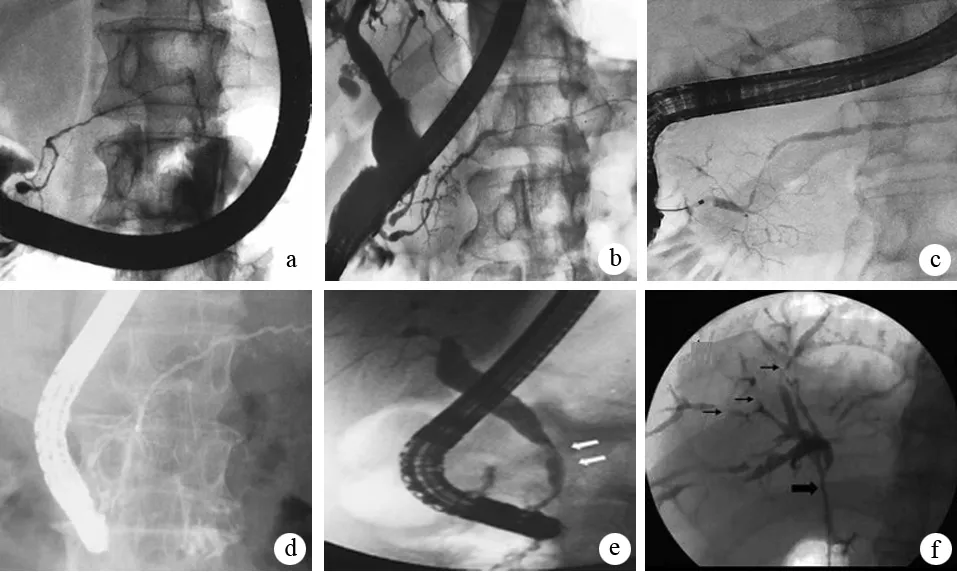
图7AIP在ERCP下的表现 a:显示典型的主胰管弥漫性、不规则狭窄;b:显示主胰管多发性、节段性狭窄;c:显示主胰管局灶性狭窄;d:显示主胰管弥漫性狭窄及胆总管下段狭窄;e:胆总管中下段狭窄;f:粗箭头显示肝门部胆管狭窄,细箭头显示肝内胆管多发节段性狭窄 (Okazaki K, et al. J Gastroenterol, 2010;Buscarini E, et al. Dig Liver Dis, 2010;Law R, et al. Cleve Clin J Med, 2009.)
(六)PET
PET能够反映病变器官的代谢情况,对AIP的诊断价值日益受到重视。AIP的典型代谢表现为胰腺弥漫性摄取增高(图8),部分患者可见涎腺、下颌下腺、肾脏等胰腺外摄取增高病灶,有助于与胰腺癌鉴别。激素治疗后,胰腺及胰腺外病灶的摄取程度显著降低,与临床症状和其他影像学表现一致。
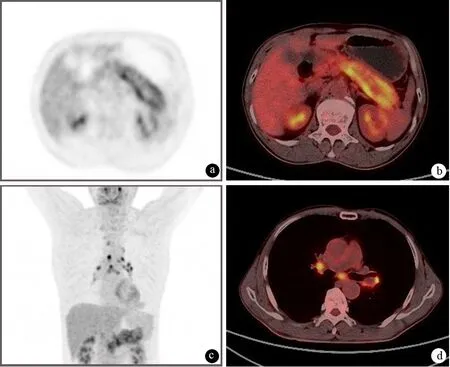
图81型AIP的PET及PET-CT征象 a、b:可见胰腺弥漫性摄取增加;c、d:可见纵隔多发淋巴结摄取增高(上海长海医院提供)
七、实验室检查
AIP的实验室检查主要包括以下几方面:
(一)高γ-球蛋白血症及高IgG4血症
1型AIP患者常有血清γ-球蛋白、总IgG尤其是IgG4水平升高。血清IgG4升高是AIP患者的特征性表现,不同研究报道IgG4敏感性为50%~90%;以IgG4高于正常值上限2倍作为AIP诊断依据,其准确性>95%。但值得注意的是,IgG4升高并非AIP特有,约7%~10%胰腺癌患者和>10%胆管癌患者血清IgG4水平也可升高;且由于AIP发病率远低于胰腺癌,血清IgG4对诊断AIP的阳性预测值很低,仅有血清IgG4水平升高不足以诊断AIP。
(二)自身抗体阳性
40%~50%的1型AIP患者自身抗体阳性,主要为抗转铁蛋白抗体(ALF)、抗碳酸酐酶Ⅱ抗体(ACA-Ⅱ)。这两种抗体被认为具有一定的器官特异性,前者来源于胰腺腺泡细胞,后者来源于导管上皮,两者诊断AIP的敏感性均超过50%,但目前尚未广泛应用于临床。此外,还可有抗核抗体(ANA)、类风湿因子(RF)阳性,而抗线粒体抗体(AMA)、抗SS-A抗体、抗SS-B抗体、抗平滑肌抗体(ASMA)等阳性率则很低。2型AIP患者自身免疫抗体多为阴性。
(三)肝功能异常
胰腺肿大压迫胆管或伴有IAC时,可出现以直接胆红素为主的血清总胆红素升高,伴不同程度的转氨酶升高。
(四)血清胰腺酶学改变
有报道66%患者血清脂肪酶升高,多为轻度,18.7%患者血淀粉酶一过性升高。
(五)胰腺内、外分泌功能异常
有报道18.6%AIP患者在发病前血糖升高,28.7%在发病时升高;72%患者BT-PABA降低。
(六)其他
部分患者出现血沉增快或CRP、IgE、CA19-9等指标升高,CA19-9甚至可高于1000 U/ml。激素治疗后通常可下降。
八、诊断
AIP无特异性临床表现,需与胰腺癌、CP鉴别,应结合影像学、实验室检查、胰腺外器官受累、病理学和激素疗效做出诊断。2002年,日本胰腺学会首先提出AIP诊断标准,此后韩国、美国等也相继推出诊断标准。2010年,国际胰腺学会整合各国对AIP的诊断意见,发布AIP诊断标准国际共识。诊断标准的变化反映了对AIP认识和研究的演变史,也为AIP的临床诊治提供了更为明确的依据。
AIP诊断标准国际共识中,诊断依据包括影像学(细分为胰腺实质影像学和胰管影像学)、血清学、胰腺外器官受累、组织病理学和诊断性激素治疗等5个方面。这一共识最突出的特点是强调了胰腺实质影像学检查(CT/MRI)在AIP诊断中的首要地位,其次是对各诊断依据进行分级和组合(诊断性激素治疗除外)。该共识中实验室检查指标仅有IgG4一项,与之前部分指南有所区别;评价诊断性激素治疗效果的指标主要依靠影像学,实验室检查指标不再作为监测指标(表2、3)。

表2 国际共识中1型AIP诊断证据分级
注:*:诊断性激素治疗必须在包括EUS-FNA等手段除外胰腺癌的前提下谨慎实施;☆:部分AIP患者表现有低密度占位、胰管扩张或胰腺远端萎缩,梗阻性黄疸和(或)胰腺占位患者有上述不典型表现高度提示胰腺癌,应先按照胰腺癌处理,除非有强烈提示AIP的其他征象并完全排除胰腺癌;★:内镜下十二指肠乳头活检有一定诊断价值,壶腹常在AIP时受累

表3 国际共识中1型AIP的诊断标准
根据AIP诊断标准国际共识,对AIP的诊断应从影像学检查开始。如患者有典型的影像学征象,且有实验室检查或胰腺外受累证据,即可诊断为AIP,可行激素治疗。如影像学不典型,需除外胰腺癌,再结合实验室检查、组织病理学证据做出诊断。如行诊断性激素治疗,必须除外胰腺癌,疗程不长于2周;复查影像学提示胰腺或胰腺外病变明显好转者支持AIP诊断。诊断流程如图9所示。
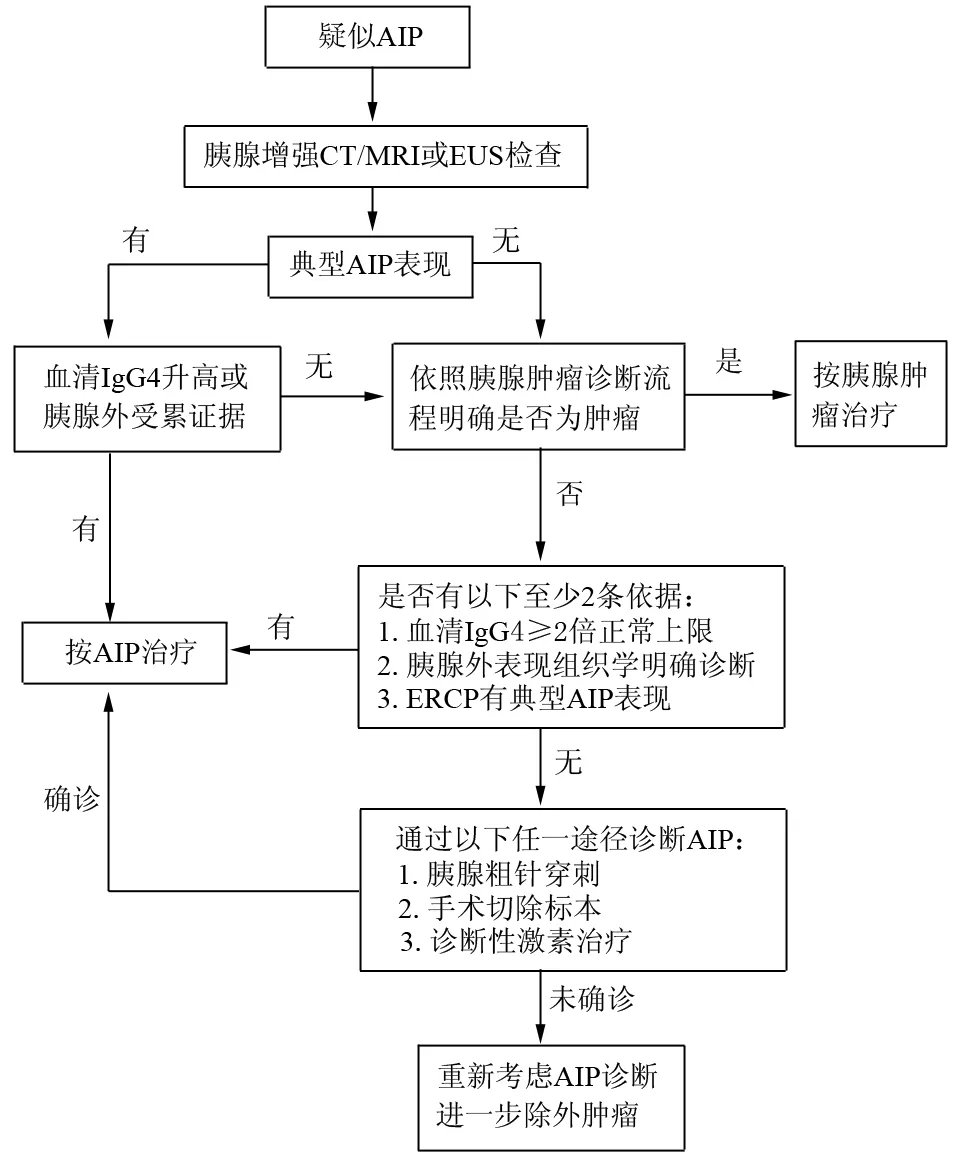
图9 AIP诊断国际共识的诊断流程
九、鉴别诊断
(一)胰腺癌
AIP(尤其是局灶性AIP)与胰腺癌的临床表现相似,均可出现梗阻性黄疸、体重下降、轻度腹部不适等,且AIP发病率远低于胰腺癌,因此临床诊断AIP需首先排除胰腺癌。两者的鉴别需结合影像学、实验室检查、病理学及激素疗效等。AIP可伴有胰腺外表现,如硬化性胆管炎、涎腺炎、泪腺炎等;AIP的CT和MRI典型征象为胰腺边缘光滑、可有包膜样边缘,而胰腺癌一般轮廓不规则,无包膜样边缘;AIP的动态增强CT显示胰腺病变延迟、均匀强化,而胰腺癌动态增强后多表现为不均匀、低强化肿块;AIP的ERCP典型征象为主胰管弥漫性、节段性或局灶性纤细和狭窄,管壁不规则,狭窄段近端胰管无显著扩张,而胰腺癌则表现为主胰管突然截断伴近端胰管扩张;AIP血清IgG4水平的升高较胰腺癌更常见,尤其是IgG4高于正常上限2倍时。影像学表现不典型的患者,应考虑EUS-FNA等方法获取病理学标本进一步鉴别。美国Mayo医学中心提出AIP与胰腺癌的鉴别诊断流程(图10),可作为两种疾病临床鉴别的参考。

图10 美国Mayo医院AIP与胰腺癌鉴别诊断策略
(二)PSC
AIP伴发的IAC影像学表现与PSC相似,但PSC较常见胆管带状、串珠样或截枝样狭窄,而IAC较常见末端胆管狭窄、节段性、长型狭窄合并近段胆管扩张。且IAC患者一般年龄较大,激素治疗效果好。
(三)胆管癌
部分AIP伴发的IAC需与胆管癌鉴别。胆管内超声(intraductal ultrasonography,IDUS)在两者的鉴别中具有重要作用,IAC的典型征象为胆管壁呈均匀、同心圆性增厚,而胆管癌则呈不均匀低回声团块。血清IgG4、自身抗体及肿瘤标记物检测也有助于鉴别。
(四)酒精性慢性胰腺炎(alcohol chronic pancreatitis,ACP)
ACP患者一般年龄较轻,临床症状较重,主胰管明显扩张、胰腺实质萎缩,常伴胰腺钙化、结石、假性囊肿,自身抗体多阴性,血清球蛋白、IgG4多正常。
(五)胰腺炎性假瘤
多发生于胰头部,表现为胰头部局灶性包块,需与局灶性AIP相鉴别。炎性假瘤多见于中年男性,多有典型的胰腺炎症状,自身抗体阴性,CT常可发现假性囊肿或胰周渗出。
十、治疗
AIP的治疗以口服激素为主。如激素疗效不佳,首先需要考虑诊断是否正确,然后可换用或联用免疫调节剂乃至利妥昔单抗。对胰腺内、外分泌功能不全者应给予相应治疗。已经确诊的AIP患者无需常规进行ERCP,对诊断不明确或黄疸较重患者可考虑内镜介入治疗。
(一)口服激素治疗
尽管有少部分AIP患者可自行缓解,但目前仍公认口服糖皮质激素是AIP的首选治疗方法。激素治疗可进一步证实诊断、缓解梗阻性黄疸等症状、改善组织结构异常、在急性期改善胰腺内外分泌功能。一般采取口服泼尼松30~40 mg/d,或按照0.6 mg·kg-1·d-1选择剂量。起始剂量治疗2~4周后,应结合临床症状、影像学和实验室检查进行综合评价,如效果较好可逐渐减量,以每1~2周减少5 mg为宜,再根据临床表现采用5 mg/d剂量维持或停药。小剂量激素维持治疗可减少复发,但不能避免复发,有报道在维持治疗或停药后复发率为17%~24%。美国Mayo医学中心对AIP激素治疗后复发的处理流程见图11。
(二)免疫调节剂和利妥昔单抗
硫唑嘌呤(AZA)、6-巯基嘌呤(6-MP)或霉酚酸酯(MMF)等免疫调节剂可用于激素治疗无效的患者。初步研究表明,利妥昔单抗(RTX)对激素和免疫调节剂抵抗的AIP患者效果良好。
(三)熊去氧胆酸
国内外有研究报道给予熊去氧胆酸治疗AIP患者,并发的糖尿病、肝功能损害明显改善,胰腺体积减小。但其治疗机制尚不明确,且临床应用报道尚少,其价值需进一步研究。

图11 美国Mayo医院对AIP激素治疗后复发的处理原则
(四)内镜介入治疗
已经确诊的AIP患者无需常规进行ERCP。诊断不明确或黄疸较重患者可考虑内镜介入治疗;也有观点认为激素可迅速降低黄疸,无需积极行ERCP干预。对激素治疗风险较大的患者,可首先行内镜介入治疗缓解黄疸。
(五)外科治疗
AIP患者不建议手术治疗,当临床难以排除恶性肿瘤时可考虑手术。
十一、随访与预后
对AIP患者的随访应关注其临床症状和影像学变化以及药物不良反应。长期服用激素和联用免疫调节剂者需监测血常规、血糖和肝功能。
1型AIP复发率较高,约20%~40%的患者初次激素治疗停药后可能复发,复发后仍可给予激素或联用/换用免疫调节剂和单抗类药物。2型AIP少有复发。部分AIP病程可呈自限性,病程反复者可形成结石。虽有进展或合并胰腺癌的个案报道,但AIP与胰腺癌之间的相关性还不明确。建议对病程较长的AIP患者按时随访。
参加本指南修订的专家(按姓氏笔划排序)
王兴鹏(上海第一人民医院消化科)
邓安梅(第二军医大学长海医院实验检验科)
吕农华(南昌大学第一附属医院消化内科)
任 旭(黑龙江省医院消化内科)
李兆申(第二军医大学长海医院消化内科)
李 汛(兰州大学第一医院普外科)
杨爱明(北京协和医院消化内科)
赵东宝(第二军医大学长海医院风湿免疫科)
陆建平(第二军医大学长海医院影像医学科)
邹多武(第二军医大学长海医院消化内科)
金 钢(第二军医大学长海医院普外科)
金震东(第二军医大学长海医院消化内科)
郑建明(第二军医大学长海医院病理科)
郭学刚(第四军医大学西京医院消化内科)
袁耀宗(上海瑞金医院消化内科)
钱家鸣(北京协和医院消化内科)
麻树人(沈阳军区总医院内窥镜科)
屠振兴(中华胰腺病杂志编辑部)
靳大勇(上海市中山医院普外科)
廖 专(第二军医大学长海医院消化内科)
[1] Shimosegawa T, Chari ST, Frulloni L, et al. International consensus diagnostic criteria for autoimmune pancreatitis: guidelines of the International Association of Pancreatology. Pancreas,2011,40:352-358.
[2] Chari ST, Kloeppel G, Zhang L, et al. Histopathologic and clinical subtypes of autoimmune pancreatitis: the Honolulu consensus document. Pancreatology, 2010,10:664-672.
[3] Chari ST. Diagnosis of autoimmune pancreatitis using its five cardinal features: introducing the Mayo Clinic′s HISORt criteria. J Gastroenterol, 2007,42 Suppl 18:39-41.
[4] Kim KP, Kim MH, Kim JC, et al. Diagnostic criteria for autoimmune chronic pancreatitis revisited. World J Gastroenterol, 2006, 12:2487-2496.
[5] Otsuki M, Chung JB, Okazaki K, et al. Asian diagnostic criteria for autoimmune pancreatitis: consensus of the Japan-Korea Symposium on Autoimmune Pancreatitis. J Gastroenterol, 2008,43:403-408.
[6] Sah RP, Chari ST, Pannala R, et al. Differences in clinical profile and relapse rate of type 1 versus type 2 autoimmune pancreatitis. Gastroenterology, 2010,139:140-148.
[7] Kanno A, Nishimori I, Masamune A, et al. Nationwide Epidemiological Survey of Autoimmune Pancreatitis in Japan. Pancreas, 2012,41:835-839.
[8] Kamisawa T, Shimosegawa T, Okazaki K, et al. Standard steroid treatment for autoimmune pancreatitis. Gut,2009,58:1504-1507.
[9] Finkelberg DL, Sahani D, Deshpande V, et al. Autoimmune pancreatitis. N Engl J Med, 2006, 355: 2670-2676.
[10] Seleznik GM, Reding T, Romrig F, et al. Lymphotoxin β receptor signaling promotes development of autoimmune pancreatitis. Gastroenterology, 2012, 143:1361-1374.
[11] Manfredi R, Frulloni L, Mantovani W, et al.Autoimmune pancreatitis: pancreatic and extrapancreatic MR imaging-MR cholangiopancreatography findings at diagnosis, after steroid therapy, and at recurrence. Radiology, 2011, 260: 428-436.
[12] Sahani DV, Sainani NI, Deshpande V, et al. Autoimmune pancreatitis: disease evolution, staging, response assessment, and CT features that predict response to corticosteroid therapy. Radiology, 2009, 250:118-129.
[13] 辛磊,彭国林,廖专,等.中国自身免疫性胰腺炎临床特征分析:单中心81例总结.中华胰腺病学杂志,2012,12:294-298.
[14] Song Y, Liu QD, Zhou NX, et al. Diagnosis and management of autoimmune pancreatitis: experience from China. World J Gastroenterol, 2008,14:601-606.
[15] 丁辉, 钱家鸣, 吕红, 等. 自身免疫性胰腺炎激素治疗的疗效及预后研究. 中华消化杂志, 2010, 30:721-724.
[16] Zhang X, Zhang X, Li W, et al. Clinical analysis of 36 cases of autoimmune pancreatitis in china. PLoS One, 2012,7:e44808.
[17] 吴晰, 杨爱明, 钱家鸣, 等. 自身免疫性胰腺炎的内镜超声表现. 中华消化内镜杂志, 2008,25:134-137.
10.3760/cma.j.issn.1674-1935.2012.06.017
李兆申,上海第二军医大学长海医院消化内科,200433
Email:zhsli81890.net
2012-10-28)
(本文编辑:吕芳萍)

