自身免疫性胰腺炎胰管病变的MRCP特征
张斌斌,靳二虎
(1.首都医科大学附属北京中医医院放射科,北京 100010;2.首都医科大学附属北京友谊医院放射科,北京 100050)
自身免疫性胰腺炎胰管病变的MRCP特征
张斌斌1,靳二虎2*
(1.首都医科大学附属北京中医医院放射科,北京 100010;2.首都医科大学附属北京友谊医院放射科,北京 100050)
目的 探讨自身免疫性胰腺炎(AIP)胰管病变的MRCP特征。方法 回顾性分析15例AIP患者的临床及MRCP影像资料,对其胰管病变进行定性及定量分析。结果 MRCP上15例AIP患者的胰管均见狭窄(15/15,100%),表现为局部胰管不可见。9例(9/15,60.00%)同时累及腹胰管和背胰管,仅腹胰管或背胰管受累各3例(3/15,20.00%)。11例(11/15,73.33%)胰管呈单发节段性狭窄,狭窄长度2.07~4.69 cm(中位数3.24 cm),上游胰管管径0.14~0.31 cm(中位数0.19 cm);4例(4/15,26.67%)胰管呈多发节段性狭窄,狭窄长度0.19~3.45 cm(中位数0.82 cm),狭窄段间及上游胰管管径0.14~0.70 cm(中位数0.21 cm)。轴位T1WI、T2WI上,13例(13/15,86.67%)胰腺弥漫性肿大,病变胰腺T1WI呈等、低信号,T2WI稍高信号为主混杂信号;2例(2/15,13.33%)胰腺局限性肿大/肿块,其胰管狭窄部位与胰腺实质病变范围一致。1例(1/15,6.67%)胰尾周围见假性囊肿。结论 AIP胰管病变的MRCP表现可分为单节段狭窄型和多节段狭窄型,大多数的非狭窄段胰管不扩张,但胰管扩张不能排除AIP。
自身免疫性胰腺炎;胰管;磁共振胰胆管造影术
自身免疫性胰腺炎(autoimmune pancreatitis, AIP)是由自身免疫异常引发的胰腺慢性炎症,其影像异常主要包括两部分,即胰腺实质异常及胰管病变[1]。众所周知,胰管影像学特征在慢性胰腺炎和胰腺癌的鉴别诊断中具有重要作用。AIP患者的胰管改变有无特征是消化内科和放射科医师迫切需要了解的。检索国内外文献发现,目前描述AIP胰腺实质异常的文章较多[2-4],而对其胰管病变影像表现的研究很少[5]。本研究回顾性分析一组AIP患者的临床和影像资料,探讨AIP胰管病变的MRCP表现。
1 资料与方法
1.1一般资料 收集2008年1月—2014年12月在首都医科大学附属北京友谊医院诊断为AIP的21例患者,临床表现包括黄疸(n=12)、腹痛(n=7)、新发或加重的糖尿病(n=6)、体质量下降(n=5)、腹胀(n=4)、腹泻(n=1),1例因术前诊断为胰腺癌而行手术切除。纳入标准:(1)符合2008年韩国与日本提出的AIP亚洲诊断标准[6],本组主要为以下3个方面:①影像学异常,胰腺实质弥漫/局限性肿大(块),以及胰管弥漫/局灶性狭窄;②血清学检测:IgG或IgG4水平升高;③切除胰腺病理提示淋巴浆细胞性硬化性胰腺炎;AIP诊断符合①+②或③。(2)于首都医科大学附属北京友谊医院行MR检查,MRI和MRCP资料完整。排除标准:①在MRCP检查前,已经使用类固醇治疗或胆总管支架置入术后的患者;②MRCP图像模糊,不能精确测量数据。最终,本研究共纳入AIP患者15例,男性13例,女性2例,年龄43~82岁,平均(58.6±12.1)岁。
1.2仪器与方法 采用GE Signa Excite HD 3.0T MR扫描设备,8通道相控阵体部表面线圈。MRCP扫描应用屏气二维采集技术,单次激发快速自旋回波(single shot fast spin echo, SSFSE)重T2加权成像序列。扫描参数:TR 10 000 ms,TE 600 ms/Ef,层厚50 mm,矩阵352×320,FOV 350 mm×350 mm。MRCP以体轴为中心,间隔5°重建并最终形成12幅影像。
在MRCP扫描前行脂肪抑制快速扰相梯度回波(fast spoiled gradient recalled echo, FSPGR)T1WI及脂肪抑制快速自旋回波(fast spin echo FSE)T2WI扫描,扫描范围自肝顶至双肾下极水平。扫描参数:T1WI,TR 200 ms,TE 2.7 ms;T2WI,TR 6 000 ms,TE 106.5 ms;层厚7 mm,层间距1.5 mm,矩阵288×224,FOV 380 mm×285 mm。
1.3影像分析 由2名高年资放射科医师采用盲法对本组病例的影像资料进行独立测量及分析,有分歧时通过讨论达成一致意见。
1.3.1MRCP 定性分析:①胰管是否狭窄(狭窄定义为上游胰管显示,下游胰管管径较小或不可见)及狭窄表现;②胰管狭窄数目(单发、多发)及狭窄部位(本研究按照胰管胚胎发育形成过程,将胰管解剖分为腹胰管、背胰管两部分);③狭窄段间胰管及上游胰管是否扩张(>3 mm);④分支胰管显示情况;⑤是否出现胰腺假性囊肿;⑥胆管是否狭窄(狭窄定义为局部胆管管腔变细或不可见,其上游胆管相对扩张)及狭窄表现;⑦胆管狭窄部位。定量分析:①胰管狭窄数目;②胰管狭窄长度;③上游及狭窄段间胰管直径。
1.3.2轴位T1WI、T2WI图像 ①胰腺肿大类型(弥漫性、局限性)及肿大部位(胰头、胰体、胰尾);②受累胰腺T1WI、T2WI信号改变(与同层面肝实质相比);③是否存在胰周低信号环;④是否出现胰腺假性囊肿。
2 结果
2.1MRCP表现 15例患者(15/15,100%)均见胰管狭窄,表现为节段性管腔不可见。其中11例(11/15,73.33%)胰管单发节段性狭窄,4例(4/15,26.67%)胰管多发节段性狭窄。9例(9/15,60.00%)腹胰管和背胰管同时受累,3例(3/15,20.00%)仅累及腹胰管,3例(3/15,20.00%)仅累及背胰管。1例单发胰管狭窄位于背胰管末端,无上游胰管扩张情况,其余14例患者中,12例(12/14,85.71%)狭窄段间胰管及上游胰管无扩张(图1),1例(1/14,7.14%)狭窄段间胰管扩张(图2),1例(1/14,7.14%)狭窄段上游的胰管扩张(图3)。15例(15/15,100%)分支胰管均未显示。1例(1/15,6.67%)背胰管末端见假性囊肿形成。13例(13/15,86.67%)胆管狭窄,其中12例(12/13,92.31%)表现为胰腺段胆管变细、局部不可见,其近侧肝内、外胆管明显扩张;1例(1/13,7.69%)表现为肝门区胆管及肝外胆管变细、局部不可见,近侧肝内胆管扩张。2例(2/15,13.33%)未见胆管狭窄及扩张表现。
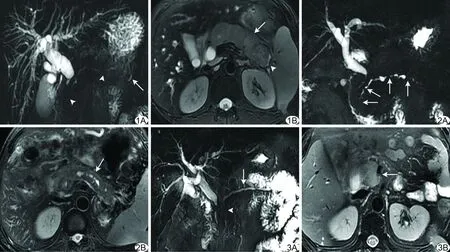
图1 患者男,57岁 A.冠状面MRCP显示胰管多发节段性狭窄,病变呈跳跃分布,腹胰管和背胰管均受累(箭头),狭窄段间及上游胰管无扩张,背胰管末端见少许液体高信号(箭);胰腺段胆管狭窄,近侧肝内外胆管明显扩张; B.轴面脂肪抑制T2WI显示胰腺弥漫性肿大,呈不均匀稍高信号(箭),胰尾周围见一个小假性囊肿(箭头) 图2 患者男,54岁 A.MRCP显示胰管多发跳跃性狭窄(箭),狭窄段之间的胰管扩张,似串珠状改变,胰腺段胆管狭窄,近侧肝内外胆管扩张; B.轴位脂肪抑制T2WI显示胰腺弥漫性肿大,胰管节段性狭窄及扩张交替(箭) 图3 患者男,61岁 A.MRCP显示腹胰管单发狭窄(箭头),上游的背胰管轻度扩张(箭);胆总管下段狭窄,其近侧胆管扩张; B.轴位脂肪抑制T2WI显示胰头局限性肿大,病变胰腺呈稍高信号(箭)
测量11例单发节段性胰管狭窄,其中1例由于狭窄部位在背胰管末端而无法测量,其余10例胰管狭窄长度2.07~4.69 cm,中位数3.24 cm;上游胰管管径0.14~0.31 cm,中位数0.19 cm。4例多发节段性胰管狭窄的狭窄段数目分别为8段、2段、3段及4段,单个狭窄段的长度0.19~3.45 cm,中位数0.82 cm;1例狭窄段间3处胰管扩张,管径分别为0.70、0.33、0.55 cm,其余3例狭窄段间及上游胰管无扩张,管径0.14~0.25 cm,中位数0.21 cm。
2.2T1WI、T2WI表现 13例患者(13/15,86.67%)胰腺弥漫性肿大,1例(1/15,6.67%)胰头局限性肿大,1例(1/15,6.67%)胰体见局限性肿块。与同层面肝实质相比,受累胰腺在轴面T1WI呈等信号7例、低信号7例、高信号1例,T2WI呈等信号4例、高信号10例、低信号1例。4例(4/15,26.67%)见胰周低信号环。1例(1/15,6.67%)胰尾周围见小的假性囊肿。
3 讨论
3.1临床病理特征 AIP是一种少见的特殊类型的慢性胰腺炎,与自身免疫异常有关,占慢性胰腺炎的4.6%~6.0%。AIP以男性多见,研究[1]报道其平均发病年龄为55~78岁,本组患者平均年龄为(58.6±12.1)岁。临床上AIP主要表现为无痛性梗阻性黄疸、腹痛、体质量下降、新发或加重的糖尿病等,本病常与胰腺癌(pancreatic cancer, PC)混淆而行不必要的手术切除治疗[7]。
AIP的病理表现主要包括大量淋巴浆细胞浸润、席纹状纤维化以及闭塞性静脉炎,其纤维炎性病变累及胰管、胰腺小叶及静脉,导致胰腺弥漫性或局限性肿大以及胰管狭窄[8]。AIP胰头病变常伴胰腺段胆管受累,造成低位胆管狭窄,其原因是纤维炎性病变浸润和/或胰腺实质肿大压迫[9]。
3.2胰管MRCP特征及鉴别诊断 主胰管在胚胎早期由腹胰管和背胰管融合而成,腹胰管位于胰头后下部及钩突,背胰管位于胰头前上部、胰体及胰尾[10]。本研究按照胰管胚胎发育形成过程,将胰管分为腹胰管、背胰管两部分;本组60%患者腹胰管和背胰管同时受累,仅腹胰管或背胰管受累各占20%。本组AIP胰管狭窄的MRCP有两种表现形式:①单节段狭窄型,狭窄段较长;②多节段狭窄型,多发病变可广泛累及整个胰管,但每个狭窄段的长度相对较短,狭窄呈跳跃性分布。大多数患者狭窄段间胰管及上游胰管无扩张,少数患者狭窄段上游的胰管轻度扩张。如果狭窄段间胰管显著扩张,因胰管狭窄段与扩张段交替分布,胰管可呈串珠状改变。
AIP常伴胆管受累,称为IgG4相关硬化性胆管炎,表现为胆管壁均匀增厚伴延迟强化,管腔狭窄[9]。本组86.67%患者MRCP可见胆管狭窄,多表现为胰腺段胆管变细、局部不可见,近侧的肝内、外胆管明显扩张。
内镜超声下,胰管不规则狭窄伴管壁增厚对诊断AIP有较高价值[11],由于MRCP空间分辨率不足以显示胰管增厚,轴位T1WI、T2WI上亦不能精确测量未强化的胆管壁增厚,因此本研究并未对二者的管壁厚度进行测量。
AIP胰管的MRCP特征可与PC鉴别:①在胰管狭窄数目方面,多发狭窄可作为二者的鉴别点之一。Park等[12]对一组AIP与PC患者的MRCP对比研究发现,71.1%的AIP患者胰管多发狭窄,而PC组胰管均为单发狭窄。不仅是弥漫性AIP,局限性AIP亦可表现为胰管多发狭窄[5]。②在胰管狭窄长度方面,研究[12]报道MRCP并不能鉴别AIP与PC的胰管不规则狭窄。③在上游胰管扩张方面,AIP狭窄段上游胰管多表现为无扩张或轻度扩张。有研究[4]显示,上游胰管管径截断值为5 mm时,鉴别局限性AIP与PC的敏感性为100%,特异性为73%。Sun等[13]对一组局限性AIP与PC对比研究发现,仅5%的局限性AIP上游胰管扩张≥5 mm,而PC组比例高达86%。
3.3胰腺实质病变表现 本组86.67%的AIP患者表现为胰腺弥漫性肿大,病变胰腺T1WI呈等、低信号,T2WI混杂稍高信号为主,MRCP上胰管多表现为单发狭窄,但亦可为多发跳跃性病变;13.33%患者胰腺局限性肿大/肿块,MRCP显示胰管均为单发狭窄,狭窄部位与胰腺实质病变范围一致。本组26.67%患者见胰周低信号环,其病理改变为纤维炎性病变浸润胰腺周围组织[14],此征象有助于诊断AIP。
AIP合并胰腺假性囊肿罕见,可能与AIP少有严重的组织坏死以及胰液缺乏有关。假性囊肿的形成有以下3种原因:①急性胰腺炎胰液渗出及组织坏死后形成包裹,又称包裹性坏死;②胰腺急性到慢性炎症的转变过程所致;③慢性胰腺炎胰管狭窄[15]。本例胰腺假性囊肿位于胰腺实质外,邻近胰尾,可能是②或者③原因所致,与胰腺的慢性炎症有关。
总之,AIP胰管病变的MRCP可表现为以下两型:①单节段狭窄型,其上游胰管多无扩张,少数轻度扩张;②多节段狭窄型,病变呈跳跃性分布,非狭窄段胰管多无扩张,少数轻度扩张。偶见狭窄段间胰管明显扩张,形成串珠状胰管改变。当AIP与PC的胰腺实质病变表现鉴别困难时,MRCP上胰管的影像特征可为明确诊断提供重要信息。
[1] Proctor RD, Rofe CJ, Bryant T, et al. Autoimmune pancreatitis: An illustrated guide to diagnosis. Clin Radiol, 2013,68(4):422-432.
[2] 史瑞华,司丽芳,李敏,等.MSCT双期增强扫描诊断局灶性自身免疫性胰腺炎.中国医学影像技术,2016,32(5):749-752.
[3] 张斌斌,靳二虎,陈光勇,等.自身免疫性胰腺炎MRI表现及随访分析.国际医学放射学杂志,2016,39(2):111-115.
[4] Muhi A, Ichikawa T, Motosugi U, et al. Mass-forming autoimmune pancreatitis and pancreatic carcinoma: Differential diagnosis on the basis of computed tomography and magnetic resonance cholangiopancreatography, and diffusion-weighted imaging findings. J Magn Reson Imaging, 2012,35(4):827-836.
[5] Negrelli R, Manfredi R, Pedrinolla B, et al. Pancreatic duct abnormalities in focal autoimmune pancreatitis: MR/MRCP imaging findings. Eur Radiol, 2015,25(2):359-367.
[6] Otsuki M, Chung JB, Okazaki K, et al. Asian diagnostic criteria for autoimmune pancreatitis: Consensus of the Japan-Korea symposium on autoimmune pancreatitis. J Gastroenterol, 2008,43(6):403-408.
[7] Meng Q, Xin L, Liu W, et al. Diagnosis and treatment of autoimmune in China: A systematic review. PLoS One, 2015,10(6):e0130466.
[8] Chari ST, Kloeppel G, Zhang L, et al. Histopathologic and clinical subtypes of autoimmune pancreatitis: The Honolulu consensus document. Pancreas, 2010,39(5):549-554.
[9] 张斌斌,张洁,靳二虎,等.IgG4相关硬化性胆管炎的CT和磁共振胰胆管成像表现.中国介入影像与治疗学,2015,12(6):336-340.
[10] 靳二虎,张辉.人体磁共振成像解剖变异.北京:人民军医出版社,2011:156-164.
[11] Palazzo M, Palazzo L, Aubert A, et al. Irregular narrowing of the main pancreatic duct in association with a wall thickening is a key sign at endoscopic ultrasonography for the diagnosis of autoimmune pancreatitis. Pancreas, 2015,44(2):211-215.
[12] Park SH, Kim MH, Kim SY, et al. Magnetic resonance cholangiopancreatography for the diagnostic evaluation of autoimmune pancreatitis. Pancreas, 2010,39(8):1191-1198.
[13] Sun GF, Zuo CJ, Shao CW, et al. Focal autimmune pancreatitis: Radiological characteristics help to distinguish from pancreatic cancer. World J Gastroenterol, 2013,19(23):3634-3641.
[14] Manfredi R, Frulloni L, Mantovani W, et al. Autoimmune pancreatitis:Pancreatic and extrapancreatic MR imaging—MR cholangiopancreatography findings at diagnosis, after steroid therapy, and at recurrence. Radiology, 2011,260(2):428-436.
[15] Gompertz M, Morales C, Aldana H, et al. Cystic lesions in autoimmune pancreatitis. Case Rep Gastroenterol, 2015,9(3):366-374.
MRCP features of pancreatic duct lesions in autoimmune pancreatitis
ZHANGBinbin1,JINErhu2*
(1.DepartmentofRadiology,BeijingTraditionalChineseMedicineHospital,CapitalMedicalUniversity,Beijing100010,China; 2.DepartmentofRadiology,BeijingFriendshipHospital,CapitalMedicalUniversity,Beijing100050,China)
Objective To investigate the MRCP features of pancreatic duct lesions in autoimmune pancreatitis (AIP). Methods Clinical and MRCP data of 15 patients with AIP were retrospectively analyzed, and the pancreatic duct lesions were qualitatively and quantitatively analyzed. Results The pancreatic duct stenosis was found in 15 patients (15/15,100%), which was not visible in local pancreatic duct. Both ventral pancreatic duct and dorsal pancreatic duct were involved in 9 cases (9/15, 60.00%), only ventral pancreatic duct or dorsal pancreatic duct were involved in 3 cases (3/15, 20.00%). 11 cases (11/15, 73.33%) showed single segmental stenosis of pancreatic duct, the stenotic length was 2.07—4.69 cm (median 3.24 cm), its upstream pancreatic duct diameter was 0.14—0.31 cm (median 0.19 cm); 4 cases (4/15, 26.67%) showed multiple segmental stenosis, the stenotic length was 0.19—3.45 cm (median 0.82 cm), its upstream pancreatic duct diameter was 0.14—0.70 cm (median 0.21 cm). In axial T1WI and T2WI, pancreatic parenchyma showed diffuse enlargement in 13 cases (13/15, 86.67%), appeared as hypo-intense on T1WI, mixed hyper-intense on T2WI; focal enlargement (block) of the pancreas in 2 cases (2/15, 13.33%), pancreatic parenchymal lesions and pancreatic duct stenosis were in the same range. Pseudocyst around the pancreatic tail was seen in 1 case (1/15, 6.67%). Conclusion MRCP features of pancreatic duct disorders in AIP can be divided into single segment stenosis type and multiple segment stenosis type, and non-stenotic segments are not dilated often, but dilatation of pancreatic duct can not rule out AIP.
Autoimmune pancreatitis; Pancreatic duct; Magnetic resonance cholangiopancreatography
张斌斌(1982—),女,北京人,硕士,主治医师。研究方向 :腹部疾病MRI诊断。E-mail: 434797628@qq.com
靳二虎,首都医科大学附属北京友谊医院放射科,100050。E-mail: erhujin@263.net
2016-08-31
2016-12-25
腹部影像学
10.13929/j.1003-3289.201608151
R445.2; R657.51
A
1003-3289(2017)02-0232-05

