小型猪不同程度阻塞性慢性胰腺炎模型建立及其CT表现
汪建华 张建 孙高峰 李晓栋 茅娟莉 潘桂霞 彭烨 郑建明 左长京
·短篇论著·
小型猪不同程度阻塞性慢性胰腺炎模型建立及其CT表现
汪建华 张建 孙高峰 李晓栋 茅娟莉 潘桂霞 彭烨 郑建明 左长京
近年来慢性胰腺炎(CP)发病率呈逐渐上升趋势[1-2]。CP病程迁延,晚期大多数预后不佳,甚至癌变[3-4]。CT是诊断CP最常用的方法之一,但CT表现与CP病理的分级是否具有相关性尚缺乏严格的病理对照实验研究。本研究探讨不同程度CP的CT表现、动态增强模式及其与病理分级的相关性。
一、材料与方法
1.动物分组及模型建立:雌性巴马小型猪36头,月龄6~10个月,体重12.5~20 kg,由第二军医大学实验动物中心提供,使用许可证SYXK(沪)2007-0003,生产许可证SCXK(沪)2005-0002。适应性饲养1周后禁食24 h,禁水4 h。按随机数字表法分成CP组(24头)和对照组(12头)。先肌内注射盐酸氯胺酮注射液0.1 ml/kg体重,后静脉输入枸橼酸芬太尼注射液(0.1 ml/kg体重)及盐酸氯胺酮注射液(0.1 ml/kg体重)进行麻醉,约隔20 min再静脉注射2 ml 3%戊巴比妥溶液维持麻醉。
常规备皮、消毒、铺巾后沿剑突下正中开腹,将胃向上翻起暴露十二指肠,在十二指肠左缘找到胰腺头颈部,游离出主胰管,用3.0丝线把主胰管与双股3.0聚丙烯线一起结扎(待聚丙烯线溶解后即为超过75%的主胰管部分被结扎),同时结扎胰腺组织。对照组开腹仅翻动胰腺及肠道,然后关腹。切口无菌包扎后用腹带固定,术后按小型猪需求给水和食物。造模后4、8、12周分别选取1/3头猪行影像检查,同时取血、尿和胰腺透析液。处死动物后取胰腺组织。
2.病理学检查:胰腺组织常规行大体和组织病理学检查。按照胰腺腺泡萎缩、炎细胞浸润和纤维化程度(主要根据胰腺纤维化的程度)将CP分为三期:Ⅰ期(轻型CP)表现为轻微纤维化,即纤维化分布以小叶周围为主,可见较多淋巴细胞、浆细胞和少量巨噬细胞的浸润;Ⅱ期(中度CP)表现为中度纤维化,纤维化扩展到小叶内、腺泡之间,间质内可见较多淋巴细胞、浆细胞浸润;Ⅲ期(重度CP)为重度纤维化和极重度纤维化,小叶内的纤维化相互融合,形成较大面积的或者广泛的纤维化,致使胰腺的外分泌实质几乎完全被破坏,间质内仍可见淋巴细胞、浆细胞浸润,但浸润的细胞数量较Ⅱ期减少。此外,行VG染色以进一步确定胰腺组织纤维化程度。
3.影像学检查:检查前静脉注射2 ml盐酸氯胺酮注射液麻醉,1 ml地塞米松注射液(规格1 ml:5 mg)以预防对比剂过敏,肌内注射2 ml硫酸阿托品注射液以抑制气道分泌物及肠蠕动。
采用Sensation Cardiac 64层螺旋CT机(西门子公司,德国)扫描。参数:120 kV,110 mA,层厚2 mm,对比剂为Ultravist (300 mg I/ml,先灵公司),剂量1.5 ml/kg体重,注射速率2 ml/s。扫描方案:先行平扫,确定胰腺部位后行动态增强扫描,扫描从注射对比剂后5 s开始,扫描间隔时间为5 s,持续至70 s。所得系列横断面图像上测量胰腺实质CT值,并绘制时间-密度曲线。
由2位有经验的影像科医师盲法共同阅片,观察胰腺形态、密度及胰管改变。取胰腺头、体、尾部3个点测CT值,取均值。测量时尽量选取同一层面,且避开血管和伪影。
根据病理组织学检查结果,将小型猪分为正常组及CP Ⅰ期、Ⅱ期、Ⅲ期组,分析CP病理分期与主胰管梗阻时间的相关性。在CT图像上比较各组间胰腺形态、密度和胰管扩张的差异,比较各期CT动态强化特点。
二、结果
1.小型猪慢性胰腺炎模型的建立:对照组12头均存活,胰腺组织均未见异常。实验组24头小型猪中存活21头,意外死亡3头。1头因麻醉状态下黏液痰阻塞气管窒息死亡;1头因胰管损伤、胰液外漏伴腹腔感染在术后2周死亡;1头因腹腔、肺部感染及大量心包积液在术后第5周死亡。实验组中19头成功建立不同程度CP模型,2头病理改变不明显,制模成功率79.2%(19/24)。主胰管结扎4周时,0期(正常)2头,Ⅰ期4头;8周时Ⅰ期1头,Ⅱ期2头,Ⅲ期2头;12周时Ⅰ期1头,Ⅱ期2头,Ⅲ期5头。总的病理分期为正常(0期)2头(9.5%)、Ⅰ期8头(38.1%)、Ⅱ期4头(19%)、Ⅲ期7头(33.4%),CP病理严重程度与主胰管不全梗阻周数呈正相关(r=0.714,P<0.05)。
2.胰腺组织病理学改变:Ⅰ期CP共8头,其中6头小型猪胰腺萎缩不明显,但质地变硬,色泽变暗,仅2头胰腺略肿胀;胰管均未见扩张。Ⅱ期和Ⅲ期CP的胰腺组织呈灰红色,表面粗颗粒状或结节状、质地明显变硬,以胰体、尾部为明显;主胰管不同程度扩张,扩张明显者沿主胰管长轴剖开,见主胰管管壁僵硬,主胰管壁上可见扩张分支胰管的开口。
Ⅰ期胰腺镜下见分叶状结构轻度破坏,腺泡轻度萎缩,间质纤维组织轻度增生,间质内散在淋巴细胞、浆细胞浸润(图1a);Ⅱ期胰腺分叶状结构破坏,腺泡明显萎缩,纤维组织明显增生,并向小叶内伸展(图1b);Ⅲ期胰腺腺泡显著萎缩,间质纤维组织大量增生,并可见较多淋巴细胞、浆细胞浸润(图1c)。

上图HE染色(×100);下图VG染色(×100)
3.CT表现:对照组及实验组0期共14头猪的胰腺形态未见萎缩,密度均匀,强化均匀一致,主胰管及分支胰管均未显示(图2a)。Ⅰ期8头中6头胰腺形态未见明显改变,边缘光整,胰腺实质强化均匀一致(图2b),2头胰腺轻度肿大且平扫密度较低;5头猪主胰管未明确显示,3头主胰管轻度扩张,但分支胰管未显示。Ⅱ期4头中3头胰腺萎缩,边缘毛糙、欠光整;增强后胰腺实质强化欠均匀,内可见散在细点状、小斑片状低密度影;主胰管不同程度扩张(图2c),1头同时见分支胰管轻度扩张。Ⅲ期7头的胰腺萎缩均较明显,边缘欠光整,呈细锯齿状,其中5头胰腺实质及包膜下出现羽毛状低密度影(图2d),增强后强化程度较周围胰腺实质低;7头主胰管均见不同程度扩张,其中1头胰管明显扩张,直径达11 mm,胰腺实质菲薄(图2e),分支胰管均有不同程度扩张。各期胰腺实质均未见钙化,胰管内未见高密度结石形成。
动态增强扫描的胰腺实质时间-密度曲线显示各期CP的CT值变化趋势与正常胰腺总体相近,但在30 s和35 s两个时间点,正常组及CPⅠ期、Ⅱ期、Ⅲ期各组间强化CT值差别有统计学意义(F=4.517,P=0.017;F=17.961,P<0.001)。
讨论许多学者对CP模型的建立进行了大量的研究[5-7],建模方法包括饮食诱导法、蛙皮素注射法、二丁基二氯化物(DBTC)注射法、胰管注射法、胰胆管结扎法和动脉结扎法等。不同的模型动物及建模方法各有优势,但以DBTC尾静脉注射法建立SD大鼠CP模型应用较多[8-11]。该模型缺点在于大鼠的胰腺解剖结构与人类差别大,难以耐受多次采血等复杂实验操作,且静脉给予DBTC对全身其他脏器亦有损伤作用,因此对于影像诊断和药物治疗效果评价有一定限制。
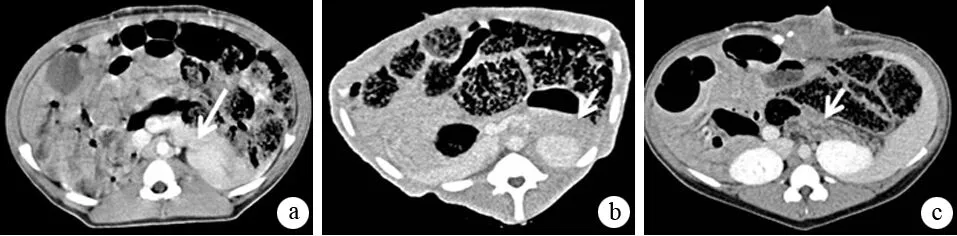
图2正常胰腺(a)及Ⅰ(b)、Ⅱ(c)、Ⅲ(d、e)期CP的CT征象
1999年Reber等[7]报道通过结扎小型猪主胰管建立CP模型,此后得到了许多学者的证实,制模成功率在70%左右[5-6]。本研究的制模成功率高于文献报道,可能与以下因素有关:(1)CP建模手术在胰腺外科专家帮助和指导下完成,在主胰管不全结扎处同时结扎胰腺组织,既保证主胰管不全结扎,又避免副胰管或侧支胰管引流胰液,减少胰瘘发生;(2)腹部切口无菌包扎并用腹带固定,减少感染等并发症;(3)术后十分注意保暖、温热食物喂养等护理措施,提高了动物存活率。主胰管不完全结扎法诱发的梗阻性CP的纤维化程度与梗阻时间呈一定的相关性,能够复制出不同病理分期的CP,可重复性好[5-6]。本研究结果表明,CP严重程度与胰管结扎后的周数呈正相关性,与文献报道一致。
CT是常用的CP影像诊断技术,它可显示胰腺萎缩或胰实质增大,胰腺钙化,主胰管扩张,管壁不规则或串珠样改变,但对于分支胰管和胰实质早期改变的显示仍有一定困难。因此,大多数学者认为CT对于中晚期CP诊断价值较高。本研究结果显示,Ⅰ期CP的胰腺CT图像改变大多不明显,这与此期病理改变轻微、间质纤维化尚不明显有关。少数Ⅰ期CP胰腺轻度肿大且平扫密度较低,可能是胰腺水肿和早期的炎症反应的表现。Ⅱ期CP的胰腺CT图像多表现为萎缩,边缘毛糙、欠光整,主胰管不同程度扩张,少数可见分支胰管扩张。病理基础是胰腺小叶状结构中度破坏,腺泡萎缩、纤维组织中等程度增生,牵拉胰腺包膜及胰管致胰腺边缘毛糙,胰管轻中度扩张。胰腺实质密度不均匀,内可见散在细点状、小斑片状低密度影,大多数为脂肪浸润,少数为扩张的分支导管和腺泡。Ⅲ期CP的胰腺CT图像显示胰腺萎缩明显,边缘呈细锯齿状,主胰管及分支胰管见不同程度扩张。病理基础是胰腺小叶状结构严重破坏,胰腺腺泡明显萎缩、结缔组织增生及纤维化,牵拉胰腺包膜及胰管致胰腺边缘不整,胰管不规则扩张改变。胰腺实质及包膜下出现羽毛状低密度影,此为脂肪组织不均匀沉积所致。
动态增强表明,Ⅰ、Ⅱ、Ⅲ期CP各组间增强CT值在30 s和35 s两个时间点上差别明显,表明长期反复炎症和纤维化导致胰腺微血管密度降低。随着CP严重程度加重,胰腺实质强化峰值逐渐降低,低于正常胰腺,且达峰时间延迟。其病理基础是胰腺内毛细血管数量、血流灌注逐渐减少以及胰腺间质内压力逐渐增加所致[12]。因此,CT动态增强对判断CP严重程度有一定价值。
临床上,胰腺钙化为胰腺组织炎性损伤的最后结局,较多见于酒精性或家族性胰腺炎。胰腺钙化的发生机制尚未完全清楚,可能与高血钙有关[13]。本研究各期CP的CT图未见胰腺实质钙化,胰管内也未见高密度结石形成,这可能与本实验CP是梗阻性CP,血钙不高,在相对较短的实验期间难以形成钙化有关。
总之,巴马小型猪主胰管不全结扎法建立CP模型成功率高,CP的纤维化程度与梗阻时间呈显著的相关性,发病机制接近人类慢性梗阻性胰腺炎的形成过程。CT图像上,轻度CP与正常胰腺难以鉴别,中重度CP的CT表现有一定特征。动态增强有助于CP严重程度的判断。该模型CT表现与人类CP十分相似,可为CP的影像学研究提供良好的平台。
[1] 王兴鹏,徐肇敏,许国铭. 慢性胰腺炎诊治指南.中华消化杂志, 2005,25:319-320.
[2] Wang LW, Li ZS, Li SD, et al. Prevalence and clinical features of chronic pancreatitis in China:a retrospective multicenter analysis over 10 years.Pancreas, 2009, 38:248-254.
[3] Banks PA.Classification and diagnosis of chronic pancreatitis.J Gastroenterol, 2007,42:148-151.
[4] Dítě P, NovotnI, Precechtělová M, et al. Incidence of pancreatic carcinoma in persons with chronic pancreatitis. Vnitr Lek, 2009, 55:18-21.
[5] Boerma D,Straatsburg IH,Offerhaus GJ, et al. Experimental model of obstructive chronic pancreatitis in pigs. Dig Surg, 2003, 20:520-523.
[6] 舒健,赵建农,张小明.小型猪慢性胰腺炎模型的建立.中国实验动物学报,2008,16:135-137.
[7] Reber PU, Petel AG, Toyama MT, et al. Feline model of chronic obstructive pancreatitis:effects of acute pancreatic duct decompression on blood flow and interstitial pH. Scand J Gastroenterol, 1999,34:439-445.
[8] Fang F,He X,Deng H,et al.Discrimination of metabolic profiles of pancreatic cancer from chronic pancreatitis by high-resolution magic angle spinning 1H nuclear magnetic resonance and principal components analysis.Cancer Sci,2007, 98:1678-1682.
[9] Merkord J, Weber H, Jonas L, el al.The influence of ethanol On long-term effects of dibutyltin dichloride(DBTC) in pancreas and liver of rats. Hum Exp Toxicol, 1998, 17:144-150.
[10] Sparmann G, Behrend S, Merkord J, et al. Cytokine mRNA levels and lymphocyte infiltration in pancreatic tissue during experimental chronic pancreatitis induced by dibutyhin dichloride. Dig Dis Sci, 2001, 46:1647-1656.
[11] 何新红, 陆建平, 廖专, 等.二丁基二氯化物尾静脉注射建立大鼠慢性胰腺炎模型. 胰腺病学, 2007, 7: 17-20.
[12] 郝强,田建明,左长京,等.CT灌注成像在胰腺癌诊断中的应用.第二军医大学学报,2005,26:732-735.
[13] 孙钢,宁晓红,钱家鸣. 慢性胰腺炎321例致病因素分析. 中国医刊, 2002,37:30-32.
10.3760/cma.j.issn.1674-1935.2012.06.013
上海市国际科技合作基金(10410708800),中国博士后科学基金(20100480545),浙江省医药卫生科技计划项目(2012KYB176),宁波市自然基金(2010A610052)
315010 宁波,宁波市第二医院介入治疗科(汪建华);第二军医大学附属长海医院核医学科(汪建华、张建、孙高峰、茅娟莉、潘桂霞、彭烨、左长京),放射科(李晓栋),病理科(郑建明)
左长京,Email: changjing.zuo@gmail.com
2012-07-03)
(本文编辑:吕芳萍)

