Gs在SP活化NK92-MI细胞中的作用
侯殿东,傅炜昕,顾鹏毅,范世光,王默然,汪佳慧,梁再赋*
(1.中国医科大学实验技术中心一部暨国家中医药管理局中药生物工程三级科研实验室,辽宁 沈阳 110001;2.辽宁中医药大学基础医学院,辽宁 沈阳 110032)
神经肽P物质(SP)是发现最早的神经肽之一,已有一些研究表明SP对NK细胞有调节作用[1-2],但其作用机制、信号通路尚不十分清楚。cAMP-PKA通路是信号传导领域里研究较多的经典通路,在介导细胞外各种刺激引起细胞反应的信号传导通路中扮演关键角色。cAMP-PKA通路中涉及的G蛋白有Gs和Gi 2种,为探索SP调控NK92-MI细胞功能的作用途径,本研究采用Gsα特异性拮抗剂 NF449(4,4',4″,4‴-(Carbonylbis(imino-5,1,3-benzenetriyl-bis(carbonylimino)))tetrakis-1,3-benzenedisulfonic acid, octasodium salt)[3]分析 Gs在 SP调节 NK92-MI细胞功能中的作用。通过检测NF449对SP活化后NK92-MI细胞活性及相关分子的影响,来探讨SP调控NK92-MI细胞的信号传导途径。
1 材料与方法
1.1 材料
1.1.1 菌株 NK92-MI细胞株购自中科院上海细胞库。
1.1.2 主要试剂 NF449,美国 R&D 公司;α-MEM培养基,美国Invitrogen公司;马血清及胎牛血清,美国 HYCLONE公司;SP,美国 Sigma公司;Real-Time PCR反应试剂盒,TaKaRa公司。
1.2 方法
1.2.1 NK细胞培养 用含12.5%胎牛血清和12.5%马血清的α-MEM培养基传代培养。实验组NK92-MI细胞用Gs拮抗剂NF449(终浓度10 μmol/L)预先作用30 min(无NF449预处理组用相同体积PBS作用),再以浓度为10-12mol/L的SP作用24 h(杀伤试验)或48 h(增殖试验),分别检测各指标。
1.2.2 NK92-MI细胞对 K562杀伤活性的测定K562细胞以10%FBS RPMI-1640培养液常规传代培养。以对数期的K562细胞为靶细胞,各实验孔加入靶细胞100 μL/孔(浓度为1×105/mL),使效靶比分别为4∶1,同时设效应细胞对照孔、靶细胞对照孔及空白对照孔,各孔均设3复孔。效靶细胞共同孵育4 h后,每孔加入 CCK-8 液(5 mg/mL)20 μL,再继续孵育1 h。用酶标仪于450 nm处测定OD值。按下列公式计算 NK-92MI细胞对K562细胞的杀伤率:NK细胞杀伤率(%)=(1-(杀伤实验组 OD值 -效应细胞对照组 OD值)/靶细胞对照组OD值)×100%。
1.2.3 NK92-MI细胞增殖活性的测定 实验组NK92-MI细胞用 Gs拮抗剂 NF449预先作用30 min(无NF449预处理组用相同体积PBS作用),再以浓度为10-12mol/L的SP作用48 h,每孔加入 CCK-8液(5 mg/mL)20 μL,再继续孵育1 h。用酶标仪于450 nm处测定OD值。
1.2.4 Real-Time PCR 检测 IFN-γ、LFA-1 mRNA表达水平 IFN-γ、LFA-1、内参基因GAPDH的引物的引物用 Primer Premier 5.0软件设计,由TaKaRa公司(大连)合成,各引物序列见表1。RNA制备采用异硫氰酸胍(Trizol)法,RT反应及Real-Time PCR反应参照试剂盒说明书,应用ABI PRISM 7500 Real-Time PCR System进行检测,PCR反应采用两步法。以GAPDH作参照基因,用2-ΔΔCt法比较实验组相对表达量与对照组的倍数差异。

表1 PCR用引物Table 1 Primer sequences used in the article
2 结果与分析
2.1 NF449对SP活化NK92-MI细胞杀伤活性的影响
浓度为10-12mol/L的SP能够促进无NF449预处理组细胞杀伤活性,与对照组比较有明显差异(P﹤0.05),但对NF449预处理组细胞则无明显促进杀伤活性作用。在浓度为10-12mol/L SP作用下,无NF449预处理组细胞杀伤活性明显高于NF449预处理组细胞(P﹤0.05)。结果见图1。
2.2 NF449对SP活化NK92-MI细胞增殖活性的影响
浓度为 10-12mol/L的 SP对无 NF449预处理组和NF449预处理组细胞均有促进增殖活性作用,与对照组比较有明显差异(P﹤0.05);在此浓度的 SP作用下,2组细胞的增殖活性无明显差异(P>0.05)。结果见图2。
2.3 NF449对 SP活化 NK92-MI细胞 IFN-γ mRNA表达的影响
浓度为10-12mol/L的SP对无NF449预处理组NK92-MI细胞IFN-γ mRNA的表达有促进作用,与对照组比较有明显差异(P﹤0.05),但对NF449预处理组NK92-MI细胞IFN-γ mRNA的表达与相应对照组相比无明显促进作用(P﹥0.05)。结果见图 3。
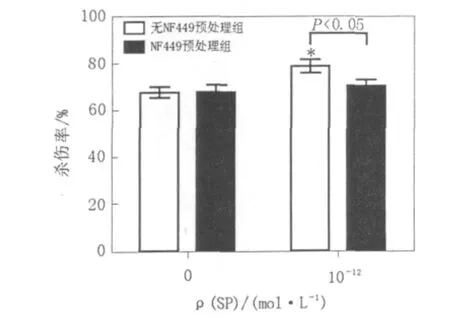
图1 NF449对SP活化NK92-MI细胞杀伤活性的影响Fig.1 Effects of NF449 on cytotoxicity of SP-activated NK92-MI cells
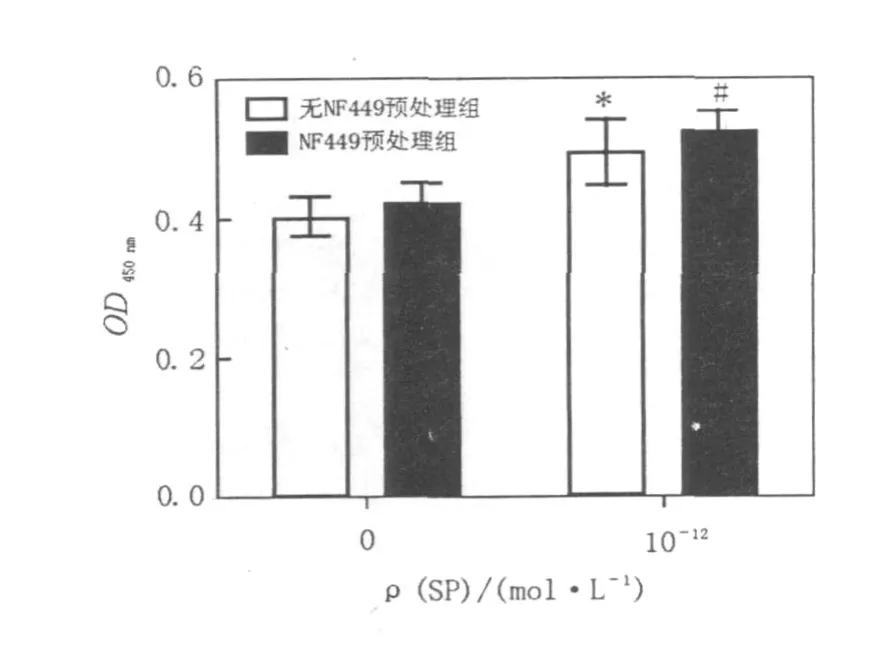
图2 NF449对SP活化NK92-MI细胞增殖活性的影响Fig.2 Effects of NF449 on proliferation of SP-activated NK92-MI cells
2.4 NF449对 SP活化 NK92-MI细胞 LFA-1 mRNA表达的影响
浓度为10-12mol/L的SP和NF449对NK92-MI细胞LFA-1 mRNA的表达均无明显影响(P>0.05)。结果见图 4。
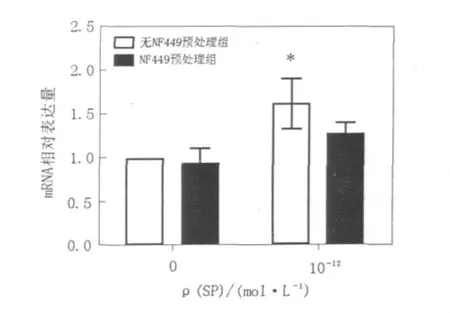
图3 NF449对SP活化NK92-MI细胞IFN-γ mRNA表达的影响Fig.3 Effects of NF449 on IFN-γ mRNA expression of SP-activated NK92-MI cells

图4 NF449对SP活化NK92-MI细胞LFA-1 mRNA表达的影响Fig.4 Effects of NF449 on LFA-1 mRNA expression of SP-activated NK92-MI cells
3 讨论
由前期研究结果表明,使用NK-1R特异性拮抗剂可完全阻断SP对NK92-MI细胞的促增殖作用;大部分阻断SP对NK92-MI细胞杀伤活性的增强作用;大部分阻断SP对NK92-MI细胞杀伤介质mRNA表达的增加作用[4]。说明 SP促进NK92-MI细胞增殖、增强NK92-MI细胞杀伤活性主要依赖于NK-1R。另外,结果显示SP作用于NK92-MI细胞后,对其各项功能的调节作用均发生在较晚的时间点(24 h)[4],进一步说明SP对NK92-MI细胞的各种调节作用应为SP激活NK-1R后的下游事件。
NK-1R属G-蛋白偶联受体家族,受体激活后通过G-蛋白调节第二信使的形成[5]。因此有必要进一步研究SP对与G蛋白影响。G蛋白根据对腺苷酸环化酶(AC)的作用,可分为刺激性G蛋白(Gs)和抑制性G蛋白(Gi)。Gs的主要作用是激活AC和钙离子通道,Gi的主要作用是抑制AC 和激活钾离子通道[6]。G 蛋白由 α、β、γ 3个亚基组成,Gα亚基在信号传递过程中发挥主导作用。
NF 449是一种Gsα亚基选择性拮抗剂,可抑制GTP与Gαs的结合,同时也可抑制细胞膜内腺苷酸环化酶(AC)活性[7]。
结果显示浓度为10-12mol/L的SP能够促进无NF449预处理组细胞杀伤活性,但对NF449预处理组细胞则无明显促进杀伤活性作用。且在此浓度SP作用下,无NF449预处理组细胞杀伤活性明显高于 NF449预处理组细胞。这表明NF449对SP的促杀伤活性具有阻断作用。
浓度为10-12mol/L的SP对无NF449预处理组和NF449预处理组细胞均有促进增殖活性作用;在此浓度的SP作用下,2组细胞的增殖活性无明显差异。结果表明,NF449对SP的促增殖活性无明显影响。
以上结果表明NF449可通过阻断Gs抑制SP的促杀伤活性,因此有必要对NF449对NK92-MI细胞与杀伤活性相关的分子的影响进行进一步研究。
IFN-γ是NK细胞活化后分泌的重要效应分子,参与调节淋巴细胞亚群的增殖、分化,能激活单核巨噬细胞、诱导多种细胞表达MHCⅠ类和Ⅱ类分子而增强抗原递呈、促进Th0细胞向Thl分化等[8]。通常认为,IFN-γ是免疫应答的正向调节剂,不仅能通过多种机制上调免疫应答,而且能直接杀伤肿瘤细胞和病毒感染的细胞[9]。
结果表明浓度为 10-12mol/L的 SP对无NF449预处理组NK92-MI细胞IFN-γmRNA的表达有促进作用,但对NF449预处理组NK92-MI细胞IFN-γmRNA的表达无明显促进作用。以上结果表明SP可通过Gs介导的信号通路促进IFN-γmRNA的表达,这也可能与SP促进NK92-MI细胞的杀伤活性有关。
LFA-1能与靶细胞表面ICAM-1结合引发细胞内产生一系列的信号转导,使细胞完成其黏附、游走以及吞噬等功能[10]。因此,LFA-1在淋巴细胞与抗原提呈细胞以及杀伤细胞与靶细胞的免疫反应中起着重要作用。结果表明SP和NF449对NK92-MI细胞杀伤活性均无明显影响。
以上结果显示 NF449对 SP促进 IFN-γ mRNA表达的活性具有一定的阻断作用,这表明SP可通过Gs介导的信号通路促进IFN-γ mRNA的表达,这可能是SP促进杀伤活性的机制之一,因此有必要对IFN-γ以及其他与杀伤相关分子进行进一步研究。
[1]周爱平,顾鹏毅,傅炜昕,等.生物肽SP对NK细胞NKG2D/NKG2A受体表达的影响[J].微生物学杂志,2011,6(6):57-61.
[2]傅炜昕,秦博,顾鹏毅,等.生物肽SP对NK细胞活化性受体NCRs表达的影响[J].微生物学杂志,2012,1(1):64-69.
[3]Lagadari M,Lehmann K,Ziemer M,et al.Sphingosine-1-phosphate inhibits the cytotoxic activity of NK cells via Gs protein-mediated signalling[J].Int J Oncol,2009,34(1):287-294.
[4]Fu WX,Qin B,Zhou AP,et al.Regulation of NK92-MI cell cytotoxicity by substance P[J].Scand J Immunol,2011,74(2):107-113.
[5]Ulfers AL,Piserchio A,Mierke DF.Extracellular domains of the neurokinin-1 receptor:structural characterization and interactions with substance P[J].Biopolymers,2002,66(5):339-349.
[6]Bradley J,McLoughlin D.Use of the DiscoveRx Hit hunter cAMPII assay for direct measurement of cAMP inGs and Gi GPCRs[J].Methods Mol Biol,2009,552:171-179.
[7]Hohenegger M,Waldhoer M,Beindl W,et al.Gsalpha-selective G protein antagonists[J].Proc Natl Acad Sci U S A,1998,95(1):346-351.
[8]Wang R,Jaw JJ,Stutzman NC,et al.Natural killer cell-produced IFN-γ and TNF-α induce target cell cytolysis through upregulation of ICAM-1[J].J Leukoc Biol,2012,91(2):299-309.
[9]Korbel DS,Finney OC,Riley EM.Natural killer cells and innate immunity to protozoan pathogens[J].Int J Parasitol.2004,34(13-14):1517-1528.
[10]Theorell J,Schlums H,Chiang SC,et al.Sensitive and viable quantification of inside-out signals for LFA-1 activation in human cytotoxic lymphocytes by flow cytometry[J].J Immunol Methods,2011,366(1-2):106-118.

