5种中药不同组合抑制小鼠S180肉瘤及抗血管生成作用的比较研究*
杨 峰,高启龙,姚亚民,刘晓莉,田同德
(郑州大学附属肿瘤医院中西医结合科,郑州 450008)
随着分子生物学的研究进展,中医药对肿瘤的影响也从免疫功能调节研究发展到新的治疗靶点——抗肿瘤血管生成。随着对肿瘤血管形成机制的深入研究和其抑制剂的开发,许多学者开始研究中医药抗肿瘤血管生成作用,虽然研究血管生成的方法、药物很多,但缺乏明确的疗效和机制及用于临床抗血管生成的中药。尤其是目前对中药抗血管生成的研究侧重于中药单体或单味中药研究,复方中药研究血管生成的很少,即使有也是对中药成方的验证。在前期研究中,我们从文献中筛选出19种抗血管生成的中药单体,又运用鸡胚绒毛尿囊膜法对这19种中药单体抗血管生成的功效进行了比较,确定了藤黄酸、人参皂苷、斑蝥素、青蒿琥脂、苦参碱这5种中药抗血管生成能力最强。还运用鸡胚绒毛尿囊膜法和体外抗血管生成法,比较了这5种中药不同组合抗血管生成的效果。本研究继续运用小鼠体内肿瘤实验进一步比较这5种中药不同组合的抗肿瘤血管生成作用,从而开发出确有疗效的抗肿瘤血管生成中药复方新药。
1 材料与方法
1.1 材料
1.1.1 动物与细胞 清洁级健康雌性昆明小鼠,4~6周龄,体重25g±3g,购自郑州大学河南省实验动物中心(合格证号2011-097)。分笼饲养,自由进食水,饲养间温度控制在21℃ ±2℃,相对湿度控制在50%~60%。小鼠S180肉瘤细胞株购自中科院上海生化细胞所。
1.1.2 药物与试剂 藤黄酸、人参皂苷、斑蝥素、青蒿琥脂、苦参碱均购自上海融禾医药科技发展有限公司,沙利度胺为常州第四药厂有限公司产品。兔抗鼠 CD31抗体购自美国 Biolegend公司,SABC试剂盒及DAB购自中科院上海细胞所,由河南省肿瘤研究所储存。
2 方法
2.1 荷瘤小鼠模型的建立
冷冻保存的腹水型S180细胞体外复苏,2000r/min离心5 min弃上清液,用无菌生理盐水稀释,调整瘤细胞至2×109/L,取5只健康昆明种小鼠,每只用上述细胞悬液0.4ml,ip,7d~10d后接种小鼠腹部明显增大、凸出。将其麻醉处死,无菌抽取乳白色腹水液,以生理盐水1∶1稀释,经台盼蓝染色后计算活细胞数95%,调整瘤细胞密度为2×109/L,64只小鼠右后肢腹股沟部皮下接种0.2ml,4d~5d后形成直径约6mm大小皮下肿瘤的小鼠作为荷瘤鼠。
2.2 分组与给药
建立荷瘤小鼠模型并随机分为7组,每组8只。A组:生理盐水组;B1-5组:为5种中药的不同组合,剂量分别为藤黄酸32mg/kg/d,斑蝥素2mg/kg/d,人参皂苷 20mg/kg/d,青蒿琥脂 50mg/kg/d,苦参碱50mg/kg/d。按上述剂量给药组合如下:B1组:藤黄酸、人参皂苷、斑蝥素;B2组:藤黄酸、人参皂苷、青蒿琥脂;B3组:斑蝥素、人参皂苷、青蒿琥脂;B4组:藤黄酸、人参皂苷;B5组:藤黄酸、苦参碱;C组:沙利度胺50mg/kg/d。取上述7组药物灌胃,连续10d。
2.3 各组肿瘤体积和肿瘤质量观察
给药结束第2天处死小鼠,测量小鼠肿瘤质量与体积,肿瘤体积公式V=长×宽 ×0.5计算,并取肿瘤称重。肿瘤抑制指数H=(V对照组-V实验组)/V对照组×100%。
2.4 各组肿瘤微血管密度检测
处死小鼠,切取肿瘤组织、固定、包埋、切片,行免疫组化检查。免疫组化检查采用SABC法,按试剂盒操作说明进行。一抗为兔抗鼠CD31抗体,用PBS代替一抗作为阴性对照,瘤旁正常组织作为阳性对照。计数方法选择肿瘤组织细胞间质内孤立的棕黄色的血管内皮细胞或细胞簇或血管腔内径小于8个红细胞者代表一条单独的微血管。先在低倍视野下找到肿瘤组织内微血管密度最高的区域,然后在200倍视野下计数5个视野的微血管数目,取平均值,计算微血管密度。
3 统计学分析
4 结果
4.1 5种中药不同组合对小鼠S180肉瘤生长的抑制作用及抑制率
表1显示,A组移植瘤体积增长较快,而各治疗组移植瘤体积增长缓慢,C组和B1组最明显。实验结束时各组裸鼠的体重无明显差别,与实验前比较有增长但改变不明显,B1到B5组移植瘤平均体积和平均瘤质量与A组相比,差异均有统计学意义(P<0.05)。根据肿瘤质量和体积计算,B1组药物对小鼠S180肉瘤生长抑制率分别为45.80%和45.31%,各治疗组小鼠饲养中未见药物不良反应。
4.2 5种中药不同组合对小鼠S180肉瘤血管生成的影响
表1显示,经抗 CD31抗体免疫组织化学染色,阳性信号位于细胞质和细胞膜,肿瘤组织内的血管内皮细胞呈棕色或棕黄色。各组移植瘤均有 CD31标记的新生血管表达,肿瘤组织边缘 MVD高于中央。以 A组中 MVD最高达39.92±7.97,从 B1到B5组 CD31表达逐渐减少,C组 MVD最低 仅为17.45±3.99。由5种中药不同组合的 B1到 B5组与 A组相比,差异具有显著性(P<0.05)。
表1 5种中药不同组合对小鼠S180肉瘤及血管生成的抑制作用(±s,n=8)
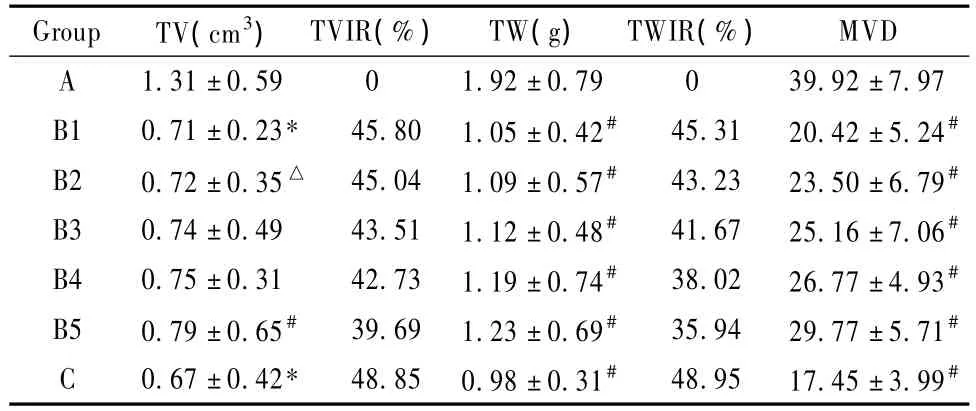
表1 5种中药不同组合对小鼠S180肉瘤及血管生成的抑制作用(±s,n=8)
注:#P <0.05,compared with NS group;MVD:microvessel density;IR:Inhibition rate;TV:Tumor volume;TW:Tumor weight
Group TV(cm3) TVIR(%) TW(g) TWIR(%)MVD A 1.31±0.59 0 1.92±0.79 0 39.92±7.97 B1 0.71±0.23* 45.80 1.05±0.42# 45.31 20.42±5.24#B2 0.72±0.35△ 45.04 1.09±0.57# 43.23 23.50±6.79#B3 0.74±0.49 43.51 1.12±0.48# 41.67 25.16±7.06#B4 0.75±0.31 42.73 1.19±0.74# 38.02 26.77±4.93#B5 0.79±0.65# 39.69 1.23±0.69# 35.94 29.77±5.71#C 0.67±0.42* 48.85 0.98±0.31# 48.95 17.45±3.99#
5 讨论
肿瘤血管生成(Angiogenesis)由 Folkman[1]于20世纪70年代提出,是实体肿瘤赖以生存的微循环模式,能为肿瘤提供各种养分,促进肿瘤的生长和转移。若没有血管形成,肿瘤的营养供给及代谢物排泄仅能靠简单的物理弥散,这极大限制了肿瘤细胞生长,肿瘤呈静息状态达数月乃至数年之久,直径只能维持在2mm~3mm以内而不表现明显的临床症状[2]。因此,肿瘤血管生成是肿瘤持续生长、侵袭转移的物质基础。抗血管生成为肿瘤的治疗提供了新的契机,与传统的肿瘤治疗相比它具有特异性强、正常组织不易受损、不易发生耐药、抗瘤谱广等优势。随着分子生物学的发展,人们试图寻找抗肿瘤血管生成作用强且毒副作用小的新型抗血管生成药物,中草药及其提取物逐渐受到重视。虽然目前研究中医药抗血管生成的文献很多,但临床实用确有疗效的中药抗血管生成制剂很少。
我们前期研究运用鸡胚绒毛尿囊膜法,从文献报道中选出具有抗血管生成作用的19种中药,但这些中药或提取物都未运用于临床,原因可能是虽然实验中具有抗血管生成作用,但临床应用后抑制血管生成效果并不明显;虽然文献报道这些药物具有抗血管生成效应,但并没有进行比较哪些中药抗血管生成作用最强,以及我们在这些药物研究的基础上如何研发出抗肿瘤血管生成作用更强的药物并能运用于临床。从文献报道来看,这19种中药提取物都具有抗血管生成的作用,没有比较就没有鉴别,没有比较就不能开发出切合临床实用的抗血管生成中药新药。前期研究结果表明(另行发表),去甲斑蝥素、人参皂苷、苦参碱、青蒿琥脂、藤黄酸5种中药对CAM血管生成具有明显的抑制作用,表现为 CAM新生血管密度降低,管径变细,血管分布杂乱,部分血管出现断裂,颜色变浅。CAM照片经计算机分析表明,5种中药抑制血管生成能力的顺序为藤黄酸>人参皂苷>青蒿琥脂>苦参碱>斑蝥素。
为进一步提高中医药抗肿瘤血管生成的疗效,我们在前期研究的基础上对已经筛选出的疗效较强的中药进行了重组,希望找到疗效较强的抗肿瘤血管生成的中药组合。根据实验结果,藤黄酸、人参皂苷、斑蝥素组合抗肿瘤血管生成能力最强,藤黄酸、人参皂苷、青蒿琥脂组合次之,第三是斑蝥素、人参皂苷、青蒿琥脂组合,第四是藤黄酸、人参皂苷组合,第五是藤黄酸、苦参碱组合。在抗肿瘤血管生成效应最强的这一组合中的药物,已有文献报道这些药物对多种肿瘤都有抗血管生成作用,其中藤黄酸抗血管生成的能力较强,这与Yi T等的研究结果一致[3]。人参皂苷也有明确的抗血管生成作用[4],去甲斑蝥素对乳腺癌和胆囊癌也都有明显的抗血管生成效应[5、6],这为我们进一步的临床研究奠定了深厚的基础。
因此,有效的抗肿瘤中药的筛选、提炼和重组,给抗肿瘤血管生成治疗开辟了新的前景,但中医药抗肿瘤血管生成的研究还有很多问题需要解决。主要有多味中药的不同组合及1味药在多个方剂中抗肿瘤血管生成的作用机制是什么?为什么单纯中药抑制肿瘤血管生成疗效欠理想?中药的作用效力如何提高?因此笔者认为,我们的下一步任务是在当前中医药抑制血管生成进展基础上,利用现代医学研究手段,继续对能抑制血管生成的中药单体进行筛选、重组和研发,使我们更进一步地对当前的科研成果进行总结和升华,深入挖掘中医药抑制肿瘤血管生成的优势和潜能。而多层面、多学科相结合将中医药抗肿瘤血管生成机制研究推向一个新的水平,开发出有确切疗效且能在临床上应用的中药单体或复方血管生成抑制剂,以进一步提高肿瘤的治疗效果,延长患者的生命,从而使中医药更好地为广大肿瘤患者服务。
[1]Folkman J.Tumor angiogenesis:therapeutic implications[J].N Engl J Med,1971,285(21):1182-1186.
[2]Folkman J, BronderT, Palmblad J, etal. Angiogenesis research:guidelines for translation to clinical application[J].Thromb Haemo,2001,86(4):23-33.
[3]Yi T,Yi Z,Cho S-G,et al.Gambogic acid inhibits angiogenesis and prostate tumor growth by suppressing vascular endothelial growth factor receptor 2 signaling[J].Cancer Research,2008,68(6):1369-1377.
[4]辛颖,姜新,崔俊生,等.20(S)-人参皂苷 Rg3对血管内皮细胞增殖和迁移的抑制作用[J].肿瘤防治研究,2010,37(12):1352-1355.
[5]范跃祖,陈春球,赵泽明.去甲斑蝥素对胆囊癌肿瘤血管生成的作用及机制研究[J].中华医学杂志,2006,92(10):693-699.
[6]林晓燕,宋和平,胡赟宏.去甲斑蝥素对人乳腺癌血管生成的抑制作用[J].中国癌症杂志,2007,17(11):847-850.

