注射用鹿茸多肽生物活性测定方法研究
李丽静,刘少丽,徐 博,刘 佳,王楚盈,吴世佳,张 松
(长春中医药大学,长春 130117)
生物活性检定是检定药品质量的重要检验方法之一,中药是天然环境条件中产生的生物制品,具有成分复杂、可变因素多、活性成分多、作用靶点多、药效成分和毒性成分不清晰等特点。因此,中药质量标准仅用理化方法测定指标成分有一定的局限性,而通过生物活性检定方法可测定与临床相关的生物学活性,正适用于中药这样具有多种相似生物活性成分的药品。注射用鹿茸多肽为新鲜或冷冻的鹿茸中提取的骨肽溶液制成的无菌冻干品,辅料为甘露醇,性状为白色或类白色块状物。药理学表明,注射用鹿茸多肽有明显的促进骨生长作用[1-3]。为更好地控制其生物活性以便指导临床用药,本课题尝试体外培养成骨细胞,采用新生大鼠头盖骨成骨细胞和成骨样细胞株-人骨肉瘤细胞MG-63进行该药生物学活性检测标准的研究,结果如下。
1 材料
1.1 动物
新生24h内健康SD大鼠,吉林大学实验动物中心提供(合格证号为SCXK-(吉)2007-0003)。
1.2 细胞株
成骨样细胞株-人骨肉瘤细胞MG-63购于中国协和医科大学基础医学院细胞中心,生长于含10%胎牛血清的含必需氨基酸的DMEM中,常规传代培养。
1.3 药品
注射用鹿茸多肽样品(批号110608,25mg)由本课题组自制。
1.4 试剂
Ⅰ型胶原酶(协和医科大学基础医学院细胞中心);必须氨基酸(协和医科大学基础医学院细胞中心);胰蛋白酶(Sigma公司)青霉素和链霉素(Hyclone);L-谷氨酰胺(Sigma);二甲基亚砜(DMSO,Sigma);胎牛血清(Hyclone公司产品)噻唑蓝(MTT,Sigma);DMEM固体培养基(GIBCO公司产品);胰蛋白酶消化液-EDTA(协和医科大学基础医学院细胞中心);其他试剂为国产分析纯。
1.5 仪器
离心机(LD4-2A,上海安亭),酶标仪(Model-680,美国伯乐公司),倒置显微镜(CKX41,日本奥林巴斯),二氧化碳培养箱(MCO-175,日本三洋);分析天平(AL-204,Metter-Thermo Group),生物安全柜(305040195,France Thermo),超纯水机(Human up 900,韩国 Human)。
2 方法
2.1 试剂与药液的配制
2.1.1 MTT溶液的配制 称取250mgMTT放入小烧杯中,加50mL PBS(0.01mol/L,pH7.2)在电磁力搅拌机上搅拌30min,用0.22μm的微孔过滤器除菌分装,4℃保存。
2.1.2 药液的配制 注射用鹿茸多肽临用前用高糖 DMEM培养基配制,0.22μ微孔滤膜除菌后,给药时用高糖DMEM培养基稀释至所需浓度,作为供试品使用。
2.2 细胞培养方法
2.2.1 人成骨样细胞株MG-63的培养与传代人成骨样细胞株MG-63生长于含10%胎牛血清维生素 C(50mg/L),L-谷氨酸(300mg/L)的DMEM培养液中,0.25%胰蛋白酶-EDTA消化液消化传代,在37℃ 5%CO2条件下常规方法培养。
2.2.2 大鼠乳鼠成骨细胞的分离、培养与传代采用Ⅰ型胶原酶梯度培养法进行新生大鼠头盖骨成骨细胞的培养[4、5],将 24h 内出生的 Wistar乳鼠10只直接浸泡于75%酒精中消毒15min,取出放入平皿中。无菌条件下操作取其头盖骨,放入装有4℃预冷的PBS液(含100U/mL的青霉素和100μg/mL的链霉素)的培养皿中,剔除头盖骨骨膜及周围软组织,用PBS液清洗后,剪碎至1mm×1mm小片,再用 PBS液冲洗2次。将洗净的骨组织移入0.25%胰蛋白酶中37℃下消化20min,以消化清除纤维组织,弃掉上清液再将骨片移入0.1%Ⅰ型胶原酶中,37℃下消化60min,用含血清的培养液终止消化,同样操作重复2次,合并2次的Ⅰ型胶原酶消化液,离心弃掉上清液,加入细胞培养液清洗后吹打均匀成细胞悬液,计数并以终浓度1×106个/mL接种于25mL培养瓶中(预置消毒玻片,以便于鉴定细胞)。在37℃ 5%CO2、饱和湿度恒定条件下培养,隔日观察、换液。细胞长成致密单层铺满培养瓶底,即可进行传代。用0.25%胰蛋白酶消化使贴壁细胞松解,轻摇培养瓶细胞即可从培养瓶底部脱落下来,以终浓度1×104个/mL接种于新培养瓶内进行传代培养,以此法培养至第3代细胞可用于进行实验。
2.3 细胞形态学观察
细胞接种于25mL培养瓶中,每日于倒置显微镜下观察培养中的细胞形态及生长情况。细胞在倒置显微镜下观察贴壁前形态完整,呈均匀一致的球型,4h内细胞贴壁,细胞形态主要有长梭形、三角型、多角形,形态相似的细胞成堆出现,可呈簇生长。
图1显示,MG-63细胞比较大而丰满,更大更宽厚一些,生长速度比较快,一般3d即能长满单层;大鼠原代培养的头盖骨成骨细胞较小且狭长,镜下颜色比较浅,第1代生长比较缓慢,大概7d~10d长成单层,传代后生长速度比加快而且比较稳定。但总体形态相似,从形态上保留了成骨细胞的特征。

图1 倒置显微镜下细胞形态(×10)
2.4 注射用鹿茸多肽促成骨细胞增殖的活性验证及活性检测用细胞的选择
2.4.1 注射用鹿茸多肽对体外培养新生大鼠头盖骨成骨细胞增殖的影响 表1显示,成骨细胞分离、培养与传代方法同2.2.2。待细胞生长至60%~70%贴壁后,用0.25%胰蛋白酶消化,以含10%胎牛血清的DMEM培养液吹打制成细胞悬液,第2代细胞用含10%胎牛血清的DMEM培养液调整细胞密度至3×104,接种到96孔细胞培养板,每孔100μL,其中10孔加含10%胎牛血清的 DMEM培养液(不含细胞)100μL作为对照,置37℃ 5%C02培养箱培养 12h。弃去培养液供试品组,用DMEM培养基稀释样品至 1.0mg/ml、0.25mg/ml、0.01mg/ml,每孔加入 200μL,每批供试品做 10孔,细胞对照组和空白对照组每孔分别加入DMEM培养基 200μL,置 37℃ 5%C02培养箱培养 72h,结束培养前4h取出细胞培养板吸取培养液,每孔加入0.01mol/L的磷酸盐缓冲液(pH7.3)洗涤1次,然后每孔加入上述缓冲液(pH7.3)配制的 MTT[6]溶液30μL,继续培养4h。培养结束后,吸弃孔内 MTT溶液,每孔加入150μL的二甲基亚砜(DMSO),震荡培养10min,在酶标仪用590nm波长处测定其吸光度OD值。
2.4.2 注射用鹿茸多肽对体外培养成骨样细胞MG-63增殖的影响 用含10%的胎牛血清DMEM培养液常规培养MG-63细胞,0.25%胰蛋白酶的消化液消化传代培养,培养至第3代,消化后收集到的细胞用含10%胎牛血清的DMEM培养液调整细胞密度至3×104,接种到96孔细胞培养板。给药浓度、分组、培养时间同2.4.1。表2显示,72h后在酶标仪用590nm波长处测定其吸收度OD值,比较各样品与细胞对照间的统计学差异。

表1 注射用鹿茸多肽对体外培养成骨细胞增殖的影响(72h,n=10,x珋±s)
表2 注射用鹿茸多肽对体外培养MG-63细胞增殖的影响(72h,n=10,±s)

表2 注射用鹿茸多肽对体外培养MG-63细胞增殖的影响(72h,n=10,±s)
注:与细胞对照组比较:**P <0.01,*P <0.05
组 别 给药剂量 OD值细胞对照 200μL培养液0.175±0.032高 剂 量 1.00mg/ml 0.256 ±0.028**中 剂 量 0.25mg/ml 0.250 ±0.023**低 剂 量 0.01mg/ml 0.208±0.026*
2.4.3 活性检测细胞的选择 通过实验结果可知,注射用鹿茸多肽对原代培养的大鼠头盖骨成骨细胞和MG-63细胞均具有促增殖作用,由于MG-63细胞株稳定、细胞间个体差异小、来源清楚、培养条件稳定、培养更方便,故采用 MG-63细胞作为活性检测的细胞株进行实验。
2.5 注射用鹿茸多肽活性检测细胞密度优化
表3显示,用含10%的胎牛血清的DMEM培养液调整 MG-63细胞密度至 5 ×103、5 ×104、5 ×105,分别接种到96孔细胞培养板,培养72h得出不同细胞浓度下的吸光度OD值。
表3 不同密度MG-63细胞的生长情况(72h,n=10,±s)

表3 不同密度MG-63细胞的生长情况(72h,n=10,±s)
细胞密度 OD值5×1030.154±0.030 5×104 0.387±0.031 5×1051.576±0.048
通过数据分析可得出细胞浓度不同,其吸光度值也不同,5×103细胞密度过低,细胞生长缓慢,OD值偏低;5×105细胞密度过大,3d已经长满单层抑制细胞生长且OD较大,其中细胞密度为5×104时,细胞生长状态良好,数据稳定。考虑到MTT检测的线性范围和加入注射用鹿茸多肽后的作用时间,所以选用此浓度范围的5×104为细胞实验密度。
2.6 注射用鹿茸多肽活性检测给药浓度及培养时间的筛选
细胞按5×104个/孔接种到96孔培养板上,分别与不同浓度的注射用鹿茸多肽培养基和正常DMEM-aa 培养基共同培养 12h、24h、48h、72h、96h、120h、144h。实验组和对照组分别取10个培养孔,在各时间点小心吸弃培养液,用 PBS洗涤1次,每孔加30μL MTT(5mg/ml),继续孵育 4h后终止培养。吸弃上清,每孔再加入150μL DMSO振荡培养10 min。表4显示,在酶标仪用590nm波长处测定其吸收度OD值,取其均值。图2显示,以时间为横坐标、OD值为纵坐标绘制细胞生长曲线。
表4显示,接种后所测得的细胞刚接种后12h、24h、48hOD值变化不大,到第3天~第6天细胞OD值逐渐增加。12h、24h、48hOD值变化不大,甚至OD值下降,分析原因可能由于消化和传代导致部分细胞受损伤死亡,使细胞数目减少,但48h~72h开始细胞数目逐渐增加。进入到对数增长期,考虑到一般细胞培养3d需要换液才能维持培养基的PH值及营养,为方便实验操作,选择72h为最佳测定时间。
表4 不同浓度注射用鹿茸多肽作用于MG-63细胞的生长情况(n=10,±s)
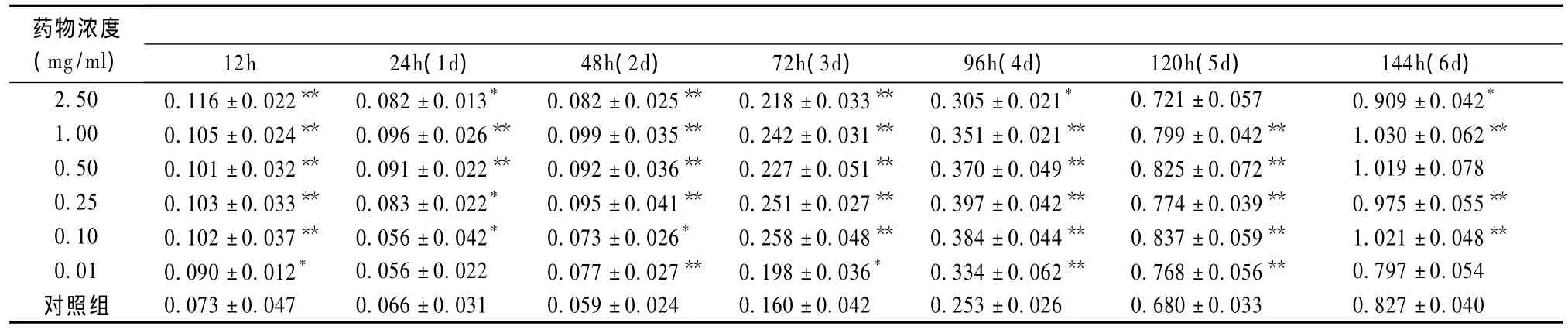
表4 不同浓度注射用鹿茸多肽作用于MG-63细胞的生长情况(n=10,±s)
注:与细胞对照组比较:**P <0.01,*P <0.05
药物浓度(mg/ml)12h 24h(1d) 48h(2d) 72h(3d) 96h(4d) 120h(5d) 144h(6d)2.50 0.116±0.022** 0.082±0.013* 0.082±0.025** 0.218±0.033** 0.305±0.021* 0.721±0.057 0.909±0.042*0.042 0.253±0.026 0.680±0.033 0.827±0.040 1.00 0.105±0.024** 0.096±0.026** 0.099±0.035** 0.242±0.031** 0.351±0.021** 0.799±0.042** 1.030±0.062**0.50 0.101±0.032** 0.091±0.022** 0.092±0.036** 0.227±0.051** 0.370±0.049** 0.825±0.072** 1.019±0.078 0.25 0.103±0.033** 0.083±0.022* 0.095±0.041** 0.251±0.027** 0.397±0.042** 0.774±0.039** 0.975±0.055**0.10 0.102±0.037** 0.056±0.042* 0.073±0.026* 0.258±0.048** 0.384±0.044** 0.837±0.059** 1.021±0.048**0.01 0.090±0.012* 0.056±0.022 0.077±0.027** 0.198±0.036* 0.334±0.062** 0.768±0.056** 0.797±0.054对照组 0.073±0.047 0.066±0.031 0.059±0.024 0.160±

图2 不同浓度骨肽注射液作用于MG-63细胞的生长情况
图2显示,0.1mg/ml剂量对细胞促增殖作用较好,因此选择0.1mg/ml、72h为最佳刺激浓度和最佳测定时间。
2.7 注射用鹿茸多肽活性检测重现性实验
表5显示,细胞生长对数期,消化、调整细胞密度为5×104个/孔接种至96孔板,置37℃ 5%CO2培养箱培养。待细胞贴壁4h后给注射用鹿茸多肽,培养72h后进行MTT检测。对110608供试品不同时间重复试验5次。
表5 注射用鹿茸多肽对MG-63细胞增殖的影响(72h,±s,n=10)

表5 注射用鹿茸多肽对MG-63细胞增殖的影响(72h,±s,n=10)
注:与细胞对照组比较:*P<0.05,RSD值=11.50%
对照组 注射用鹿茸多肽OD值第1次 0.249±0.027 0.302±0.032*第2次 0.256±0.036 0.306±0.033*第3次 0.254±0.037 0.310±0.041*第4次 0.254±0.038 0.309±0.029*第5次 0.248±0.036 0.303±0.041*
通过以上数据可知,该方法重复性好,准确性高,可以作为注射用鹿茸多肽生物学活性的常规检查方法。
3 讨论
采用Ⅰ型胶原酶梯度培养法分离新生乳鼠头盖骨成骨细胞,得到的成骨细胞纯度高、成活率高,且此法操作简单,可以作为新生乳鼠头盖骨成骨细胞的常规培养方法。细胞生长密度大小对实验结果有很大影响,密度过大会导致细胞在一定时间内成簇叠加生长,密度足够大时会抑制细胞生长导致细胞死亡,密度过低细胞生长缓慢,MTT检测时吸光度值偏低,影响评价药物作用。药物浓度较大,细胞生长速率较快,细胞数目足够多时会导致细胞死亡;药物浓度较低,细胞生长缓慢,MTT检测时吸光度值偏低,所以给药浓度较低或密度较低均会影响评价药物作用。细胞生长可分为滞留期、对数期、生长停止期3个阶段,给药培养时间过长,使细胞达到生长停止期甚至死亡,MTT检测吸光度值明显偏低;给药培养时间过短,未达到对数期则同样会使MTT检测吸光度值偏低,影响评价药物作用。
目前在中药注射剂质量标准中安全性检查项目均采用生物检定,而中药生物活性或生物效价测定项目却寥寥无几,虽有人工察香、水蛙等中药使用了生物活性测定法,但绝大多数中药制剂主要使用理化分析方法。近年来,基于欧美药品管理部门认为,草药的质量稳定性单靠测定已知的有效成分是不够的,因为草药及其制剂是以其整体作为有效物质。因此,中药的指纹图谱检测方法的推广,使中药质量控制从单一指标成分分析向综合成分分析的方向发展。但脱离成分的有效活性和安全活性来考虑指标成分含量测定或多种成分的指纹图谱检测方法,虽然分析方法先进,但仍具有一定的局限性。因此,国内外基本上都将指纹图谱的研究和应用限定在鉴别范畴,而采用生物检定的方法与主要活性成分理化分析方法相结合的中药质量标准,更能全面综合地保证药品的安全性、有效性和质量可控性。本课题以中药鹿茸制成的注射用鹿茸多肽为研究对象,初步探讨了应用主要药效学指标作为生物活性检测方法的可行性。通过实验表明,可以选择合适的中药主要药效学试验方法,开展生物活性测定方法和测定限值的研究。
[1]侯建平,李丽静,王晓丽,等.纳米鹿茸粗多肽对体外培养的软骨细胞代谢的影响[J].中国中医基础医学杂志,2006,12(7):555.
[2]郭颖杰.鹿茸多肽对骨、软骨细胞增殖的实验研究[J].中国生化药物杂志,1998,19(2):74.
[3]周丽秋,刘永强,王颖,等.梅花鹿茸和马鹿茸多肽化学性质及生物活性比较[J].中国中药杂志,2001,26(10):699.
[4]周秋丽,王丽娟,郭颖杰,等.鹿茸多肽对实验性骨折的治疗作用及机理研究[J].白求恩医科大学学报,1999,25(5):586.
[5]薛燕潍,李峰杰,王亦进,等.成骨细胞培养方法的改良[J].解剖科学进展,2005,11(11):82.
[6]黄洁,程云英.大鼠成骨细胞的体外培养和生物学特性的研究[J].南京铁道医学院学报,2000,19(2):88-90.
[7]杨春波,周凌云,李冀宏,等.MTT分析法检测重组成骨生长肽的活性[J].齐齐哈尔医学院学报,2002,23(4):361-362.

