力竭运动后大鼠心脏传导系统TNF-α的变化及其在运动性心律失常发生中的作用
常 芸,杨红霞
力竭运动后大鼠心脏传导系统TNF-α的变化及其在运动性心律失常发生中的作用
常 芸,杨红霞
目的:探讨力竭运动后不同时相心脏窦房结、房室结和浦肯野氏纤维细胞炎性因子TNF-α基因和蛋白水平的表达特点,为运动性心律失常发生机制的阐明提供实验依据。方法:100只健康成年雄性SD大鼠随机分为一次和反复力竭组及相应的对照组,每组10只。分别于力竭运动后0、4、12及24h应用激光显微切割技术定位并收集窦房结、房室结和浦肯野氏纤维细胞,采用实时荧光定量PCR和免疫荧光方法研究细胞炎性因子TNF-α的mRNA和蛋白表达的变化。结果:一次力竭运动后窦房结和房室结的TNF-αmRNA和蛋白表达规律基本一致,呈先升高后下降的趋势,在运动后即刻明显高于对照组(P<0.01)。浦肯野纤维TNF-αmRNA和蛋白表达呈先下降后上升趋势,在运动后4h明显低于对照组(P<0.01)。反复力竭运动后窦房结、房室结和浦肯野纤维的TNF-αmRNA和蛋白表达呈下降趋势,与对照组相比,窦房结和浦肯野纤维在运动后12h最明显,房室结在运动后24h最明显(P<0.01)。结论:一次力竭运动后即刻窦房结和房室结炎性因子TNF-α在mRNA和蛋白水平均大量表达,易引起心脏传导系统炎性细胞浸润,细胞间质增殖乃至纤维化和损伤,势必影响正常心脏的起搏和传导,构成运动性心律失常的病理基础。而反复力竭运动致心脏传导系统各部位细胞累积损伤,作为细胞炎性因子TNF-α在mRNA和蛋白水平未表现出明显的应激性反应,呈现出低表达趋势。
力竭运动;肿瘤坏死因子α;窦房结;房室结;浦肯野氏纤维;鼠;动物实验
运动性心律失常一直是运动医学领域十分关注的医学问题。而运动性心律失常的发生机制是一个极其复杂的过程,涉及众多因子。运动医学界对此进行了广泛的临床观察与调研[3]。常芸等针对运动性心律失常的发生机制进行了大量实验性研究[1,2]。目前,运动性心律失常发生的可能原因仍未完全阐明,以往实验性研究方法大多数集中心肌组织,很难概括心律失常发生的病理机制。心脏传导系统作为心电活动的控制中心和冲动传导的重要部位,其特殊的组织结构和细胞类型决定其具有不同于普通心肌的心电起搏和传导功能,与各种类型心律失常的发生和发展具有密切的关系,成为目前心脏研究领域十分关注的热点。
研究表明,心肌细胞含有TNF-α受体,心脏既是TNF-α的合成场所又是发挥作用的靶器官。TNF-α的局部炎症反应和促凝固作用,使TNF-α在调节心肌细胞、血管内皮细胞和血管平滑肌的代谢中起重要作用。有研究发现,TNF-α诱导的炎症反应直接损伤心肌纤维,使细胞间质重新分布,发生毛细血管渗出和堵塞等病理过程,直接造成心肌收缩功能的降低。此外,TNF-α还可直接或间接来影响心肌能量代谢和肌细胞膜上离子通道的功能,并通过NO通道诱导心肌细胞凋亡。因此,TNF-α是急性心肌梗死、慢性心力衰竭、病毒性心肌炎发生的重要介质;在缺血再灌注损伤、心肌循环功能障碍和心肌细胞凋亡中也起着重要的作用。研究认为,TNF-α是衡量心肌损伤的敏感指标。为此,本研究拟对力竭运动后心脏传导系统TNF-α的变化进行研究,观察力竭运动后心脏传导系统的TNF-α在mRNA和蛋白水平的表达规律及其在运动性心肌损伤和心律失常发生中的作用,试图为运动性心律失常发生机制的探讨提供理论与实验依据。
1 材料与方法
1.1 实验对象
健康雄性成年SD大鼠100只,8周龄,体重220±8 g。国家标准啮齿动物饲料喂养,自由饮食。饲养环境为室温20℃±2℃,光照时间12h,相对湿度40%~55%。
1.2 运动负荷
将100只实验大鼠随机分为10组,每组10只。其中,一次力竭和2周反复力竭游泳运动[11]各4组,相应安静对照2组。安静对照组不运动,力竭运动各组大鼠尾部负重为体重的3%,反复运动组每周运动6天,每天1次。力竭标准参照Thomas的报道[16],即“经过10s后动物仍不能返回水面,并且捞出后置于平面不能完成翻正反射”。1.3 取材
最后一次力竭运动后即刻、4h、12h及24h等不同时相取材,迅速取出心脏,沿心脏矢状面的方向将整个心脏用OCT包埋,液氮骤冷,作全心连续冰冻切片,光镜定位心脏传导系统,运用激光显微切割仪切割分别收集心脏传导系统细胞或细胞团。
1.4 实时荧光定量PCR检测
采用Trizol法提取总RNA,并逆转录cDNA,存于-20℃备用。通过互联网搜索Genbank查找目标因子TNF-α和内参照β-actin的引物基因序列,应用Primer 5软件进行引物设计,引物扩增目标基因片断长度均小于150bp,其PCR产物用2%琼脂糖凝胶电泳检测验证引物可用后,再进行荧光定量PCR,取定量PCR用96孔板,加入cDNA和引物配置25μL反应体系。实时定量RT-PCR主要过程:预变性95℃30s,PCR反应95℃10s,60℃30s,40个循环。检测CT值。利用SDS 2.2软件对实时定量PCR数据进行分析处理,并导出文件及图像。利用管家基因对目的基因的表达进行校正,得到相对定量结果(相对数值)。设计的引物由上海生工生物技术有限公司合成。
1.5 免疫荧光检测
心脏传导系统冰冻切片进行免疫荧光组织化学染色,采用Leica AD MDW活细胞多维图成像工作站和Leica Qwin图像分析系统对目标因子蛋白荧光强度进行定量,荧光强度用积分灰度表示(IOD),参考阴性对照标本中荧光强度,灰度值在40~130之间为蛋白阳性表达。
1.6 统计学分析
所有数据均用SPSS 11.5统计软件进行处理,结果用平均数±标准差表示,组间比较采用多因素方差分析,显著性水平为P<0.05。
2 结果
2.1 一般指标
经过两种力竭运动后大鼠不同程度出现心律失常,心脏肉眼观察有不同程度的充血,且反复力竭游泳运动后各时相组心脏重量指数均显著高于对照组心脏重量指数(P<0.05),一次力竭运动后和反复力竭运动后实验大鼠有不同程度的心律失常,具体数据结果参见参考文献[4]。
2.2 心脏传导系统TNF-αmRNA表达结果
2.2.1 一次力竭运动后心脏传导系统TNF-αmRNA表达特点
如表2所示,经一次力竭游泳运动后4h心脏传导系统窦房结TNF-αmRNA表达显著高于12h(P<0.01);即刻房室结TNF-αmRNA表达显著高于对照组和其他各运动组(P<0.01);4h、12h浦肯野氏纤维TNF-αmRNA表达显著低于对照组(P<0.01),4h又显著低于即刻(P<0.05)。
心脏传导系统不同部位在一次力竭游泳运动后存有差异,其中,即刻,浦肯野氏纤维显著高于房室结(P<0.01);4h,浦肯野氏纤维显著低于窦房结和房室结(P<0.01);24h,浦肯野氏纤维显著高于窦房结(P<0.05)。其他时相心脏传导系统各部位差异不明显(P>0.05)。
总体来看,一次力竭运动后窦房结和房室结的TNF-α mRNA表达规律基本一致,呈先升高后下降的趋势,在运动后即刻明显高于对照组(P<0.05)。浦肯野纤维呈先下降后上升的趋势,在运动后4h下降最明显(P<0.05,图1)。

图1 本研究一次力竭运动后大鼠TNF-αmRNA相对表达量曲线图Figure 1. The mRNA Expression of TNF-α in One-time Exhaustive Swimming Group
2.2.2 反复力竭运动后心脏传导系统TNF-αmRNA表达特点
如表3所示,经反复力竭游泳运动后,心脏传导系统窦房结、浦肯野氏纤维TNF-αmRNA表达各时相组间差异不明显(P>0.05);12h、24h房室结TNF-αmRNA表达均显著低于对照组和其他各运动组(P<0.01),即刻又显著低于对照组(P<0.05)。
心脏传导系统不同部位在反复力竭游泳运动后存有差异,其中,即刻,房室结显著高于浦肯野氏纤维(P<0.01);4h和12h,房室结显著高于窦房结(P<0.01)和浦肯野氏纤维(P<0.05)。其他时相心脏传导系统各部位差异不明显(P>0.05)。
总体来看,反复力竭运动后传导系统各部位TNF-α mRNA表达规律基本一致,呈下降趋势,窦房结和浦肯野氏纤维TNF-αmRNA表达在运动后12h下降接近低谷,房室结TNF-αmRNA表达在运动后24h下降至低谷(图2)。
2.2.3 不同力竭方式运动后心脏传导系统TNF-αmRNA表达特点
如表2、表3、图3所示,两种不同方式力竭运动后心脏传导系统窦房结TNF-αmRNA表达在反复力竭后即刻、4h显著低于一次力竭后即刻(P<0.05)和4h(P<0.01),其他时相组间无明显差异(P>0.05)。
如表2、表3、图4所示,两种不同方式力竭运动后心脏传导系统房室结TNF-αmRNA表达在反复力竭后即刻、24h显著低于一次力竭后即刻(P<0.01)、24h(P<0.05),其他时相组间无明显差异(P>0.05)。
如表2、表3、图5所示,两种不同方式力竭运动后心脏传导系统浦肯野氏纤维TNF-αmRNA表达在反复力竭后即刻、24h显著低于一次力竭后即刻(P<0.05)和24h(P<0.05),其他时相组间无明显差异(P>0.05)。
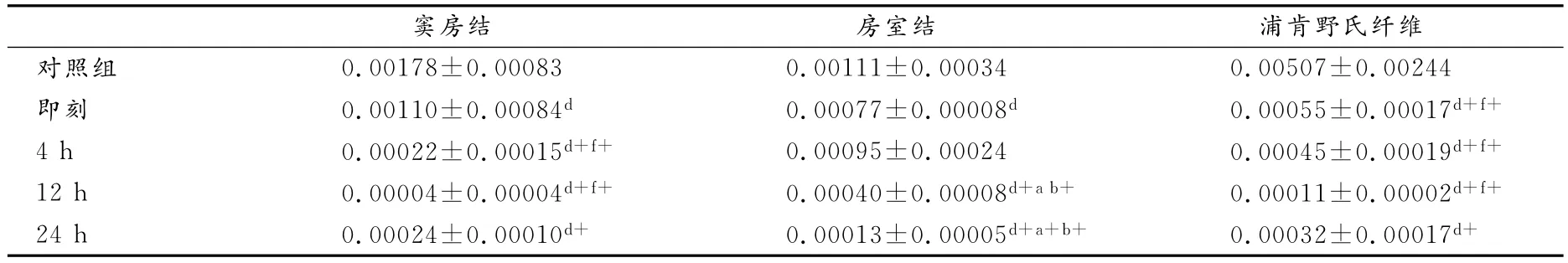
表3 本研究反复力竭运动后大鼠TNF-αmRNA相对表达量一览表Table 3 The mRNA Expression of TNF-αin Repeated Exhaustive Swimming Group
2.3 心脏传导系统TNF-α蛋白表达结果
2.3.1 一次力竭运动后心脏传导系统TNF-α蛋白表达特点
力竭运动后心脏传导系统TNF-α免疫荧光染色结果。如表4所示,经一次力竭游泳运动后,心脏传导系统窦房结、房室结TNF-α蛋白表达即刻显著高于对照组(P<0.01),4h、12h、24h又均显著低于对照组和即刻(P<0.01),其中窦房结TNF-α蛋白表达12h显著低于4 h和24h(P<0.01),房室结12h显著高于24h。
浦肯野氏纤维TNF-α蛋白表达运动后各组均显著低于对照组(P<0.01),4h、12h、24h又显著低于即刻(P<0.01),且24h显著高于4h和12h(P<0.01)。
心脏传导系统不同部位在一次力竭游泳运动后存有差异。其中,即刻和24h,浦肯野氏纤维TNF-α蛋白表达显著高于窦房结和房室结(P<0.01);12h,窦房结显著低于房室结和浦肯野氏纤维(P<0.01)。
总体来看,一次力竭运动后窦房结和房室结的TNF-α蛋白表达规律基本一致,呈先升高后下降的趋势,在运动后即刻明显高于对照组(P<0.05)。浦肯野纤维呈先下降后上升的趋势,在运动后4h下降最明显(P<0.05;图6)。
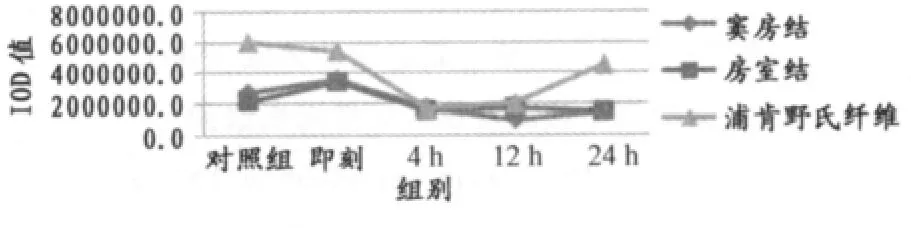
图6 本研究一次力竭运动后大鼠TNF-α蛋白表达总灰度值变化情况曲线图Figure 6. The Protein Expression of TNF-α in One-time Exhaustive Swimming Group
2.3.2 反复力竭运动后心脏传导系统TNF-α蛋白表达特点
如表5所示,经反复力竭游泳运动后,心脏传导系统窦房结TNF-α蛋白表达即刻显著低于对照组(P<0.01),4h、12h、24h又均显著低于即刻(P<0.01)。
房室结TNF-α蛋白表达12h显著低于对照组、即刻和4h(P<0.01),24h显著低于对照组、即刻、4h(P<0.01)和12h(P<0.05)。
浦肯野氏纤维TNF-α蛋白表达运动后各组均显著低于对照组(P<0.01),12h又显著低于即刻(P<0.01)。
心脏传导系统不同部位在反复力竭游泳运动后存有差异。其中,即刻,窦房结TNF-α蛋白表达显著高于房室结(P<0.05)和浦肯野氏纤维(P<0.01);4h和12h,房室结显著高于窦房结和浦肯野氏纤维(P<0.05);24h,浦肯野氏纤维显著高于窦房结和房室结(P<0.01)。
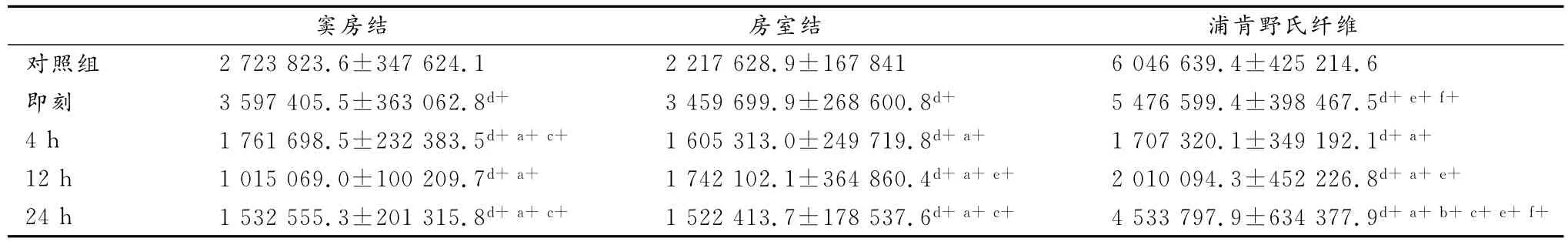
表4 本研究一次力竭运动后大鼠TNF-α蛋白表达总灰度值变化情况一览表Table 4 The Protein Expression of TNF-αin One-time Exhaustive Swimming Group

表5 本研究反复力竭运动后大鼠TNF-α蛋白表达总灰度值变化情况一览表Table 5 The Protein Expression of TNF-αin Repeated Exhaustive Swimming Group
总体来看,反复力竭运动后传导系统各部位TNF-α蛋白表达规律基本一致,呈下降趋势。其中,窦房结和浦肯野氏纤维TNF-α蛋白表达在运动后12h下降接近低谷,房室结TNF-α蛋白表达在运动后24h下降至低谷(图7)。
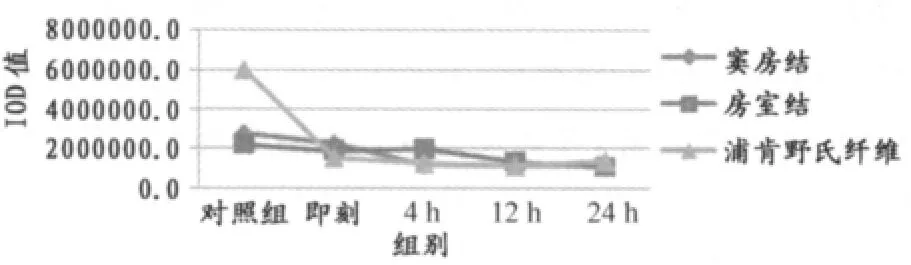
图7 本研究反复力竭运动后大鼠TNF-α蛋白表达总灰度值变化情况曲线图Figure 7. The Protein Expression of TNF-α in Repeated Exhaustive Swimming Group
2.3.3 不同力竭方式运动后心脏传导系统TNF-α蛋白表达特点
如表4、表5、图8所示,两种不同方式力竭运动后心脏传导系统窦房结TNF-α蛋白表达在反复力竭后即刻、4h、24h均显著低于一次力竭后即刻、4h、24h(P<0.01)。
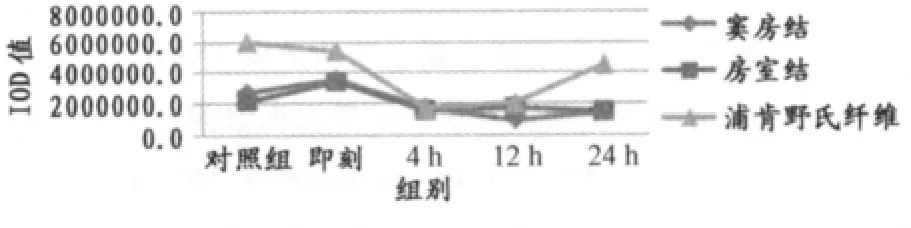
图8 本研究两种不同力竭运动后大鼠窦房结TNF-α蛋白表达总灰度值变化情况曲线图Figure 8. The Protein Expression of TNF-α on SAN in Two Exhaustive Swimming Group
如表4、表5、图9所示,两种不同方式力竭运动后心脏传导系统房室结TNF-α蛋白表达在反复力竭后即刻、12h、24h均显著低于一次力竭后即刻、12h、24h(P<0.01),反复力竭后4h显著高于一次力竭后4h(P<0.05)。
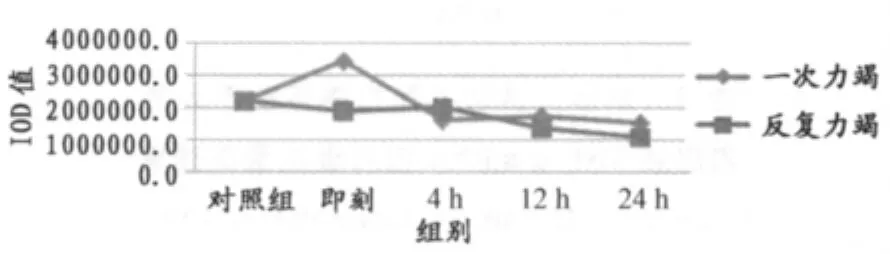
图9 本研究两种不同力竭运动后大鼠房室结TNF-α蛋白表达总灰度值变化情况曲线图Figure 9. The Protein Expression of TNF-α on AVN in Two Exhaustive Swimming Group
如表4、表5、图10所示,两种不同方式力竭运动后心脏传导系统浦肯野氏纤维TNF-α蛋白表达在反复力竭后即刻、4h、12h和24h均显著低于一次力竭后即刻、4h、12h和24h(P<0.01)。

图10 本研究两种不同力竭运动后大鼠浦肯野氏纤维TNF-α蛋白表达总灰度值变化情况曲线图Figure 10. The Protein Expression of TNF-αon Purkinje’s Fiber in Two Exhaustive Swimming Group
3 讨论
近年研究表明,TNF-α是急性心肌梗死、慢性心力衰竭、病毒性心肌炎和运动性心肌损伤的重要介质;在缺血再灌注损伤、心肌循环功能障碍和心肌细胞凋亡中也起着重要的作用,认为是衡量心肌损伤的敏感指标。Hedayat M等[5,6]在心力衰竭患者的血浆中发现TNF-α的高表达。随后的研究[7,13]也发现,慢性心衰患者中TNF-α,水平比对照组显著增高,并且TNF-α的浓度水平反应心衰的严重程度。心肌细胞含有TNF-α受体,心脏既是TNF-α的合成场所又是发挥作用的靶器官。TNF-α的局部炎症反应和促凝固作用,使TNF-α在调节心肌细胞、血管内皮细胞和血管平滑肌的代谢中起重要作用。有研究发现,TNF-α诱导的炎症反应直接损伤心肌纤维,使细胞间质分裂、重新分布,毛细血管液体渗出和毛细血管堵塞等病理过程,直接造成心肌收缩功能的降低。此外,TNF-α还可直接或间接来影响心肌能量代谢和肌细胞膜上离子通道的功能,并通过NO通道引起心肌细胞凋亡。研究发现,TNF-α可使心肌细胞发生凋亡,且细胞凋亡数量与TNF-α浓度成正比[12]。TNF-α来源于体内多种细胞,脂多糖(LPS)、病毒、真菌、过敏毒素、IL-1和免疫复合物等均可刺激其分泌,由157个氨基酸组成,相对分子质量为17000的可溶性多肽。研究发现[10],成熟的心肌细胞在某些应激状态下具有产生TNF-αmRNA及其蛋白质的能力,并可直接影响心脏结构和功能,并参与多种心脏病的病理过程。本研究从大鼠力竭运动后心脏传导系统的炎性因子TNF-α的表达变化入手,试图为运动性心律失常发生机制的阐明及其运动员心脏问题的医务监督提供理论与实验依据。
本研究结果发现,一次力竭运动后和反复力竭运动后引起部分实验大鼠心律失常,证实本研究建立运动性心律失常的模型成功[4]。且研究发现,一次力竭运动后窦房结TNF-αmRNA和蛋白表达呈现先上升后下降的趋势;反复力竭运动后呈现下降趋势。分析认为,一次力竭运动后TNF-α升高,可激活淋巴细胞增殖分裂、活化巨细胞、趋化各种炎性细胞,释放炎性因子引起窦房结细胞出现各种炎性反应[9,14]。随运动后恢复时间的延长,炎性反应逐渐减弱。由于反复力竭刺激作用,直接引起窦房结细胞凋亡和细胞坏死,导致TNF-αmRNA和蛋白表达相对下降或者不表达。提示,反复力竭运动后窦房结细胞受多种因素影响,累积损伤程度更重[8,15],作为细胞炎性因子TNF-α在mRNA和蛋白水平未表现出明显的应激性反应,呈现出低表达趋势。
本研究发现,一次力竭运动后房室结TNF-αmRNA和蛋白表达呈现先上升后下降的趋势,且运动后即刻显著高于对照组和其他各运动组。一次力竭运动后TNF-α升高,可激活各种炎性细胞,释放炎性因子引起房室结细胞出现各种炎性反应,进而引起房室结细胞损伤。随运动后恢复时间的延长,炎性反应逐渐减弱。反复力竭运动后呈下降趋势,且运动后12h、24h均显著低于对照组和其他各运动组。由于反复力竭的刺激,房室结细胞损伤加剧,引起细胞凋亡和细胞坏死,出现TNF-α表达相对下降的趋势,且反复力竭后即刻和24h显著低于一次力竭后即刻和24h。
本研究发现,一次力竭运动后心脏传导系统浦肯野氏纤维TNF-αmRNA和蛋白表达呈先下降后上升的趋势,且运动后4h、12h浦肯野氏纤维TNF-αmRNA表达显著低于对照组。提示,力竭运动后心脏传导系统不同部位的改变不仅存在差异,且有时相性改变,TNF-α在运动后即刻表达相对下降或者表达缺失,随恢复时间的延长,TNF-α出现异常高表达,这一改变可激活淋巴细胞增殖分裂、巨噬细胞活化,趋化各种炎性细胞,释放炎性因子引起浦肯野氏纤维出现各种炎性反应,从而影响心室内的兴奋性传导,引发室性心律失常。而反复力竭运动后TNF-α表达呈下降趋势,一直持续到运动后24h,且各时相组间差异不明显,作为细胞炎性因子TNF-α在浦肯野氏纤维mRNA和蛋白水平也未表现出明显的应激性反应,这一点与心脏传导系统其他部位的改变基本一致。
总之,力竭运动后即刻窦房结和房室结炎性因子TNF-α在mRNA和蛋白水平均大量表达,易引起心脏传导系统炎性细胞浸润,细胞间质增殖乃至纤维化和损伤,势必影响正常心脏的起搏和传导,构成运动性心律失常的病理基础。
4 小结
1.力竭运动后心脏传导系统TNF-α在mRNA和蛋白水平表达规律基本一致,其中,一次力竭运动后即刻窦房结和房室结炎性因子TNF-α在mRNA和蛋白水平均大量表达,易引起心脏传导系统炎性细胞浸润,细胞间质增殖乃至纤维化和损伤的发生,其结果势必影响正常心脏的起搏和传导,构成运动性心律失常的病理基础。而反复力竭运动致心脏传导系统各部位细胞累积损伤,作为细胞炎性因子TNF-α在mRNA和蛋白水平均未表现出明显的应激性反应,呈现出低表达趋势。
2.力竭运动后心脏传导系统不同部位的改变不仅存在差异,且有时相性改变,尤其表现在心脏浦肯野氏纤维滞后的异常高表达,又激活该部位淋巴细胞增殖分裂、巨噬细胞活化、趋化各种炎性细胞,释放炎性反应因子引起浦肯野氏纤维出现各种炎性反应,将影响心室内的兴奋性传导,构成室性心律失常的诱发因素。
[1]常芸.运动心脏理论与实践[M].北京:人民体育出版社,2008:106-132.
[2]常芸.运动员心脏的医务监督[M].北京:北京体育大学出版社,2009:203-207.
[3]曲绵域.实用运动医学[M].北京:北京科学技术出版社,1996:311-318.
[4]杨红霞,常芸.力竭运动后不同时相心脏窦房结ADAMTS-1的变化[J].中国运动医学杂志,2011,30(5):437-441.
[5]DUNLAY S M,WESTON S A,REDFIELD M M,et al.Tumor necrosis factor-alpha and mortality in heart failure:a community study[J].Circulation,2008,118(6):625-631.
[6]HEDAYAT M,MAHMOUDI M J,ROSE N R,et al.Proinflammatory cytokines in heart failure:double-edged swords[J].Heart Fail Rev,2010,15(6):543-562.
[7]HOHENSINNER P J,NIESSNER A,HUBER K,et al.Inflammation and cardiac outcome[J].Curr Opin Infect Dis,2011,24(3):259-264.
[8]HUANG C C,LIN T J,CHEN C C,et al.Endurance training accelerates exhaustive exercise-induced mitochondrial DNA deletion and apoptosis of left ventricle myocardium in rats[J].Eur J Appl Physiol,2009,107(6):697-706.
[9]JOBE L J,MELENDEZ G C,LEVICK S P,et al.TNF-alpha inhibition attenuates adverse myocardial remodeling in a rat model of volume overload[J].Am J Physiol Heart Circ Physiol,2009,297(4):H1462-H1468.
[10]KLEINBONGARD P,SCHULZ R,HEUSCH G.TNFalpha in myocardial ischemia/reperfusion,remodeling and heart failure[J].Heart Fail Rev,2011,16(1):49-69.
[11]KRAMER K,DIJKSTRA H,BAST A.Control of physical exercise of rats in a swimming basin[J].Physiol Behav,1993,53(2):271-276.
[12]LI S,JIAO X,TAO L,et al.Tumor necrosis factor-alpha in mechanic trauma plasma mediates cardiomyocyte apoptosis[J].Am J Physiol Heart Circ Physiol,2007,293(3):H1847-H1852.
[13]MARTINEZ,ROSAS M.Cardiac remodeling and inflammation[J].Arch Cardiol Mex,2006,76Suppl 4:S58-S66.
[14]SUZUKI K,NAKAJI S,YAMADA M,et al.Systemic inflammatory response to exhaustive exercise.Cytokine Kinetics[J].Exerc Immunol Rev,2002,8:6-48.
[15]TANAKA Y,KAWANISHI N,SHIVA D,et al.Exhaustive exercise reduces tumor necrosis factor-alpha production in response to lipopolysaccharide in mice[J].Neuroimmunomodulation,2010,17(4):279-286.
[16]THOMAS D P,MARSHALL K I.Effect of repeated exhaustive exercise on myocardial subcellular membrane structures[J].Int J Sports Med,1988,9(4):257-260.
The Expression of TNF-αin Cardiac Conduction System after Exhaustive Exercise and Their Role in Exercise Induced Arrhythmia
CHANG Yun,YANG Hong-xia
Objective:To discuss the gene and protein expression characters of TNF-αof cardiac sinus node,atrioventricular node and Purkinje fibers at different time-phrase after exhaustive exercise,providing experimental evidence for clarifying the mechanism of exercise-induced arrhythmia.Method:100healthy adult male SD rats were grouped into 10groups(10rats for each group)as 4groups of one-time exhaustive swimming group(n=40),4groups of 2-week repeated exhaustive swimming group(n=40)and 2control groups(n=20).Rats were sacrificed at 0,4,12,and 24hours after exhaustive swimming,then Laser microdissection(LMD)and immune fluorescent histochemical were underwent according to time-phrase.The SAN,AVN and Purkinje's fiber cells were spotted and collected in the approach of Laser Microdissection(LMD).The mRNA and protein expression of TNF-αon the SAN,AVN and Purkinje's fiber cells were analyzed by real-time fluorescent quantitative PCR,immunochemistry and image analysis.Results:Compared to control group,the expression of mRNA and protein of TNF-αon cardiac sinoatrial node and atrioventricular node increased greatly immediately after two exhaustive exercise(P<0.01).The expression of mRNA and protein of TNF-αon cardiac Purkinje fiber dropped markedly 4hours after one-time exhaustive exercise(P<0.01).The expression of mRNA and protein of TNF-αon heart conduction system declined significantly after repeated exhaustive exercise,especially at 12hours after exercise on sinoatrial node and atrioventricular node and 24hours on Purkinje's fiber cells(P<0.01).Conclusion:After onetime exhaustive exercise,the mRNA and protein of TNF-αgreatly expressed on sinoatrial node and atrioventricular node,causes inflammation and proliferation on fiber cells,leading to the cardiac sinus pacing and sinus electrical conduction abnormalities,which is one of the factors of arrhythmia.Repeated exhaustive exercise causes irreversible damage on cardiac conduction system,and the mRNA and protein of TNF-αon heart conduction system expressed at low level and no significant change has tested.
exhaustiveswimming;TNF-α;cardiacsinoatrialnode;atrioventricularnode;Purkinje'sfiber;rat;animalexperiment
G804.5
A
1000-677X(2012)07-0032-07
2012-03-08;
2012-06-18
国家体育总局体育科学研究所基本科研业务费资助项目(基本10-01)。
常芸(1957-),女,研究员,博士,博士研究生导师,主要研究方向为运动员心脏病生理与医学监督,Tel:(010)87182526,E-mail:changyun@ciss.cn。
国家体育总局体育科学研究所,北京100061
China Institute of Sport Science,Beijing 100061,China.

