运动预处理对大负荷跑台运动引起的大鼠心肌损伤干预作用及其机制探讨
许思毛,上官若男,彭峰林,苏全生
运动预处理对大负荷跑台运动引起的大鼠心肌损伤干预作用及其机制探讨
许思毛1,上官若男2,彭峰林1,苏全生2
目的:明确大负荷运动引起的心肌损伤基本特征,探讨运动预处理(EP)对其保护作用及作用机制。方法:成年雄性SD大鼠64只,随机分为安静对照组(AB组)、运动预处理对照组(AC组)、单纯大负荷运动组(B组)、运动预处理+大负荷运动组(C组);根据大负荷运动后即刻、6h、24h3个时相,又分别随机将B、C组依次分为B1、B2、B3与C1、C2、C3组。AC组与C组进行6周中等负荷跑台运动;C组于末次中等负荷运动后48h与B组进行一次性大负荷跑台运动。测定血清cTnI、CK-MB浓度;测定心肌SOD活性、MDA含量与Ca2+浓度、ATP含量(高效液相色谱仪法测定)及心肌细胞膜Na+-K+-ATPase、Ca2+-ATPase活性。结果:运动预处理可明显减轻大负荷运动引起的大鼠血清cTnI、CK-MB浓度升高程度。运动预处理可明显提高心肌SOD活性;明显减轻大负荷运动后心肌SOD指标下降程度及MDA、Ca2+指标的升高程度;明显减轻大负荷运动后心肌ATP含量及心肌细胞膜Na+-K+-ATPase、Ca2+-ATPase活性的下降程度。结论:EP对大负荷运动引起的心肌损伤具一定保护作用,这可能与EP提高的心肌SOD活性有关。
运动预处理;大负荷运动;心肌损伤;保护;鼠;动物实验
1 前言
无论是人体实验还是动物实验,均发现长时间大强度运动可引起机体心肌损伤[21,28,29],以往关于抗运动性心肌损伤方面的研究,主要是采用药物干预来进行。但就现有文献资料来看,用来干预运动性心肌损伤的药物种类较多且相互之间缺乏系统性比较研究,此外,药物对机体一些不可预测的效应也尚未明了,这些都给将药物干预运用到运动实践中带来很大问题。大量运动训练实践及运动医学研究表明,运动是一把“双刃剑”,虽然过于剧烈的运动对机体结构与功能有害,但适宜的运动能使机体组织发生良性适应性变化。关于运动引起的心脏保护作用的认识始于流行病学研究,研究发现,运动能减少冠心病发生率和死亡率。1999年,Yamashita等[32]正式提出了运动预处理(Exercise Preconditioning,EP)概念。运动预处理(EP)是指运动锻炼能增强心脏对缺血再灌注刺激的耐受性。动物在体心脏实验发现,剧烈运动引起大鼠心电图出现J点下移、T波、S波及R波幅值改变,ST-T弓背下压等变化,心肌发生急性缺血[6];通过电超速驱动模拟大运动负荷刺激离体心脏后,可直接观察到心肌梗死的缺血性损伤表现[3]。目前,国内关于EP对运动性心肌损伤干预研究尚处于试探性阶段。本研究通过反映心肌损伤的血液特异性敏感指标心肌肌钙蛋白-I(Cardiac Troponin-I,cTnI)及心肌型肌酸激酶(Creatine Kinase Rsoenzyme,CK-MB)指标的检测来反映大负荷运动引起的心肌损伤及观察运动预处理(EP)对其的干预作用。病理生理学研究提出缺血再灌注损伤机制主要有自由基、钙超载及能量代谢障碍等学说,运动医学界在对大负荷运动引起的心肌损伤研究过程中也有类似发现。本研究同步检测心肌超氧化物歧化酶(Superoxide Dismutase,SOD)和反映心肌自由基水平的丙二醛(Malondialdehyde,MDA)指标、心肌内Ca2+和三磷酸腺苷(Adenosine Triphosphate,ATP)及心肌细胞膜钠钾泵(Na+-K+-ATPase)、钙泵(Ca2+-ATPase)指标,来探讨EP对大负荷运动引起的心肌损伤干预作用的可能机制。
2 研究对象与方法
2.1 研究对象
成年雄性Sprague-Dawley(SD)大鼠64只,体重227± 17g,由四川大学华西医学院实验动物中心提供。大鼠自购回后在标准啮齿目动物饲养笼内分笼喂养,自由摄食饮水。保证通风条件良好,室温控制在27℃~28℃,相对湿度40%~60%,自然光照。
2.2 研究方法
2.2.1 动物分组与运动方式
将64只大鼠适应性喂养1周后,随机分为安静对照组(AB组,n=8)、运动预处理对照组(AC组,n=8)、单纯大负荷运动组(B组,n=24)与运动预处理+大负荷运动组(C组,n=24)。B组与C组又根据大负荷运动后即刻、6h、24h3个时相,各随机分为3组,分别依次记为单纯大负荷运动后即刻组(B1组,n=8)、单纯大负荷运动后6h组(B2组,n=8)、单纯大负荷运动后24h组(B3组,n=8)与运动预处理+大负荷运动后即刻组(C1组,n=8)、运动预处理+大负荷运动后6h组(C2组,n=8)、运动预处理+大负荷运动后24h组(C3组,n=8)。AB组不进行运动训练;AC组与B组、C组进行跑台运动(跑台为天津产6跑道小动物跑台),运动强度参考Bedford标准[15]制定。AC组运动方案:以坡度为+5°、速度为15.2m/min的强度完成每天持续60min、为期6周(6天/周)的长期中等负荷跑台运动。C组与B组运动方案:C组以坡度为+5°、速度为15.2m/min的强度完成每天持续60min、为期6周(6天/周)的长期中等负荷跑台运动,在末次运动48h后与B组一起,以坡度为+10°、速度为20m/min的强度进行一次性大负荷跑台运动,直至大鼠出现趴伏喘息,暂时对声、电、机械刺激均无逃避反应,即终止运动。
2.2.2 测试样品的制备
运动预处理对照组(AC组)在按中等运动负荷方案末次运动后48h时、B组与C组大负荷运动后的各时相小组B1、B2、B3与C1、C2、C3分别在相应时相,与安静对照组(AB组)一道分别用2%戊巴比妥纳腹腔麻醉,股动脉取血5ml后,立即处死取心脏(冰浴中进行)。所取血以3 000rpm离心10min,取血清,用于心肌肌钙蛋白-I(cTnI)、肌酸激酶同工酶MB(CK-MB)指标的测定。取心室肌,用PBS液充分洗尽残留血液,横切为前、中、后3部分。其中前部分(约300mg)用于细胞膜的制备,中间部分(约150mg)用于SOD、MDA及Ca2+指标测试样本制备,后部分(约100mg)用于大鼠心肌ATP样品的制备。
心肌SOD、MDA及Ca2+指标测试样本制备:将心室肌组织制成10%的组织匀浆,以4 000rpm离心30min,取上清液,用于Ca2+、超氧化物歧化酶(SOD)活性及丙二醛(MDA)指标的测定。
心肌ATP测试样品的制备:制备心肌ATP测试样品时先对心肌组织称重并做记录,然后在沸水浴中剪碎并保持在沸水浴中煮20min,冷却后匀浆,用缓冲液(50mmol/L甘氨酰甘氨酸,10mmol/l MgSO4,1mmol/L EDTA,pH7.6)定容至1ml,高速台式离心机离心5min(4℃、4 000 rpm),取上清液,即为提取的心肌ATP样本,冰箱中-70℃保存待测[9]。制备心肌ATP样品所需甘氨酰甘氨酸、MgSO4、EDTA购自美国Sigma公司。
心肌细胞膜制备:按照南京建成生物有限公司的方法分级离心(10 000rpm,20min)制备。取心室前壁肌,去掉心内、外膜后称重,加入9倍的试剂Ⅰ(蔗糖0.1M,EDTA 2 mM,咪唑1mM,pH7.4)用内切式匀浆机在冰浴中剪碎匀浆,制成10%匀浆滤液,两层纱布过滤后,离心取沉淀加入到5ml试剂Ⅰ中,离心2次取沉淀加入到10ml试剂Ⅱ[尿素1.3M,咪唑12mM,EDTA 2mM,MgCl2·6H2O 0.1mM,(NH4)2SO47.6mM,pH 7.4]中混匀,0℃放置48h后,离心取沉淀加入到试剂Ⅲ(咪唑25mM,组氨基酸125mM,EDTA 13μM,pH6.8)中,离心2次取沉淀即心肌细胞膜悬于约10ml试剂Ⅳ(咪唑25mM,组氨基酸50 mM,EDTA 0.3μM,pH 6.8)中,置0℃中保存,48h内测ATP酶活性[7]。
2.2.3 血清指标与心肌SOD、MDA、Ca2+及细胞膜指标检测方法
血清cTnI浓度采用ELISA法测定,CK-MB浓度采用免疫抑制法测定。心肌SOD活性采用黄嘌呤氧化酶法测定,MDA含量采用TBA法测定,Ca2+浓度采用偶氮胂Ⅲ法测定。心肌细胞膜Na+-K+-ATPase、Ca2+-ATPase活性采用定磷法测定。cTnI试剂盒由美国LDI公司提供;CK-MB试剂盒由北京中生北控生物科技股份有限公式提供;SOD试剂盒及MDA试剂盒均由南京建成生物工程研究所提供;钙(Ca)试剂盒由四川省迈克科技有限责任公司提供。
2.2.4 心肌ATP指标检测方法
心肌ATP含量采用高效液相色谱仪法测定。取心肌ATP提取样本100μl,加入浓度为1.6mol/L高氯酸(分析纯)200μl,0℃静置5min后,以20 000×g(0℃)离心10 min。取上清液200μl,加入浓度为1mol/L高氯酸100 μl,调节其pH值至6.5,20 000×g(0℃)离心10min,取上清液用于心肌ATP含量测试。测试仪器为美国Agilent1100高效液相色谱仪(High Performance Liquid Chromatography,HPLC)。
高效液相色谱仪测试ATP含量的色谱条件:美国Agilent C18.Hypersil ODS色谱分析柱(5μm,250mm×4.0 mm),柱温为20℃;流动相为97%的缓冲盐溶液+3%乙腈,缓冲盐溶液的配置:取适量200mmol/L的溶液Ⅰ(NaH2PO4200mmol/L,四丁基氢氧化铵3mmol/L),用溶液Ⅱ(Na2HPO4200mmol/L,四丁基氢氧化铵3mmol/L)调至pH 6.0;流速1mL/min;紫外检测波长为260nm;进样体积为20μl。采用外标法定量[19]。将ATP标准品定量分析后获得的回归方程和相关系数:

对处理好的本研究中大鼠心肌ATP样品溶液进行HPLC测定,记录其ATP的峰面积,代入上述方程计算后,获得各样品液的ATP质量浓度。经换算后,得到各组大鼠心肌组织中ATP的含量。ATP标准品的色谱图如图1所示,ATP的反应时间(RT)为12.722min。图2为本研究中一只大鼠心肌ATP样品色谱图,ATP的反应时间(RT)为12.707min。
ATP标准品,四丁基氢氧化铵,磷酸二氢钠,磷酸氢二钠,氢氧化钠,高氯酸(分析纯),均购自美国Sigma公司。实验所需超纯水由美国Millipore超纯水器制得。
图1 本研究ATP标准品色谱图(RT=12.722min)Figure 1. Chromatogram of ATP Standard Sample

图2 本研究大鼠心肌ATP样品色谱图(RT=12.707min)Figure 2. Chromatogram of Myocardial ATP in Rat
2.2.5 统计学分析
3 研究结果
3.1 大鼠大负荷跑台运动持续时间比较结果
如表1所示,单纯大负荷运动组(B组)、运动预处理+大负荷运动组(C组)大鼠以设定的运动强度完成一次性大负荷跑台运动至最后不能再坚持运动时,两组大鼠大负荷跑台运动持续时间具显著性差异,C组大鼠明显长于B组。
表1 本研究大鼠大负荷运动持续时间比较一览表(S)Table 1 List of Comparison of Heavy Load Training Time between Group B and C

表1 本研究大鼠大负荷运动持续时间比较一览表(S)Table 1 List of Comparison of Heavy Load Training Time between Group B and C
注:与B组相比,■P<0.05。
n 力竭运动持续时间(min)B组24 154±15 C组24 166±21■
3.2 各组大鼠血清心肌损伤指标CK-MB、cTnI浓度比较结果
与安静对照组(AB组)相比,B组大鼠大负荷运动后即刻(B1)、6h(B2组)及24h(B3组)血清CK-MB、cTnI浓度均明显升高,具非常显著性差异;其中,B2组变化最为明显,与其他2组有非常显著性差异。虽然C组大鼠大负荷运动后3h相小组血清CK-MB、cTnI浓度也明显升高,以运动后6h(C2组)最为明显;但C组大鼠大负荷运动后各时相小组的升高幅度均不如B组大负荷运动后各时相小组,具显著或非常显著性差异(表2、图3、图4)。
表2 本研究各组大鼠血清指标比较一览表(±S)Table 2 List of Comparison of Serumc Index in Each Group

表2 本研究各组大鼠血清指标比较一览表(±S)Table 2 List of Comparison of Serumc Index in Each Group
注:与AB组相比,▲P<0.05,▲▲P<0.01;与AC组相比,▼P<0.05,▼▼P<0.01;与B2组相比,##P<0.01;与C2组相比,◆◆P<0.01;与B1、B2、B3组同时相性相比,★P<0.05,★★P<0.01;下同。
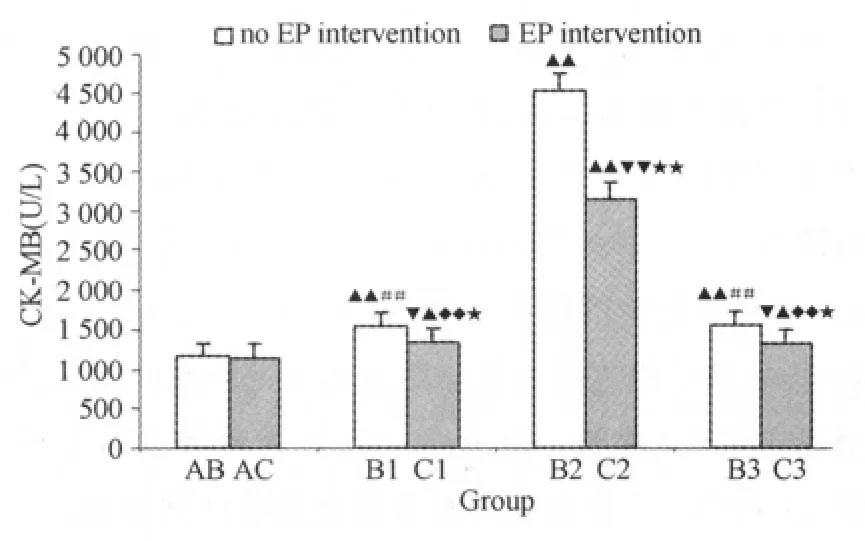
图3 本研究EP对大鼠大负荷运动后血清CK-MB浓度影响示意图Figure 3. Effect of EP on Serumc CK-MB Index after Heavy Load Training in Rat
3.3 各组大鼠心肌SOD活性、MDA含量、Ca2+浓度与ATP含量比较结果
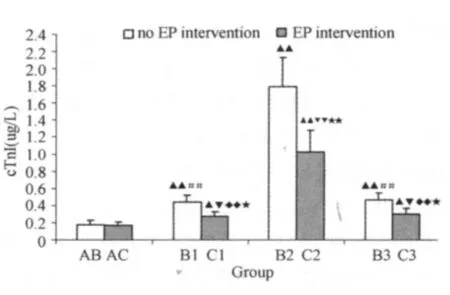
图4 本研究EP对大鼠大负荷运动后血清cTnI浓度影响示意图Figure 4. Effect of EP on Serumc cTnI Indexafter Heavy Load Training in Rat
与安静对照组(AB组)相比,运动预处理对照组(AC组)SOD活性明显增高,具显著性差异。B组与C组大鼠大负荷运动后各时相小组的心肌SOD活性均明显降低、MDA含量均明显升高,与运动前均具非常显著性差异;其中,运动后6h时相组(B2组或C2组)比其他2个时相小组SOD活性更低、MDA含量更高,具非常显著性差异。从大负荷运动后各时相小组的两两对应比较来看,运动预处理对大负荷运动引起的SOD活性下降、MDA含量升高具一定预防作用(表4、图5、图6)。

图5 本研究EP对大鼠安静及大负荷运动后心肌SOD活性影响示意图Figure 5. Effect on Myocardial SOD Index of EP Quiet after Heavy Load Training in Rat

图6 本研究EP对大鼠大负荷运动后心肌MDA含量影响示意图Figure 6. Effect on EP Myocardial MDA Index after Heavy Load Training in Rat
B组与C组大鼠大负荷运动后心肌Ca2+浓度明显升高,运动后各时相小组与运动前相比,均具非常显著性差异;其中,运动后6h时相组(B2组或C2组)比其他2个时相小组变化更为明显,具非常显著性差异;从大负荷运动后各时相小组的两两对应比较来看,运动预处理可明显减轻大负荷运动后Ca2+浓度的升高程度(表3、图7)。B组与C组大鼠大负荷运动后即刻(B1组、C1组)心肌ATP含量明显下降,与运动前相比具非常显著性差异;运动后6h(B2组、C2组)、运动后24h(B3组、C3组)表现出逐渐恢复的势态。从大负荷运动后各时相小组的两两对应比较来看,运动预处理对大负荷运动引起的ATP含量下降具一定预防作用(表3、图8)。
3.4 各组大鼠心肌细胞膜Na+-K+-ATPase、Ca2+-ATPase活性比较结果
B组与C组大鼠在大负荷运动后即刻(B1组、C1组)心肌细胞膜Na+-K+-ATPase、Ca2+-ATPase活性明显下降,与运动前相比具非常显著性差异;在运动后6h(B2组或C2组)均进一步下降,与运动后即刻相比具非常显著性差异;在运动后24h(B3组或C3组)有不同程度的恢复。从B组与C组运动后同时相小组的两两比较来看,运动预处理对大负荷运动引起的心肌细胞膜Na+-K+-ATPase、Ca2+-ATPase活性下降具一定预防作用(表4)。
表3 本研究各组大鼠心肌SOD活性、MDA含量、Ca2+浓度与ATP含量比较一览表(±S)Table 3 List of Comparison of Cardiac SOD,MDA,Ca2+and ATP Indicators in Each Group
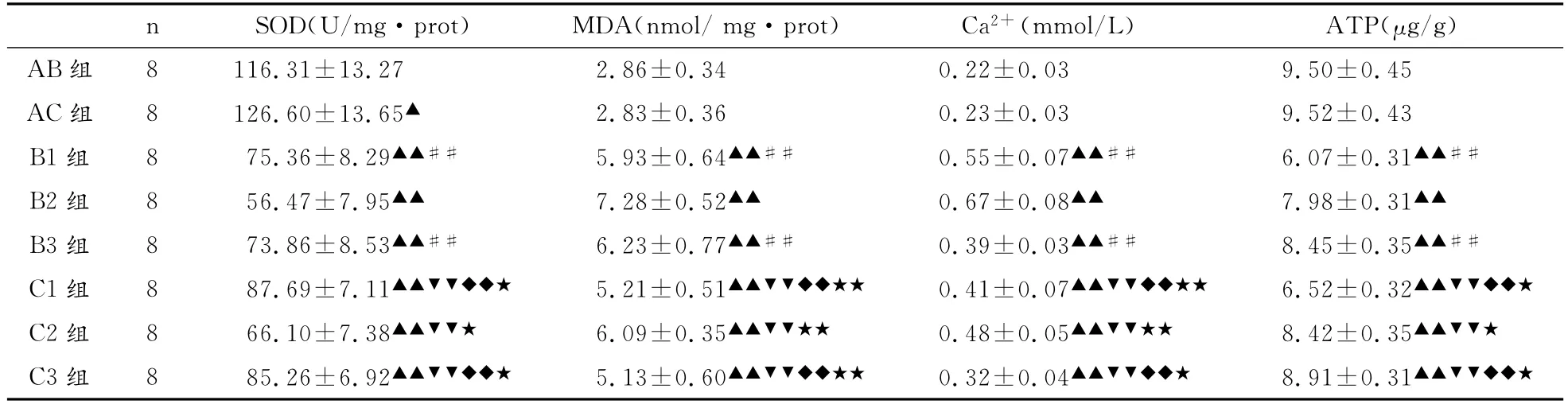
表3 本研究各组大鼠心肌SOD活性、MDA含量、Ca2+浓度与ATP含量比较一览表(±S)Table 3 List of Comparison of Cardiac SOD,MDA,Ca2+and ATP Indicators in Each Group
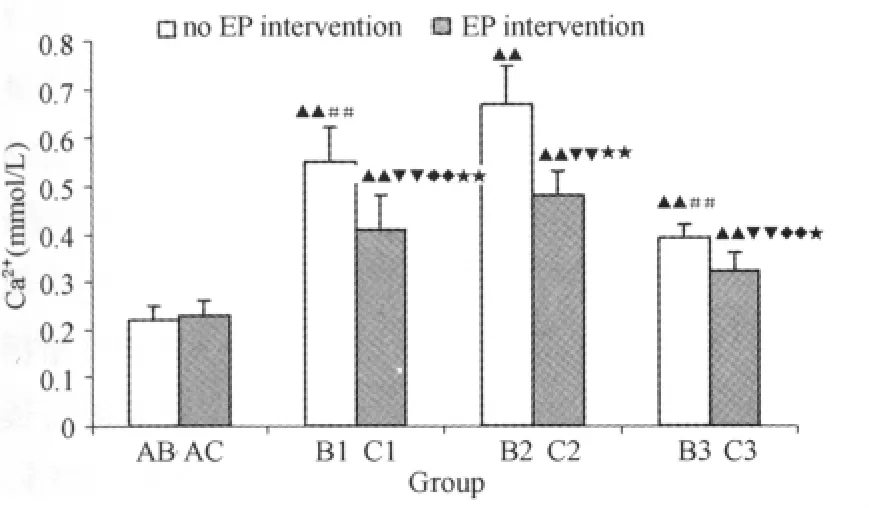
图7 本研究EP对大鼠大负荷运动后心肌Ca2+浓度影响示意图Figure 7. Effect on EP Myocardial Ca2+Index after Heavy Load Training in Rat
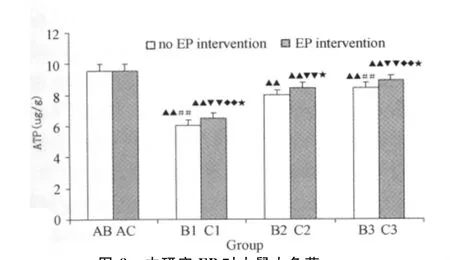
图8 本研究EP对大鼠大负荷运动后心肌ATP含量影响示意图Figure 8. Effect on EP Myocardial ATP Index after Heavy Load Training in Rat
表4 本研究各组大鼠心肌细胞膜指标比较一览表Table 4 Comparison of Myocardial Plasmalemmal Norm in Each Group (±S,umolPi/mgprot/h)
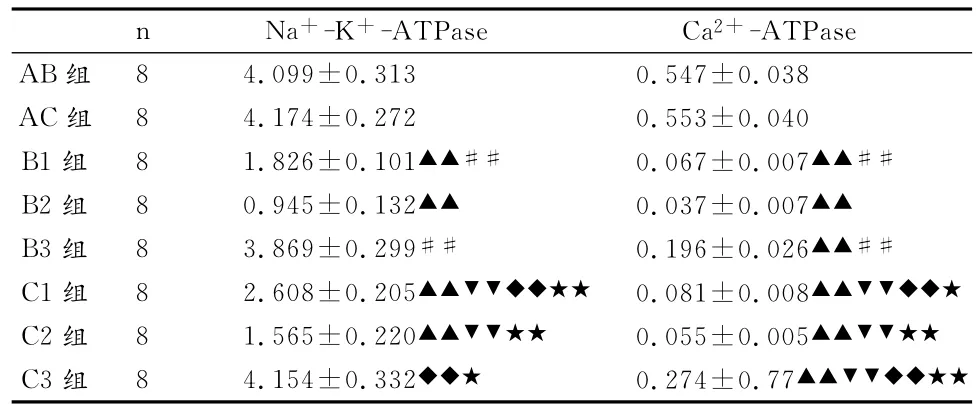
表4 本研究各组大鼠心肌细胞膜指标比较一览表Table 4 Comparison of Myocardial Plasmalemmal Norm in Each Group (±S,umolPi/mgprot/h)
4 讨论
4.1 运动预处理方案的讨论
临床上发现,心肌缺血可造成心肌损伤,然而,心肌在恢复供血过程中损伤进一步加剧,这种现象被称之为心肌缺血再灌注损伤。在对缺血性心肌病基础实验研究过程中发现,心肌在经过短暂缺血后能够增加其对缺血的耐受现象,称为缺血预处理(Rschemic Precondi-tioning,IPC)现象。然而,如何将IPC效应真正运用到临床实践上也是个不小的难题。随着对IPC深入研究,发现运动有类似IPC心脏保护效应,运动预处理(EP)的概念也被正式提出。近年来,一系列动物实验研究表明,耐力运动能抗心肌缺血再灌注损伤,而且各年龄段表现一致[16-18]。实际上,关于运动预处理的运动负荷尚没有明确,间歇性大强度运动、中等强度的适量运动都能抗心肌缺血再灌注损伤。在国内,有关运动预处理的研究尚处于摸索阶段。
动物在体、离体心脏实验均发现,大负荷运动可引起心肌缺血[3,6]。与病理性心肌缺血不同的是:运动引起机体各器官系统缺血,是在机体保护性抑制系统监控下发生的一个主动缺氧过程,当无法忍受缺氧刺激时,机体将通过降低运动强度或完全停止运动来减少缺血程度,从而避免因过度缺血缺氧导致结构功能的不可逆改变[4]。大量研究表明,大负荷运动引起的心肌损伤与病理性心肌缺血再灌注损伤极其相似。运动医学界就如何提高心肌对大负荷运动刺激的耐受性做了一些相关研究。有文献[10]指出,在高原或模拟高原环境进行运动训练以及运动前的热身(warm-up)等,很可能是因为心肌预缺血缺氧等因素所诱发的所谓EP现象,运动员便能持续进行较长时间、更剧烈的运动。本研究也发现,EP后大鼠进行大强度运动至不能再坚持运动时,运动所持续时间明显延长。张钧等[11]研究发现,8周中等负荷运动可降低大鼠心肌长时间剧烈运动后脂质过氧化水平,减少脂褐素的产生。郑兵等[12]研究发现,间歇性大强度运动能改善长时间剧烈运动后大鼠心肌抗氧化能力的下降、降低脂质过氧化水平及减少血清肌酸激酶的出现。这些是都是对EP的另一种诠释。
本研究在前人的研究基础上进行运动预处理方案的探索,基于健身角度的思考选择长期中等负荷运动作为EP方案。本实验中大鼠运动强度依据Bedford标准制定[15]。根据Bedford标准推算,本研究中体重227±17g的SD大鼠,在坡度为+10°、速度为20m/min的情况下进行跑台运动,运动强度约为80%最大耗氧量强度,属于大强度;B、C两种组大鼠最后以此强度进行一次性大负荷跑台运动,至不能再坚持运动时,分别持续了154±15min和166±21min,表明大鼠完成了大负荷运动。而本实验中大鼠在坡度为+5°、速度为15.2m/min的情况下进行EP跑台运动,运动强度约为65%最大耗氧量强度,为中等强度。最终,本实验中的长期中等负荷EP方案定为坡度为+5°、速度为15.2m/min的中等运动强度,60min/天、6天/周,共6周。
4.2 大负荷运动后血清心肌损伤指标变化及运动预处理对其干预作用
心肌型肌酸激酶(CK-MB)是由M和B亚基构成的杂化型二聚体,主要存在于心肌细胞的外浆层,是心肌酶谱中的特异性酶,血液CK-MB是诊断心肌梗死的敏感指标[22]。CK-MB曾一度被认为是诊断心肌损伤尤其是急性心肌梗死(AMI)的“金指标”,其出现时间较传统酶学时间要早,特异性和敏感度也相对较高。在我国,以往对人体的运动性心肌受损的检测指标还是血清CK-MB,但由于在其检测中会受到来自受损骨骼肌CK-MB的强烈干扰,以血清CK-MB浓度变化作为心肌受损的诊断依据受到一定程度的质疑。近年来,随着对心肌肌钙蛋白(Cardiac Troponin,cTn)的深入研究,发现cTn可以更敏感特异性的反应心肌损伤。心肌微小损伤时血清cTn浓度就明显升高。cTn正逐步取代CK-MB成为心肌损伤特别是AMI诊断的“金标准”。心肌肌钙蛋白(cTn)由心肌肌钙蛋白-T(Cardiac Troponin-T,cTnT)、心肌肌钙蛋白-I(Cardiac Troponin-I,cTnI)及心肌肌钙蛋白-C(Cardiac Troponin-C,cTnC)3种亚单位组成。无论是cTnT还是cTnI,心肌微小损伤后,在血清中都可以检测到明显变化;相比较而言,cTnI更能及时特异地反映出心肌的微损伤。Rifai等[28]发现,铁人三项运动能引起人体血液cTnT、cTnI浓度升高。佘军标等[5]发现,田径运动员其血液CK-MB浓度在长时间大强度运动后明显升高。而在动物实验方面,已有大量研究表明,运动引起机体心肌细胞超微结构损伤及血液cTnT与cTnI、CK-MB浓度升高等。有研究表明,大负荷运动后大鼠心肌cTnI浓度在运动后即刻明显升高,在运动后最初一段时间内进一步升高,但在运动后24h已有明显恢复[8]。Scharhag等[29]总结指出:运动,尤其是长时间大强度运动引起的血液cTnT、cTnI浓度升高已有很多文献报道,但不论是人体实验还是动物实验,由运动引起的血液cTnT、cTnI浓度升高现象在运动后24~48h后消失。
本实验结果发现,无论是单纯力竭运动组(B组)、还是运动预处理+力竭运动组(C组)大鼠,大负荷运动后即刻血清cTnI与CK-MB浓度明显升高,且在运动后6h时进一步升高,而在运动后24h明显得到恢复。这表明本实验中的大负荷跑台运动引起大鼠心肌损伤:在运动后即刻就已损伤,而在运动后最初一段时间内损伤加重,但在运动后24h时已处于恢复过程中。从B组、C组大鼠大负荷运动后即刻、6h、24h时的血清cTnI、CK-MB指标升高程度比较来看,C组升高程度明显要低,表明运动预处理对大负荷运动引起的心肌损伤具有一定的保护作用。
4.3 运动预处理提高的心肌SOD活性与大负荷运动引起的心肌损伤保护
正常情况下,体内自由基水平取决于自由基生成与清除之间的动态平衡。清除自由基的酶促防御系统包括超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶、过氧化氢酶等,能有效清除体内活性氧并终止自由基链式反应过程。SOD的主要功能是催化超氧阴离子的歧化反应,而超氧阴离子是体内活性氧生成过程中初始产物。因此,SOD被看作是活性氧防御的第一线屏障。丙二醛(MDA)是活性氧终极代谢产物,也是衡量自由基水平的敏感指标。
机体组织中SOD活性下降可导致自由基生成增多,过氧化反应加剧及其产物MDA含量增加。国内、外有关研究表明,运动性心肌损伤与SOD活性下降、自由基水平升高有关[8,33]。自由基具有极其活泼的化学性质,能与各种细胞成份(膜磷脂、蛋白质、核酸)发生反应,使心肌细胞发生致命性损伤[1,14,23]。自由基损伤生物膜,使膜的结构、流动性及通透性发生改变,致使细胞膜上酶(包括其他蛋白)的功能出现障碍。氧自由基和脂质过氧化物可攻击蛋白质,引起蛋白质分子聚合与肽链断裂、蛋白质变性和功能丧失及酶失活。研究发现,大鼠大负荷运动也引起了心肌细胞膜Na+-K+-ATPase、Ca2+-ATPase活性下降[7]。本实验结果与其相一致。细胞膜通透性改变可使膜对Ca2+的通透性增高,Ca2+顺浓度梯度流入增多;细胞膜Na+-K+-ATPase活性下降通过Na+/Ca2+交换机制使得Ca2+大量进入细胞内[20,30];细胞膜Ca2+-ATPase活性下降,不能有效地将细胞浆内多余的钙离子泵出细胞外。最终,细胞内Ca2+浓度升高。Ca2+浓度升高使Ca2+和钙调蛋白结合增多,由此激活多种钙依赖性降解酶,如磷脂酶、蛋白水解酶、核酸内切酶等,引起生物膜、细胞骨架和核酸分解,导致细胞坏死[1]。钙依赖性降解酶(蛋白水解酶)激活可降解心肌收缩蛋白,cTnI发生修饰,包括蛋白分解与降解、与其他肌钙蛋白的交叉连接等[24,25,31]。大负荷运动引起的心肌cTnI升高与钙超载有关[8]。此外,自由基通过直接损伤线粒体及参与形成钙超载而损伤线粒体,致使线粒体合成ATP的能力下降,ATP生成不足。ATP缺乏可通过参与钙超载形成而损伤心肌:ATP缺乏使不同阶段心脏依赖能量的Ca2+隔室化机制反应降低,使Ca2+内流增加,细胞浆内Ca2+增多激活膜磷酶,使膜磷脂降解为溶血磷脂,导致缺血性肌挛缩,并在此过程中产生自由基,进一步产生损害作用[2];ATP缺乏引起的心肌细胞膜Na+-K+-ATPase、Ca2+-ATPase活性下降加重了细胞内钙超载,损伤心肌。最近有观点认为,能量代谢障碍可造成心肌细胞基因结构及表达的异常,细胞内的ATP水平是决定细胞发生凋亡或坏死的主要因素[26]。
综上所述,自由基对心肌的危害主要体现在三方面:一是,直接损伤心肌细胞各种成份;二是,参与形成钙超载而损伤心肌;三是,导致ATP合成障碍。本实验结果显示,大负荷运动后即刻大鼠心肌就已损伤,此时心肌SOD活性明显下降及MDA含量明显升高、Ca2+浓度明显升高、ATP含量明显下降,心肌细胞膜Na+-K+-ATPase、Ca2+-ATPase活性明显下降;运动后6h时心肌损伤较运动后即刻加重,此时心肌SOD活性及MDA含量、Ca2+浓度的异常变化又较运动后即刻进一步加剧,ATP含量有所恢复但仍处于较低水平,心肌细胞膜Na+-K+-ATPase、Ca2+-ATPase活性也进一步下降;运动后24h心肌损伤已有明显恢复,此时心肌SOD活性与MDA含量、Ca2+浓度及心肌细胞膜Na+-K+-ATPase、Ca2+-ATPase活性的异常变化均有不同程度恢复,ATP含量也进一步得到恢复。根据本实验结果,结合心肌缺血再灌注损伤的病理生理学研究观点,可以认为:自由基、Ca2+水平升高及ATP缺乏在大负荷运动引起的心肌损伤中起到重要作用,而在运动后最初一段时间内主要是由于自由基、Ca2+水平进一步升高而加重了心肌损伤;抗氧化酶SOD活性下降是导致自由基水平升高的重要原因;自由基的损伤作用及ATP缺乏引起心肌细胞膜Na+-K+-ATPase、Ca2+-ATPase活性下降,而在运动后最初一段时间内主要是由于自由基水平进一步升高而导致了细胞膜Na+-K+-ATPase、Ca2+-ATPase活性进一步下降;心肌细胞膜Na+-K+-ATPase、Ca2+-ATPase活性下降导致心肌钙超载。病理生理学的观点认为,组织在缺血再灌注过程中,自由基生成、钙超载以及ATP缺乏相互促进[1]。改善自由基代谢、钙代谢及能量代谢中的任一环节,都有可能保护大负荷运动引起的心肌损伤。Powers等[27]研究发现,运动训练使大鼠Mn-SOD和Cu,Zn-SOD活性显著增加,指出运动引起SOD活性升高是解释运动训练引起心脏保护作用的一个可能机制。张敏等[13]研究表明,运动预处理能提高大鼠心肌Cu,Zn-SOD基因的表达。本实验中运动预处理提高了心肌SOD活性。从本实验中B组、C组大鼠大负荷运动后各时相心肌MDA、Ca2+、ATP及细胞膜Na+-K+-ATPase、Ca2+-ATPase指标变化的对应比较情况来看,运动预处理改善了大负荷运动引起的这些指标异常变化。这可能是由于提高的SOD活性减少了大负荷运动后自由基的生成;通过减少自由基生成,继而改善了能量代谢、减少细胞膜Na+-K+-ATPase、Ca2+-ATPase损伤,并以此减轻了钙超载程度。通过上述连锁效应,运动预处理提高的SOD活性发挥抗大负荷运动引起心肌损伤的作用。
5 结论
1.根据反映心肌损伤的血清cTnI、CK-MB指标变化来看,大负荷跑台运动引起大鼠心肌损伤,表现为运动后即刻就已损伤,在运动后恢复期反而加重,但在运动后24 h时已处于恢复过程中。
2.运动预处理能减轻大鼠大负荷跑台运动引起的血清cTnI、CK-MB浓度升高程度,表明运动预处理对大负荷运动引起的心肌损伤具保护作用。
3.心肌自由基、Ca2+水平升高及ATP缺乏在大负荷运动引起的心肌损伤中起到重要作用,而在运动后最初一段时间内主要是由于自由基、Ca2+水平进一步升高加重了心肌损伤。心肌抗氧化酶SOD活性下降是导致心肌自由基水平升高的重要原因,运动预处理提高了心肌SOD活性,从而减少了大负荷运动后自由基的生成;通过减少自由基生成,继而改善了能量代谢、减少细胞膜Na+-K+-ATPase、Ca2+-ATPase损伤,并以此减轻钙超载程度。通过上述连锁效应,运动预处理提高的SOD活性发挥抗大负荷运动引起心肌损伤的作用。
[1]陈国强,冉丕鑫.基础病理生理学[M].上海:上海科学技术出版社,2009:212-301.
[2]谷天祥,张显清,谷春久,等.心肌缺血再灌注损伤亚细胞Ca2+反常与ATP酶泵功能抑制[J].中华心血管病杂志,2001,29(7):420-423.
[3]李新建,张钢林,邢少东,等.超速驱动诱发大鼠离体心脏心肌顿抑的研究[J].成都体育学院学报,2010,36(4):73-77.
[4]苏全生.运动后复氧对心脏结构功能的影响[J].成都体育学院学报,2004,30(3):61-64.
[5]佘军标,李协群,廖代容.田径运动员肌酸激酶及其同工酶变化与运动能力的关系[J].现代康复,2003,7(3):119.
[6]陶小平,苏全生,邹斌,等.运动诱发大鼠在体心脏心肌顿抑现象的研究[J].成都体育学院学报,2011,37(8):83-87.
[7]许思毛,刘涛波,苏全生.大负荷运动对大鼠心肌细胞膜钠钾泵、钙泵与肌浆网钙泵活性的影响[J].体育科学,2010,30(12):82-86.
[8]许思毛,刘涛波,苏全生.大负荷运动引起的大鼠心肌收缩力变化及其与心肌自由基、钙离子水平的关系[J].体育科学,2011,31(7):73-77.
[9]朱卫中.间歇性高原低氧抗心肌缺血再灌注损伤的线粒体机制研究[D].中国科学院研究生院博士学位论文,2005.
[10]张梅,何叶.不同强度运动训练对大鼠海马CA1区神经元凋亡的影响[J].山东体育学院学报,2006,22(6):151-153.
[11]张钧,郭勇力,黄叔怀.运动训练对大鼠大脑心肌脂褐素含量及自由基代谢的影响[J].山东体育学院学报,1998,14(4):49-52.
[12]郑兵,苏全生,熊若虹,等.间歇训练对负荷游泳力竭运动后即刻及恢复期大鼠心肌脂质过氧化及钙离子代谢的影响[J].成都体育学院学报,2007,33(5):92-95,109.
[13]张敏,浦钧宗,朱全.运动预处理对大鼠心肌CuZn-SOD基因表达的影响[J].中国运动医学杂志,2001,20(3):239-240.
[14]ASANO G,TAKASHI E,ISHIWATA T,et al.Pathogenesis and protection of ischemia and reperfusion injury in myocardium[J].J Nippon Med Sch,2003,70(5):384-392.
[15]BEADFORD T G,TIPTON C M,WILSON N C.Maximum oxygen consumption of rats and its changes with various experimental procedures[J].J Appl Physiol:Respirat Environ Exe Physiol,1979,47(6):1278-1283.
[16]BROWN D A,CHICCO A J,JEW K N,et al.Cardioprotection afforded by chronic exercise is mediated by the sarcolemmal,and not the mitochondrial,isoform of the KATPchannel in the rat[J].J Physiol,2005,569(pt3):913-924.
[17]DEMIRL,HAYDAR A,POWERS,et al.Short-term exercise improves myocardial tolerance to in vivo ischemia-reperfusion in the rat[J].J Appl Physiol,2001,91(5):2205-2212.
[18]FRENCH J P,QUINDRY J C,FALK D J,et al.Iischemiareperfusion-induced calpain activation and SERCA2adegradation are attenuated by exercise training and calpain inhibition[J].Am J Physiol Heart Circ Physiol,2006,290(1):H128-H136.
[19]HARRRS AL.Hpoxia-A key regulatory factor in tumor growth[J].Nat Rev Cancer,2002,2(1):38-47.
[20]HAMISON W R,MERTIS C F,LRATHERS C R.Evidence of collidividomycosis in the skeleton of an ancient India[J].Circ Res,1997,68:1446-1457.
[21]LIN W T,YANG S C,TSAI S C.L-Arginine attenuates xanthine oxidase and myeloperoxidase acivities in hearts of rats during exhaustive exercise[J].Brit J Nutr,2006,95(4):67-75.
[22]LIN J C,APPLE F S,MURAKAMI M M,et al.Rats of postive cardiac troponin I and creatine kinase MB mass among patiens hospitalized for suspected acute coronary syndromes[J].Clin Chem,2004,50(2):333-338.
[23]MACFARLANE N G,MILLER D J.Effects of the reactive oxygen species hypochlorous acid hydrogen peroxide on force production and calcium senstitivity of rat cardiac myofilaments[J].Pflugers Arch,1994,42(8):561-568.
[24]MCDONOUGH J L,ARRELL D K,VANEYK J E.Troponin I degradation and covalent complex formation accompanies myocardial ischemia/reperfusion injury[J].Circ Res,1999,84(1):9-20.
[25]MAEKAWA A,LEE J K,NAGAYA T,et al.Overexpression of calpastatin by gene transfer prevents troponin I degradation and ameliorates contractile dysfunction in rat hearts subjected to ischemia/reperfusior[J].J Mol Cell Cardiol,2003,35(10):1277.
[26]NORDLIE M A,WOLD L E,SIMKHOVICH B Z,et al.Molecular aspects of ischemic heart disease:ischemia/reperfusion-induced genetic changes and potential applications of gene and RNA interference therapy[J].J Cardiovasc Pharmacol Ther,2006,11(1):17-30.
[27]POWERS S K,DE IREL H D,VINCENT H K,et al.Exercise training improves myocardial to lerance to in vivo ischemiareperfusion in the rat[J].Am J Physiol Regul Integr Comp Physiol,1998,275:R1468-1477.
[28]RIFAI N,DOUGLAS P S.Cardiac troponin T and I,echocardiographic[correction of electrocardiographic]wall motion analyses,and ejection fractions in athletes participating in the hawaii ironman triathlon[J].Am J Cardiol,1999,83(7):1085-1089.
[29]SCHARHAG J,GEORGE K,SHAVE R,et al.Exercise-associated increases in cardiac biomarkers[J].Med Sci Sports Exe,2008,40:1408-1415.
[30]SCARABELLI T M,KNIGHT R,STEPHANOU A,et al.Clinical imp lications of apoptosis in ischemic myocardium[J].Curr Probl Cardiol,2006,31(3):181-264.
[31]SCHWARTZ S M,DUFFY J Y,PEARL J M,et al.Glucocorticoids preserve calpastatin and troponin I during cardiopulmonary bypass in immature pigs[J].Pediatr Res,2003,54(1):91.
[32]YAMASHITA N,HOSHIDA,OTUS K,et al.Execise provides direct biphasic cardioprotection via manganese superoxide dismutase activation[J].J Exp Mde,1999,189(11):1699-1706.
[33]ZOPPI C C,MACEDO D V.Overreaching-induced oxidative stress,enhanced HSP72expression,antioxi-dant and oxidative enzymes down regulation[J].Scand J Med Sci Sports,2008,18(2):67-76.
Protection Effect and Its Mechanism of Exercise Preconditioning on Myocardial Iniury-Induced by Heavy Load Treadmill Training in Rat
XU Si-mao1,SHANG Guan Ruo-nan2,PENG Feng-lin1,SU Quan-sheng2
Objective:To make clear the basic characteristics of myocardial iniury-induced by heavy load training,and explore the protective effect and its mechanism of exercise preconditioning(EP)on it.Methods:Sixty-four grown male SD rats were randomly divided into control group(group AB),exercise preconditioning control group(group AC),heavy load training group,heavy load training after exercise preconditioning group(group C).According to instantly,6hour and 24hour after heavy load training,group B were randomly divided into group B1,group B2,group B3and group C were randomly divided into group C1,group C2,group C3.Rats in group AC,group C had took part in medium load treadmill training for 6 weeks.Rats in group C took part in a heavy load treadmill training at 48hour after medium load treadmill training with group B.All groups index of serum cardiac troponin-I(cTnI),creatine kinase rsoenzyme(CK-MB),and cardiac superoxide dismutase(SOD),malondialdehyde(MDA)and Ca2+were be test.High performance liquid chromatography(HPLC)text adenosine triphosphate(ATP).Myocardial cellular membrane Na+-K+-ATPase,Ca2+-ATPase activity were also be test.Results:Heavy load training caused serum cTnI and CK-MB concentration were significant higher,and caused cardiac SOD activity was significant lower,cardiac MDA quantitative,Ca2+concentration were significant higher,ATP quantitative was significant higher,myocardial cellular membrane Na+-K+-ATPase,Ca2+-ATPase activity were significant lower.Conclusion:EP has protective effect on myocardial iniury induced by heavy load training.Higher SOD activity induced by EP causes chain reaction after heavy load training,therefore play against myocardial iniury.
exercisepreconditioning;heavyloadtraining;myocardialiniury;protection;rat;animalexperiment
G804.2
A
1000-677X(2012)07-0045-08
2012-04-16;
2012-06-23
国家自然科学基金资助项目(C31060146/C1106);四川省科技厅项目(2009J00001)。
许思毛(1978-),男,安徽芜湖人,讲师,硕士,主要研究方向为运动生理学和体育保健学,Tel:(0773)5845941,E-mail:xusimao666@163.com。
1.广西师范大学体育学院,广西桂林541004;2.成都体育学院,四川成都610041 1.Department of Physical Education,Guangxi Normal University,Guilin 541004,China;2.Chengdu Sport University,Chengdu 610041,China.

