运动预适应晚期保护效应中大鼠心肌组织εPKC的表达变化
郝 喆,潘珊珊
运动预适应晚期保护效应中大鼠心肌组织εPKC的表达变化
郝 喆,潘珊珊
目的:探讨运动预适应(EP)对力竭所致心肌损伤的晚期保护效应中心肌εPKC表达变化。方法:SD大鼠分为对照组(C组)、力竭运动组(EE组)、晚期运动预适应组(LEP组)、晚期运动预适应+力竭运动组(LEP+EE组)。在EP模型基础上,用力竭跑台运动致大鼠心肌损伤。用免疫化学发光法检测血清cTnI的含量;用免疫印迹法与免疫组织化学法检测心肌εPKC定量与定位表达变化。结果:与C组比,EE组血清cTnI水平、εPKC蛋白水平显著升高,免疫反应阳性于心肌闰盘聚集;LEP组血清cTnI无明显变化,εPKC蛋白水平显著升高,免疫反应阳性于心肌闰盘聚集。与EE组比,LEP+EE组血清cTnI水平显著下降,蛋白水平无明显变化,免疫反应阳性未在心肌闰盘聚集。结论:εPKC参与了EP对力竭运动致心肌损伤的晚期保护效应。
εPKC;运动预适应;晚期心肌保护效应;力竭运动;心肌损伤;鼠;动物实验
心肌缺血再灌注(ischemia/reperfusion,I/R)是引发心肌损伤的主要原因之一,缺血预适应(ischemic preconditioning,IP)[20]可减轻心肌I/R损伤的报道已屡见不鲜。近年,运动医学界研究者发现,运动可诱发机体产生强大的保护效应,在一定程度上减轻心肌I/R损伤,这种一次短时间大强度的间歇运动诱导机体产生保护效应的现象称为运动预适应(exercise preconditioning,EP)[1,4,5,11,25,32,33]。EP的保护效应分为早期和晚期[5,11],由于EP晚期保护效应的持续时间较长,在心肌保护方面的应用价值而备受国内外学者的关注。目前,EP晚期保护效应已被许多研究证实,但EP对力竭运动致急性心肌损伤晚期保护效应期的研究鲜有报道。而有关EP诱导心肌产生保护效应的机制目前尚未阐明,有研究表明,EP诱导心肌保护效应的细胞信号转导途径可能与IP类似,分为触发物质、中介物质、效应物质3个环节[2,3]。在对IP机制的研究中发现,PKC作为信号转导过程中重要的中介物质,在IP中调控了下游的众多的效应蛋白,改变ATP敏感钾离子通道的活性[3,10]及相关蛋白酶活性,诱导应激蛋白生成,发挥对心脏的保护效应[15]。迄今,已发现的PKC亚型至少有13种,但PKC各亚型的细胞信号转导途径各不相同。PKC亚型εPKC作为介导IP晚期心肌保护效应的关键中介物质[16],在EP诱导的减轻力竭运动致急性心肌损伤的晚期保护效应中的表达变化如何?尚待进一步探讨。因此,本实验在EP动物模型的基础上,用力竭运动致大鼠急性心肌损伤,采用血清cTnI的检测评价EP晚期效应期对力竭运动致急性心肌损伤的保护效应;同时,采用免疫印迹法与免疫组织化学法检测心肌εPKC的蛋白水平,重点观察εPKC在EP晚期保护效应中的变化,探讨心肌εPKC参与介导EP晚期保护效应的机制,为EP心肌保护效应与机制的研究提供新的实验与理论依据。
1 材料与方法
1.1 实验对象与分组
健康雄性Sprague-Dawley大鼠100只,体重256±13g(购自上海西普尔-必凯实验动物有限公司)。大鼠常规分笼饲养,5只/笼,均以标准啮齿类动物饲料饲养(购自第二军医大学实验动物中心),自由饮食。室温20℃~22℃,相对湿度45%~50%。大鼠适应性喂养一周,期间进行3天速度15m/min、时间10min,坡度为0°的跑台适应性训练,用以筛除不能适应跑台的大鼠。将剩余大鼠随机分为对照组(control group,C组)、力竭运动组(exhaustive exercise group,EE组)、晚期运动预适应组(late exercise preconditioning group,LEP组)、晚期运动预适应+力竭运动组(late exercise preconditioning+exhaustive exercise group,LEP+EE组)。
1.2 EP模型的建立
本实验参考本课题组以往的实验运动方案[1-5,32]建立EP动物模型。LEP组大鼠进行一次速度为30m/min(相当于75%O2max),运动10min,休息10min,坡度为0°,重复4次的间歇运动建立EP模型。在EP前,进行适应性训练5min,速度从15m/min逐渐增加到30m/min,EP结束后5min内速度由30m/min逐渐减至15m/min后终止。
1.3 力竭致心肌损伤的方案
EE组大鼠进行一次力竭运动,开始速度为15m/min,在5min中之内逐渐升高至30m/min,而后维持该运动强度直至大鼠力竭。LEP+EE组在进行EP后24h进行力竭运动。
1.4 动物取材
大鼠10%水合氯醛(40mg/100g体重)腹腔注射麻醉后,呈仰卧位固定于手术台上,于剑突下横切口打开腹腔,下腔静脉取血5ml,静置15~30min,3 000rpm离心15min,取血清,-4℃保存,用于血清cTnI含量的测定。每组随机抽取10只大鼠打开胸腔,暴露心脏,从心尖插入灌注针头,快速滴注0.85%生理盐水250~300ml,期间迅速剪断下腔静脉使血液流出,同时缓慢注入2ml 1%肝素,待流出液基本无血色后,换4%多聚甲醛溶液250~300ml快速滴注,整个滴注时间约在30min内完成。取出心脏,放置4%多聚甲醛溶液中后固定24h,常规梯度酒精脱水、二甲苯透明、浸蜡、石蜡包埋,用于心肌εPKC免疫化学实验。其余大鼠迅速开胸取心,生理盐水漂洗后置于液氮保存待用,用于心肌εPKC免疫印迹实验。
1.5 血清cTnI含量的免疫化学发光法测定
应用免疫化学发光发测定血清cTnI含量。该法应用双抗体一步夹心免疫酶分析法,以单克隆抗cTnI IgG抗体包被的磁性微粒作为捕获试剂,用连接MAb的碱性磷酸酶检测结合的cTnI,未结合的抗体则被洗去,随后加入化学发功底物,产生的信号直接与结合cTnI量成比例。仪器为Beckman coulter公司的Access 2immunoassay system(全自动化学发光免疫测定系统),试剂由仪器生产厂家配套提供。
1.6 心肌组织εPKC免疫印迹实验
采用western blot方法。心肌组织4℃解冻,冰浴下剪碎放入EP管中,加入预冷蛋白抽提试剂低温匀浆,低温离心机14 000xg,离心15min收集上清。采用BCA(bicinchonininc acid)法测定蛋白浓度。4℃SDS-PAGE电泳,样品首先于80V恒定电压下电泳至染料接近分离胶顶端,后用120V恒定电压电泳,直至溴酚蓝刚出胶底部,转移至PVDF膜上(4℃200mA恒定电流下2h)。5%BSA溶液中室温孵育1h,加入εPKC一抗(鼠抗人1∶3 000,美国Santa Cruz公司),4℃过夜,TBST洗膜3次,加入HRP标记的二抗(兔抗鼠IgG,1∶5 000),室温孵育膜1h,TBST洗膜后加入化学底物发光,用X光胶片曝光,图片扫描,采用Image J分析软件测定每一样品特异性条带及对应的GAPDH条带灰度值。按相对灰度值=εPKC蛋白灰度值/GAPDH灰度值计算样品的相对灰度值,代表εPKC蛋白水平变化。
1.7 心肌组织εPKC免疫组织化学实验
采用免疫组织化学SABC法进行εPKC免疫组织化学检测。制作常规石蜡切片,切片脱蜡至水;3%过氧化氢室温10min;滴加复合消化液5min;室温血清封闭20min;滴加一抗(兔抗人1∶50,美国Santa Cruz公司)4℃湿盒内孵育过夜;滴加生物素标记的二抗(羊抗兔IgG,武汉博士德公司)37℃湿盒孵育20min;滴加SABC试剂37℃湿盒内孵育20min;DAB室温显色;苏木精复染;常规脱水透明封片;用PBS代替一抗,并以相邻切片做阴性对照;反应结果在Olympus显微镜下观察,拍摄照片。将各组心肌组织εPKC免疫反应切片随机抽选5张,每张切片在光镜下随机选5个视野,每组共25个视野。在计算机图像分析系统下经行图像采集,采用Image-Pro Plus 4.1图像分析软件处理,测量εPKC免疫反应阳性表达面积与积分光密度(integrated optical density,IOD)。所得数据输入计算机统计分析,组间比较采用单因素方差分析。
1.8 数据统计分析
实验数据由SPSS 16.0软件处理,结果以均数±标准差±SD)表示,组间比较采用One-way ANOVA检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 大鼠血清cTnI免疫化学发光法测定
与C组相比,EE组血清cTnI水平明显升高,差异具有显著性(P<0.05);与EE组相比,LEP+EE组血清cT-nI水平明显下降,差异具有显著性(P<0.05;表1)。
2.2 大鼠心肌组织εPKC免疫印迹实验
各组大鼠心肌εPKC western blot检测结果显示,与C组相比,EE组、LEP组蛋白水平明显升高,差异具有显著性(0.98±0.34、0.87±0.31vs.0.64±0.08,P<0.05);与EE组相比,LEP+EE组蛋白水平略微升高,但差异不具有统计学意义(1.05±0.07vs.0.98±0.34,P>0.05;图1)。
2.3 大鼠心肌组织εPKC免疫组织化学观察
染色结果观察可见εPKC免疫反应阳性呈棕黄色,经苏木精复染后,细胞核被染成淡蓝色,心肌细胞间质及其他细胞成分不着色。C组心肌细胞εPKC免疫反应阳性点状颗粒散在分布于胞浆内,免疫反应阳性颗粒稀疏(图2-A),而用PBS代替一抗的相邻切片阴性对照心肌细胞胞浆中没有出现免疫反应阳性结果;EE组、LEP组心肌细胞εPKC免疫反应阳性较C组明显增强,免疫反应阳性颗粒聚集呈大颗粒状或呈线状分布于心肌细胞闰盘处,免疫染色明显加深(图2-B、图2-D);LEP+EE组心肌细胞εPKC免疫反应阳性较EE组明显减弱,免疫反应阳性颗粒呈点状散在分布于胞浆中或细微颗粒弥散性分布于细胞胞浆中,免疫染色较浅(图2-C)。
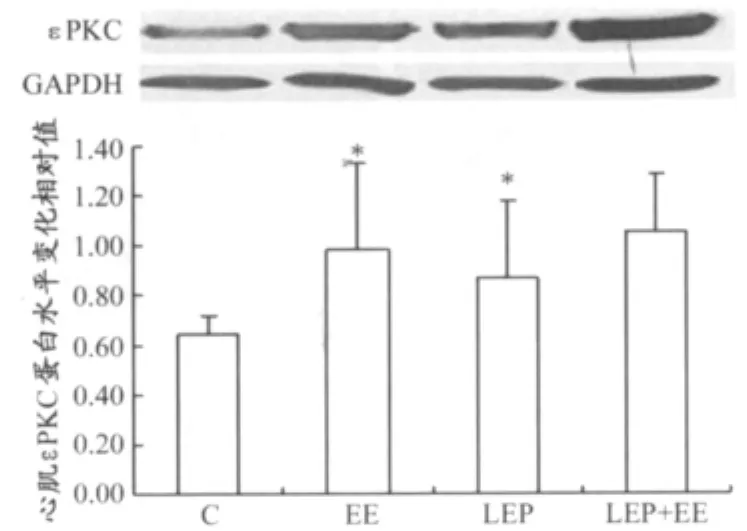
图1 大鼠心肌组织εPKC蛋白水平的变化示意图Figure 1. Changes of MyocardiumεPKC Expressions in Rats
εPKC免疫反应表达图像分析结果显示,与C组相比,EE组与LEP组免疫反应阳性面积明显增加,IOD明显升高,差异具有显著性(P<0.05);与EE组相比,LEP+EE组阳性面积明显减少,IOD明显降低,差异具有显著性(P<0.05;表2)。
3 讨论
3.1 运动预适应晚期心肌保护效应
EP对心脏的晚期保护效应已被不少研究证实。Yamashita等[33]对大鼠进行一次跑速为23~27m/min,持续时间为30min的跑台运动诱导EP晚期心肌保护效应,发现一次短暂的大强度运动可以提高心肌对缺血再灌注的损伤的耐受力,心肌梗塞面积明显减少。Domench等[11]、Parra等[25]在犬的实验中用一次速度为6km/h,持续时间为5min,间隔5min重复5次的间歇跑台运动24h后结扎冠状动脉,心肌梗死面积较对照组分别减小46%与56%,提示,运动可诱导EP晚期保护效应的产生并减少冠状动脉结扎造成的心肌梗死面积。本课题组[1,32]前期研究中也发现,对大鼠进行一次跑速为28~30m/min,运动时间10min,休息10min,间隔训练4次的跑台运动诱导晚期运动预适应效应,通过cTnI指标检测与HBFP染色图像处理后发现,运动可诱导心肌的晚期预适应保护作用,减轻异丙肾上腺素所致心肌损伤。目前国内、外关于EP晚期的研究中大多用结扎冠状动脉造成心肌缺血缺氧后灌注或以药物手段模拟急性心肌缺血缺氧以探讨EP晚期对心肌的保护效应与机制,采用力竭造成运动损伤以探讨EP晚期对心肌的保护作用的研究十分稀少。本实验在EP 24h后对大鼠进行一次速度为30m/min(相当于75%O2max),坡度为0°的力竭运动,探讨EP是否在力竭运动中发挥其晚期心肌保护效应。
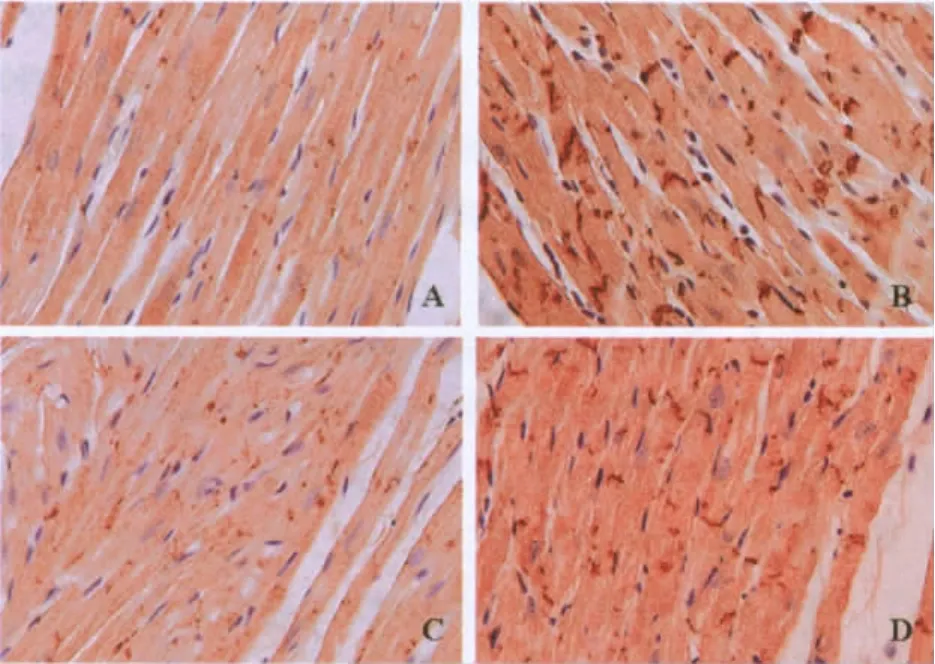
图2 大鼠心肌组织εPKC免疫反应结果(×400)Figure 2. Immunoreaction Results ofεPKC in Rat Myocardium(×400)

表2 本研究大鼠心肌组织εPKC免疫反应图像分析结果一览表Table2εPKC Immunoreaction Image Analysis Results in Myocardium
本实验采用血清cTnI评价心肌损伤程度。心肌肌钙蛋白(cardiac Troponin,cTn)是心肌肌原纤维中细肌丝上的收缩调节蛋白,其3个亚基为cTnT、cTnC、cTnI。cTn少数分布于心肌细胞胞浆中,多数与肌球蛋白结合固定存在于心肌纤维上,当心肌细胞受损或细胞膜破损时,其胞质内游离的cTn可迅速地由心肌细胞透出进入血液循环,血清cTn少量、暂时升高,伴随心肌损伤加重,结合在心肌纤维上的cTn被降解并不断地释放到血液当中,血清cTn浓度持续升高[30]。cTn亚基cTnI对心肌损伤具有高度的特异性与灵敏性,常用来评价心肌损伤。国内、外均有采用血清cTnI评价运动性心肌损伤的报道。Shave等[31]研究健康男性进行一次大强度的剧烈运动,在运动前、运动中、运动30min后检测血清cTnI的水平变化发现,在运动过程中,50%以上的男性血清cTnI有所升高,25%的男性血清cTnI在运动后3~4h显著升高,表明了大强度的剧烈运动可能导致心肌损伤。本课题组前期研究也采用血清cTnI来评价运动性心肌损伤,通过血清cTnI指标检测后发现,运动可诱导心肌的晚期预适应效应,减轻异丙肾上腺素与力竭运动所致心肌损伤[1,5,32],表明血清cTnI可以作为评价运动性心肌损伤的标准。本次实验结果显示,与C组相比,LEP组大鼠血清cTnI水平未发生变化,提示,EP没有造成大鼠急性心肌损伤;而EE组大鼠血清水平显著升高,提示,一次大强度的力竭运动造成了大鼠心肌急性损伤。与EE组相比,LEP+EE组的大鼠血清cTnI水平明显降低,提示,EP对急性心肌缺血损伤具有晚期保护作用,可以明显减轻力竭运动导致的急性心肌缺血损伤的程度。
3.2 心肌εPKC生物学概述
蛋白激酶C(protein kinase C,PKC)是由Nishizuka等人于1977年首次发现的一组磷脂依赖性Ca2+激活的蛋白丝氨酸/苏氨酸激酶,由相对分子质量为77~83KD的单一多肽单链构成[35]。目前,在生物体细胞中已至少发现PKC的13种亚型。在IP研究中主要着重于α、δ、ε、η、θPKC等亚型。εPKC属于nPKC中的一员,其在细胞生长、分化、凋亡、转化等多种细胞信号转导途径中均发挥着重要作用[6,13]。
安静状态下,PKC在细胞胞浆中无活性,活化时,PKC磷酸化后从胞质转位到细胞胞膜与线粒体并被激活[22]。在IP机制研究中发现,εPKC在IP保护效应中的作用尤为重要,εPKC通过磷酸化其下游的众多效应蛋白如KATP敏感性钾离子通道(sarcolemmal KATPchannels,sarc KATP)与线粒体KATP敏感钾通道(mitochondrial KATP,mito KATP)的开放,减轻细胞肿胀,减少细胞能量消耗[24]。具体为反复短暂的缺血再灌注引发线粒体大量释放ROS,ROS堆积触发腺苷的释放,从而激活G蛋白偶联受体-PLC-DAG-εPKC信号转导通路,活化后的εPKC转位并促使线粒体KATP通道与肌浆网L型Ca2+通道的开放,维持细胞内环境稳定从而发挥心肌保护作用[15]。εPKC在IP中也可通过抑制线粒体膜通透性转换孔(mitochondrial permeability transition pore,MPTP)的开放、增加εPKC与缝隙连接蛋白(connexin-43,Cx43)的复合体,降低心肌缝隙连接蛋白的通透性[7,21,34],诱导心肌保护效应。PKC家族成员的活性与其在细胞内的转位都受PKC自身在可催化区3个活化位点磷酸化的影响。其中,εPKC的3个活化位点为:位于活化环的Thr566、位于转角的Thr710、位于疏水端的Ser729,εPKC在Ser729磷酸化位点的磷酸化在调控εPKC活性中发挥着关键作用[9]。
3.3 运动预适应晚期效应中εPKC变化及可能机制
研究者在对EP诱导的心肌保护效应的机制的研究中发现,EP晚期保护效应期心肌的抗氧化能力提高,热休克蛋白表达增多[18,19],ATP敏感钾离子通道蛋白表达增加[4],心肌环氧合酶-2活性的增加,内质网应激蛋白的增多等[14,29],为进一步的研究εPKC在EP心肌保护作用奠定了基础。迄今为止,国内、外对EP晚期效应中PKC各个亚型的变化研究较少,国内、外对PKC亚型εPKC在EP晚期效应期分布及其表达尚无报道,εPKC是否为晚期EP心肌保护作用信号转导机制的关键中介物质目前都尚未有定论。
εPKC在IP中为介导心肌保护效应的关键物质。Ping[26]等采用western blot检测εPKC水平变化,发现IP可促使心肌中εPKC的大量表达,εPKC可能通过激活下游Lck通路,作用于下游效应蛋白KATP通道、MPTP等,减轻I/R损伤,发挥IP的心肌保护效应。Saurin[28]等发现,εPKC可能为IP诱导心肌保护效应信号转导机制中关键作用环节,在敲除εPKC基因的小鼠中IP不能减轻小鼠的心肌梗塞面积。Lange[17]等采用western blot法研究长期的血管紧张素Ⅱ受体-1拮抗剂对εPKC的影响发现,εPKC蛋白水平显著升高,血管紧张素Ⅱ受体-1拮抗剂激活εPKC心肌保护信号转导通路,使心肌梗死面积减少。部分研究者参照εPKC在IP中发挥的效应以及可能机制对εPKC在运动中的变化做了研究发现,εPKC的激活在运动对心肌细胞的保护效应中的作用可能与IP中作用类似。Carson等[8]对大鼠进行一次速度为23m/min,持续时间20min的跑台运动后采用western blot测定εPKC在心肌细胞膜的蛋白表达水平。结果显示,与他的研究假设相反的是,一次运动后心肌细胞膜εPKC表达减少,但心肌细胞胞质中εPKC在Ser729磷酸化位点的磷酸化表达增加,其心肌保护机制可能是εPKC磷酸化并激活下游效应蛋白,发挥心肌保护效应。以上结果研究提示,心肌εPKC可能通过εPKC蛋白水平的增加或εPKC在Ser729磷酸化位点的磷酸化增多激活下游εPKC-ERK/Lck信号转导通路,从而减轻心肌I/R损伤,减少心肌梗塞面积。Qiu[27]等在IP中对心肌εPKC的研究发现,εPKC活化后可转移至心肌闰盘与线粒体,发挥其对心肌的晚期保护效应。
本次实验采用western blot法检测心肌组织中εPKC蛋白水平的变化,结合免疫组织化学方法观察运动后心肌组织中εPKC表达位置变化及半定量分析其表达变化,结果表明,安静状态下εPKC免疫阳性反应呈点状颗粒散在分布于胞浆内,免疫反应阳性颗粒稀疏;与Carson[8]的研究结果不同,EP晚期εPKC蛋白水平较安静状态下明显升高,免疫组织化学结果显示εPKC免疫反应阳性大部分发生转膜现象,集中分布于心肌细胞的闰盘处,免疫阳性染色深。这证实了Newton[22]与Qiu[27]的研究结果,活化后的εPKC可向心肌闰盘转位,发挥EP晚期心肌保护效应。εPKC向心肌细胞膜聚集原因可能为εPKC转位并激活后通过作用于其下游效应物质如与Cx43形成复合物共同表达于大鼠心肌细胞连接处,或者转位于sarcKATP上维持细胞内环境稳定,发挥心肌保护作用。大强度的力竭运动可导致心肌细胞缺血、缺氧增加,造成急性心肌损伤。力竭运动后大鼠心肌细胞εPKC蛋白水平显著升高,免疫阳性反应产物呈颗粒状分布于细胞胞浆或在心肌细胞闰盘聚集呈线状分布,免疫阳性染色深。其可能原因为,大量εPKC可促使线粒体KATP通道与肌浆网L型Ca2+通道的开放,促使K+外流与Ca2+释放,抑制Ca2+内流与摄取,ATP能耗降低,心肌细胞Ca2+超载程度明显下降,维持细胞内环境稳定,进一步抑制力竭运动所致心肌损伤。但Doble[12]等的研究表明,过表达无活性的εPKC使Cx43的磷酸化水平降低,从而不能行使εPKC的心肌保护功能。随着力竭时间增长,力竭运动组可能存在大量无活性的εPKC转位于心肌细胞膜上,导致其自身磷酸化水平降低,心肌保护作用减弱。同时,EP后再进行力竭运动致εPKC蛋白水平显著升高,但与力竭运动组不同,εPKC并没有出现转位现象,免疫阳性颗粒散在分布于心肌细胞胞浆中。由于本次实验中没有检测磷酸化的εPKC的蛋白水平与位置表达,根据EP对力竭运动的晚期心肌保护效应推测,磷酸化并激活的εPKC向心肌闰盘与细胞膜的转位并激活下游效应物质可能是EP晚期心肌保护效应的关键因素。Cenni[9]的研究也表明,εPKC在Ser729磷酸化位点的磷酸化在调控εPKC活性中发挥着关键作用,进一步的研究应着重检测εPKC磷酸化位点Ser729的蛋白水平的变化与εPKC下游效应物质的蛋白水平变化,从而揭示εPKC在EP中的细胞信号转导途径。
4 结论
EP作为一种无损伤性预适应方式,能够减轻力竭运动致急性心肌损伤的程度,EP对力竭运动致急性心肌损伤具有晚期保护效应。在EP晚期保护效应中,大鼠心肌组织εPKC的蛋白水平升高,εPKC向心肌细胞闰盘转位,表明εPKC参与了EP诱导的晚期心肌保护效应。
[1]马治云,潘珊珊,申毓军,等.心肌分子标志物NT-proBNP在运动预适应保护效应评价中的应用[J].体育科学,2011,31(12):55-61.
[2]申毓军,潘珊珊.运动预适应心肌保护效应与细胞信号转导研究现状和展望[J].上海体育学院学报,2010,34(6):55-58.
[3]王凯,潘珊珊.ATP敏感钾通道介导运动预适应对心肌保护作用的研究进展[J].体育科学,2011,31(8):59-64.
[4]王凯,潘珊珊,王庆棠.心肌SarcKATP通道kir6.2亚基在运动预适应心肌保护效应中变化的研究[J].体育科学,2012,32(4):60-66,83.
[5]钟旭,潘珊珊.运动预适应对大鼠急性心肌缺血损伤早期保护作用的研究[J].中国运动医学杂志,2009,28(3):260-263.
[6]BASU A,SIVAPRASAD U.Protein kinase C epsilon makes the life and death decision[J].Cell Signal,2007,19(8):1633-1642.
[7]BOWLING N,HUANG X,SANDUSKY G E,et al.Protein kinase C-alpha and-epsilon modulate connexin-43phosphorylation in human heart[J].J Mol Cell Cardiol,2001,33(4):789-798.
[8]CARSON LD,KORZICK D H.Dose-dependent effects of acute exercise on PKC levels in rat heart:is PKC the heart’s prophylactic?[J].Acta Physiol Scand,2003,(178):97-106.
[9]CENNI V,DOPPLER H,SONNENBURG E D,et al.Regulation of novel protein kinase Cεby phosphorylation[J].Biochem J,2002,363(Pt3):537-545.
[10]COSTA A D,GARLID K D.Intra mitochondrial signaling:interactions among mitoKATP,PKC epsilon,ROS,and MPT[J].Am J Physiol Heart Circ Physiol,2008,295(2):874-882.
[11]DOMENECH R J,MACHO P,SCHWARZE H,et al.Exercise induces early and late myocardial preconditioning in dogs[J].Cardiovasc Res,2002,55(3):561-566.
[12]DOBLE B W,PING P,KARDAMI E.The epsilon subtype of protein kinase C is required for cardiomyocyte connexin-43 phosphorylation[J].Circ Res,2000,86(3):293-301.
[13]DUQUESNES N,LEZOUAL’H F,CROZATIER B.PKC-delta and PKC-epsilon:foes of the same family or strangers[J].J Mol Cell Cardiol,2011,51(5):665-673.
[14]GOLBIDI S,LAHER I.Molecular mechanisms in exercise-induced cardio-protection[J].Cardiol Res Pract,2011,6:1-15.
[15]GRANT R B,ERIC N C,Daria M R.Cardioprotective mechanisms of PKC isozyme-selective activators and inhibitors in the treatment of ischemia-reperfusion injury[J].Pharmacological Res,2007,55(6):523-536.
[16]KOICHI I,ERIC C,DARIA M R.Epsilon protein kinase C as a potential therapeutic target for the ischemic heart[J].Cardiovasc Res,2006,70(2):222-230.
[17]LANGE S A,WOLF B,SCHOBER K,et al.Chronic angiotensin II receptor blockade induces cardioprotection during ischemia by increased PKC-epsilon expression in the mouse heart[J].J Cardiovasc Pharmacol,2007,49(1):46-55.
[18]LENNON S L,QUINDRY J C,FRENCH J P,et al.Exercise and myocardial tolerance to ischaemia-reperfusion[J].Acta Physiol Scand,2004,182(2):161-169.
[19]MELLING C W,THORP D B,MILNE K J,et al.Myocardial Hsp70phosphorylation and PKC-mediated cardioprotection following exercise[J].Cell Stress Chaperones,2009,14(2):141-150.
[20]MURRY C E,JENNINGS R B,REIMER K A,et al.Preconditioning with ischemia:a delay of lethal cell injury in ischemic myocardium[J].Circulation,1986,74(5):1124-1136.
[21]NAITOH K,YANO T,MIURA T,et al.Roles of Cx43-associated protein kinases in suppression of gap junction-mediated chemical coupling by ischemic preconditioning[J].Am J Physiol Heart Circ Physiol,2009,296(2):396-403.
[22]NEWTON A C.Protein kinase c:structural and spatial regulation by phosphorylation,cofactors,and macromolecular interactions[J].Chem Rev,2001,101:2353-2364.
[23]O’Brien P J,Smith DEC,Knechtel TJ,et al.Cardiac troponin I is a sensitive,specific biomarker of cardiac injury in laboratory animals[J].Laboratory Animals,2006,40(5):153-171.
[24]OHNUMA Y,MIURA T,MIKI T,et al.Opening of mitochondrial K(ATP)channel occurs downstream of PKC-epsilon activation in the mechanism of preconditioning[J].Am J Physiol,2002,283(1):440-447.
[25]PARRA V M,MACHO P,DOMENECHR J.Late cardiac preconditioning by exercise in dogs is mediated by mitochondrial potassium channels[J].J Cardiovasc Pharmacol,2010,56(3):268-274.
[26]PING P,SONG C,ZHANG J,et al.Formation of protein kinase C epsilon Lck signaling modules confers cardioprotection[J].J Clin Invest,2002,109(4):499-507.
[27]QIU Y,PING P,TANG X L,et al.Direct evidence that protein kinase C plays an essential role in the development of late preconditioning against myocardial stunning in conscious rabbits and that epsilon is the isoform involved[J].J Clin Invest,1998,101(10):2182-2198.
[28]SAURIN A T,PENNINGTON D J,PAAT N J,et al.Targeted disruption of protein kinase C epsilon gene abolishes the infarct size reduction that follows ischaemic preconditioning of isolated buffer-perfused mouse hearts[J].Cardiovasc Res,2002,55(3):672-680.
[29]SCOTT K P,JOHN C Q,ANDREAS N K.Exercise-induced cardio-protection against myocardial ischemia-reperfusion injury[J].Free Radical Biology Med,2008,(44):198-201.
[30]SHAVE R,BAGGISH A,GEORGE K,at al.Exercise-Induced Cardiac Troponin Elevation:Evidence,Mechanisms,and Implications[J].J Am Coll Cardiol,2010,56(3):169-176.
[31]SHAVE R,ROSS P,LOW D,et al.Cardiac troponin I is released following high-intensity short-duration exercise in healthy humans[J].Int J Cardiol,2010,145(2):337-339.
[32]SHEN Y J,PAN S S,ZHUANG T,et al.Exercise preconditioning initiates late cardioprotection against isoproterenol-induced myocardial injury in rats independent of protein kinase C[J].J Physiol Sci,2011,61(1):13-21.
[33]YAMASHITA N,BAXTER F,YELLON D M.Exercise directly enhances myocardial tolerance to ischemia-reperfusion injury in the rat through a protein kinase C mediated mechanism[J].Heart,2001,85(3):331-336.
[34]YANG X L,COHEN M V,DOWNEY J M.Mechanism of cardioprotection by early ischemic preconditioning[J].Cardiovasc Drugs Ther,2010,24(3):225-234.
[35]ZENG L,WEBSTER S V,NEWTON P M.The biology of protein kinase C[J].Adv Exp Med Biol,2012,740:639-661.
Changes ofεPKC Expression during Exercise Preconditioning induced-Late Myocardial Protection in Rats
HAO Zhe,PAN Shan-shan
Objective:To determine whether exercise preconditioning(EP)is capable of protecting myocardium from exhaustive exercise and view the change ofεPKC expression during exercise preconditioning.Methods:SD rats were divided into control group(C),EE group,LEP group,LEP+EE group.After establishing of EP animal model,exhaustive exercise on treadmill for inducing myocardial injury.Then the level of cTnI was detected by chemiluminescent immunoassay.Western blotting method was used to detect changes ofεPKC,immunohistochemistry method was used to observe expressions ofεPKC.Results:As compared with the group C,the cTnI level in serum increased significantly,εPKC significantly increased andεPKC translocated from the soluble to the intercalated disk in group EE.While compared with the group C,there was no significant difference in the cTnI level in group LEP,butεPKC significantly increased and theεPKC translocated from the soluble to the intercalated disk.As compared with the group EE,the cTnI level in serum decreased significantly in group LEP+EE,there was no significant difference inεPKC level and there was no expression at intercalated disk.Conclusion:Exercise preconditioning induced-late myocardial protection against exhaustive exercise injury andεPKC participated in late cardioprotection induced by exercise preconditioning.
εPKC;exercisepreconditioning;latecardioprotection;exhaustiveexercise;myocardialinjury;rat;animalexperiment
G804.2
A
1000-677X(2012)07-0039-06
2012-04-16;
2012-06-26
国家自然科学基金资助项目(31071031);上海市科学技术委员会资助项目(09490503300)。
郝喆(1987-),女,河南开封人,在读博士研究生,主要研究方向为运动与心血管形态和机能,E-mail:sldhz1987@126.com;潘珊珊(1957-),女,江苏常州人,教授,博士研究生导师,主要研究方向为运动与心血管形态和机能,Tel:(021)51253252,E-mail:panshanshan@yahoo.com.cn。
上海体育学院运动科学学院,上海200438 School of Sports Science,Shanghai University of Sport,Shanghai 200438,China.

