Thermomyces lanuginosus ZJB09222脂肪酶基因克隆及在大肠杆菌中的表达
雷丽华,郑仁朝,柳志强,黎小军,郑裕国
(浙江工业大学生物与环境工程学院,浙江 杭州,310014)
Thermomyces lanuginosus ZJB09222脂肪酶基因克隆及在大肠杆菌中的表达
雷丽华,郑仁朝,柳志强,黎小军,郑裕国
(浙江工业大学生物与环境工程学院,浙江 杭州,310014)
Thermomyces lanuginosus脂肪酶(简称TLL)是具有重要商业应用价值的脂肪酶之一。运用RT-PCR技术,从Thermomyces lanuginosus ZJB09222基因组中克隆得到885 bp脂肪酶基因cDNA序列,其结构基因编码蛋白包含292个氨基酸。将脂肪酶基因cDNA序列开放阅读框克隆到大肠杆菌表达载体pET-28b中,转化大肠杆菌BL21(DE3),构建了基因工程菌E.coli BL21/pET28b-TLL。诱导表达后SDS-PAGE电泳显示该脂肪酶分子量约为32 ku。筛选获得廉价重组菌培养基,表达条件优化结果表明,当OD600约为0.6~0.8时,加入IPTG至终浓度为0.1 mmol/L,在28℃诱导培养7 h,酶活达到41 U/mL。
脂肪酶,Thermomyces lanuginosus,克隆,大肠杆菌,诱导表达
脂肪酶(lipase,EC 3.1.1.3)是一类能够催化长链甘油三酯水解生成甘油二酯和羧酸及其逆反应的丝氨酸水解酶[1]。同时,它们也能够在有机溶剂中高效催化各种非天然底物的酯化、转酯、氨解等反应。因此,脂肪酶在食品、洗涤、纺织、饲料、能源等加工业中应用广泛[2],是最重要的工业酶制剂之一。随着生物催化技术在支撑工业可持续发展中重要性的不断显现,脂肪酶作为高效、高立体选择性生物催化剂的功能日益受到重视,其中热稳定、高活力的脂肪酶具有无可比拟的开发和应用前景。
疏棉状嗜热丝孢菌(Thermomyces lanuginosus)是一种分布广泛,生长上限温度较高的真菌,能够产生系列具有重要工业价值的热稳定纤维素酶、淀粉酶、木聚糖酶、蛋白酶、脂肪酶等[3]。T.lanuginosus脂肪酶(TLL)属于碱性脂肪酶,最适反应pH 8.0,在pH值4.0~11.0范围内较稳定,最适反应温度60℃,在65℃下仍能保持较高活性[4],用于食品加工、油脂化学品工业、造纸工业、洗涤和生物表面活性剂合成等行业[5]。在有机合成领域,该脂肪酶用于糖衍生物的区域选择性水解、外消旋体拆分[6]和前手性酯的不对称水解等[7-8]。与其他嗜热真菌脂肪酶相比,TLL 活性最高[9]。
由于嗜热真菌的特殊属性,野生菌发酵工业化生产TLL存在较多困难。采用分子生物学手段,构建适于产业化应用的工程菌就成为必然要求。1998年,Boel最先克隆了T.lanuginosus脂肪酶的mRNA序列(AF054513);1998年,申请美国专利“Humicola lanuginose lipase produced in Aspergillus”,用异源丝状真菌表达生产脂肪酶。Novozymes在2002年成功将T.lanuginosus脂肪酶与Fusarium oxysporum脂肪酶融合在一起构成“hybrid”脂肪酶,并在Aspergillus oryzae中表达成功。该重组脂肪酶已经成为洗涤剂用酶的主力。2004年 Prathumpai等人用黑曲霉表达TLL[10]。他们利用米曲霉淀粉酶启动子和黑曲霉葡萄糖苷酶终止子,将疏棉状嗜热丝孢菌脂肪酶基因(AF054513)在黑曲霉中表达。但SDS-PAGE分析显示,绝大部分脂肪酶结合在细胞壁上,未能分泌。国内郑艳等根据已报道TLL序列(AF054513)设计特异引物,在毕赤酵母中成功表达[11]。
与其它表达系统相比,大肠杆菌表达系统具有遗传背景清楚,目的基因表达水平高,培养条件简单,培养周期短,抗污染能力强,成本低等特点,是基因表达技术中发展最早和目前应用最广泛的经典表达系统。本研究拟从实验室保存的疏棉状嗜热丝孢菌中克隆出脂肪酶基因,在E.coil BL21(DE3)中表达,并优化重组菌的表达条件。
1 材料与方法
1.1 材料
1.1.1 菌种与质粒
Thermomyces lanuginosus ZJB09222由本实验室保藏;大肠杆菌JM109、BL21(DE3)、质粒pET-28b由本实验室保存;质粒 pMD18-T Vector购自 TaKaRa公司。
1.1.2 酶与化学试剂
T4 DNA连接酶、限制性内切酶NcoⅠ和HindⅢ购自Fermentas公司,胶回收试剂盒和PCR纯化试剂盒为Axygen公司产品,RT-PCR试剂盒、IPTG、氨苄青霉素、卡那霉素、DL2000 DNA Maker、Taq DNA 聚合酶等试剂购自 TaKaRa公司。对硝基苯乙酸酯(pNPA)、对硝基苯丁酸酯(pNPB)、对硝基苯月桂酸酯(pNPL)和对硝基苯棕榈酸酯(pNPP)均购自Sigma公司。PCR引物由上海生工生物工程有限公司合成,序列测定由上海桑尼有限公司完成。其它化学试剂均为分析纯。
1.1.3 培养基与培养条件
T.lanuginosus ZJB09222培养基:PDA培养基。
本研究所用大肠杆菌培养基(pH 7.0,g/L)如下:
LB培养基:蛋白胨10,酵母粉5,NaCl 10;IG培养基:蛋白胨 20,酵母粉 12,NaCl 10,甘油 10 mL,KH2PO41.5,K2HPO42.3,MgSO4·7H2O 0.25;TB 培养基:蛋白胨 12,酵母粉 24,甘油6,NaCl 10,KH2PO42.4,K2HPO4·3H2O 12.5;2-YT 培养基:蛋白胨 16,酵母10,NaCl 5;DB培养基:蛋白胨 7,酵母粉 8,甘油 3,K2HPO42,MgSO42,NaCl 10;DLB 培养基:蛋白胨10,酵母粉5,NaCl 10;DGL培养基:蛋白胨10,酵母粉5,NaCl 10,甘油 5;DST培养基:蛋白胨 10,酵母粉5,NaCl 10,淀粉5;DG培养基:蛋白胨10,酵母粉5,NaCl 10,葡萄糖5;DM培养基:蛋白胨10,酵母粉5,NaCl 10,麦芽糖5;DS培养基:蛋白胨10,酵母粉5,NaCl 10,蔗糖5;DF培养基:蛋白胨10,酵母粉5,NaCl 10,D-果糖 5;DL 培养基:蛋白胨 10,酵母粉5,NaCl 10,乳糖5;DMA培养基:蛋白胨 10,酵母粉5,NaCl 10,甘露醇5;DBM培养基:蛋白胨7,酵母粉8,甘露醇 3,K2HPO42,MgSO42,NaCl 10。
除LB、IG、TB和2-YT培养基中的蛋白胨和酵母粉购自英国Oxoid公司外,其余培养基中的蛋白胨和酵母粉均为国产生化试剂。
1.2 方法
1.2.1 真菌总RNA的提取及cDNA第一链的合成
TRIzol法提取总RNA。采用RT-PCR的方法从T.lanuginosus ZJB09222菌中分离脂肪酶基因,使用TaKaRa公司RT-PCR试剂盒进行cDNA第一链的合成,反应体系及条件均参照试剂盒的使用说明。并经紫外检测和0.9%琼脂糖凝胶电泳鉴定其大小及浓度。-20℃保存,待用。
1.2.2 全长cDNA的克隆
以cDNA第一链为模板,利用PCR方法扩增脂肪酶cDNA序列。所用引物序列为:上游引物ZS(5'-ATGAGGAGCTCCCTTGTGCTG-3');下游引物GY(5'-CGCCGCGCACTAAAGACATGA-3')[11]。 PCR 程 序为:94℃预变性4min;94℃1min,52℃1min,72℃1min,30个循环;72℃延伸10 min。利用AxyPrep DNA凝胶回收试剂盒将PCR产物进行凝胶回收后,与pMD18-T载体16℃连接,转化大肠杆菌JM109感受态,涂布于含有氨苄青霉素的LB平板上。挑取单菌落,进行菌落PCR鉴定后,将阳性克隆送样测序。
1.2.3 TLL成熟肽基因的分离与大肠杆菌基因工程菌的构建
根据已获得的脂肪酶全长cDNA序列,设计表达引物(LEIEP1:5'-AG GCCATGGGTAGTCCTATTCGTCGAGAG-3',LEIEP2:5'-CCC AAGCTTTTACGCCGCGCACTAAAGAC-3'),用于去除非编码区序列和信号肽序列。为保证该脂肪酶基因定向插入载体中,在上下游引物两端分别引入NcoⅠ和HindⅢ酶切位点(加下划线部分)。PCR程序同前所述,退火温度为55℃。PCR产物经AxyPrep DNA凝胶回收试剂盒回收后,与pMD18-T载体连接,转化大肠杆菌JM109,涂布于含有氨苄青霉素的LB平板上。挑取单菌落,进行菌落PCR鉴定,阳性克隆经测序证实。将经测序验证含TLL成熟肽基因的质粒pMD18-T/TLL用NcoⅠ和HindⅢ双酶切,回收插入片段,并与同样双酶切的大肠杆菌表达质粒pET-28b进行连接,构建重组质粒pET28b-TLL,转化 E.coli BL21(DE3),经 Kan抗性筛选,进行菌落PCR鉴定,重组质粒酶切鉴定和测序证实。TLL大肠杆菌基因工程菌命名为E.coli BL21(DE3)/pET28b-TLL。
1.2.4 重组菌的诱导表达
通过测定重组脂肪酶酶活以及生物量,筛选较优发酵培养基,即将重组菌分别在37℃振荡培养过夜,以体积分数1%的接种量转接于50 mL含Kan的基础培养基中,200 r/min培养至OD600在0.6~0.8,加入IPTG至终浓度为0.2 mmol/L,28℃诱导培养10 h后,离心收集菌体。菌体用50 mmol/L Tris-HCl缓冲液(pH 8.0)溶解并混合均匀,稀释一定倍数后,进行酶活测定。
1.2.5 表达产物SDS-PAGE分析
诱导后的培养物10000 r/min离心5 min,弃上清并收集菌体,再取适量无菌水重悬菌体,取20 μL菌悬液加入等体积的2×Loading buffer,混匀后煮沸10 min。离心后取上清液进行SDS-PAGE分析(80 V,120 min),电泳结束后用考马斯亮蓝染色3 min,再用脱色液[V(甲醇)∶V(冰醋酸)∶V(蒸馏水)=1∶1∶8)]脱色。
1.2.6 脂肪酶活力测定
用无水乙醇溶解一定量pNPL,配成2.5 mmol/L底物溶液。取80 μL菌液加入840 μL Tris-HCl缓冲液(50 mmol/L,pH 8.0)中,30℃ 金属浴上保温2min,再加入80 μL底物溶液充分振荡混匀2 min后,用酶标仪检测405 nm下的吸光值。
酶活(U)单位定义:在 pH 8.0,30℃条件下,每分钟分解pNPL产生1 μmol对硝基苯酚(黄色)所需的酶量定义为1个酶活单位。
2 结果与分析
2.1 TLL基因的克隆
TRIzol法提取总 RNA。使用Eppendorf公司的核酸蛋白测定仪估测RNA质量,测定A260/A280比值为2.0,可见得到的RNA较均一。由于甲醛变性凝胶电泳繁琐且上样量较大,故采用普通电泳检测,即0.9%琼脂糖凝胶电泳检测RNA的完整性(图1 A)。通过RT-PCR得到cDNA第一条链(图1 B),用特异性引物对ZS和GY扩增出一条约0.9 kb的目的条带(图2),片段大小与已报道的来源于T.lanuginosus脂肪酶基因(EU022703.1)大小相近,测序后证实仅有2个碱基不同,即619位碱基T变为C,636位碱基G变为A,翻译后的氨基酸序列也有两氨基酸不同,即207位L变为P,213位G变为R。至此,已成功分离出T.lanuginosus ZJB09222脂肪酶基因全长cDNA序列。
2.2 重组菌的构建
将PCR扩增得到的TLL成熟肽编码基因克隆到克隆载体pMD18-T,CaCl2法转化E.coli JM109,通过菌落PCR,酶切并测序验证,得到重组质粒并命名为pMD18-T/TLL。经过酶切、连接,克隆到含强启动子的大肠杆菌表达载体 pET-28b,构建重组质粒pET28b-TLL,转化E.coli BL21(DE3),经IPTG诱导,表达出分子量约32 ku的目的蛋白(图3),检测具有脂肪酶活性,成功构建TLL基因工程菌E.coli BL21(DE3)/pET28b-TLL。
2.3 重组菌的表达条件优化
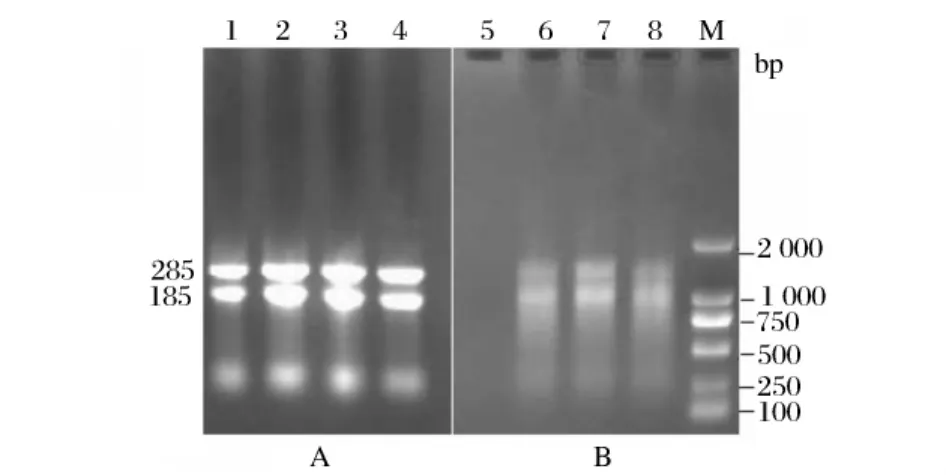
图1 T.lanuginosus RNA电泳分析(A)和RT-PCR产物电泳分析(B)

图2 全长cDNA序列PCR扩增产物电泳分析

图3 诱导产物SDS-PAGE分析
为了考察重组脂肪酶对脂肪酸碳链长度的选择性,选用2.5 mmol/L对硝基苯乙酯(pNPA)、对硝基苯丁酸酯(pNPB)、对硝基苯月桂酸酯(pNPL)、对硝基苯棕榈酸酯(pNPP)作为底物,检测重组脂肪酶对不同底物的催化能力,结果如图4。以pNPA、pNPB为底物时的活力仅有以pNPL为底物时的10%~40%。可见重组脂肪酶对较长碳链脂肪酸酯的催化效率高,即对较长碳链脂肪酸有较高的亲和性。因此,选择pNPL作为酶活测定底物。

图4 重组脂肪酶对不同链长脂肪酸酯的催化活性
2.3.1 不同培养基的选择
为了提高重组脂肪酶的表达量,考察了部分已报道大肠杆菌培养基对酶活的影响,如图5所示。结果表明,添加甘油能促进菌体生长,酶活也得到提高。其中在IG培养基诱导培养下,酶活和干重均达到最高,其次是DB和DMA培养基。由于进口蛋白胨、酵母粉价格较高,进一步以DB、DBM、DGL和DMA培养基为基础,分别比较0.2 mmol/L IPTG和1%乳糖的诱导效果,结果如图6所示。1%乳糖诱导蛋白表达量仅为0.2 mmol/L IPTG诱导下的50%。在IPTG诱导下,DB培养基中重组脂肪酶活力最高,达26 U/mL。

图5 不同培养基对重组菌生长和产酶的影响
2.3.2 诱导条件的优化
在基础培养基基础上,以IPTG为诱导剂,考察了不同诱导剂浓度、诱导温度及诱导时间对产酶的影响(如图7)。确定该重组菌诱导表达最佳条件为:OD600为0.6~0.8时,加入 IPTG至终浓度为 0.1 mmol/L,28℃诱导7 h,脂肪酶的酶活最高达到41 U/mL,比优化前提高了1.6倍。
3 讨论

图6 不同诱导剂对重组菌生长和产酶的影响

图7 诱导剂浓度(A)、诱导温度(B)及诱导时间(C)对重组酶表达的影响
疏棉状嗜热丝孢菌是一种分布广泛、最适生长温度较高的真菌,能够产生具有重要工业价值的热稳定脂肪酶。但是野生菌生产脂肪酶需在高温下培养(60℃),造成实际生产中菌体培养困难、能耗高。此外,其工业化生产还受到如诱导剂高黏度油脂与产物分离困难等因素的限制。因此,应用分子生物学手段,将嗜热真菌热稳定脂肪酶基因导入中温单细胞微生物中高效表达成为十分有效的途径。
虽然黑曲霉和毕赤酵母表达系统都成功实现了高活性TLL的表达[10-11],但由于黑曲霉和毕赤酵母都属于好氧微生物,发酵过程通氧量大,且黑曲霉和毕赤酵母表达系统诱导周期长,导致生产成本相对较高。而大肠杆菌表达系统具有操作简单、发酵周期短、易于大规模培养,成本低廉等优点,在工业化产酶中具有十分显著的优势。
本研究成功构建了E.coil BL21(DE3)/pET28b-TLL基因工程菌,首次实现了TLL在大肠杆菌中的重组表达,确定了廉价培养基和较优表达条件,当OD600约为0.6~0.8时,加入IPTG至终浓度为0.1 mmol/L,在28℃诱导培养7 h,酶活达到41 U/mL,为高效、低成本TLL的工业化生产和应用奠定了基础。
[1]Cousin X,Hotelier T,Giles K,et al..The alpha/beta fold family of proteins database and the cholinesterase gene server[J].Nucleic Acids Research,1997,25:143-146.
[2]Sangeetha R,Arulpandi I,Geetha A.Bacterial lipases as potential industrial biocatalysts:An overview [J].Research Journal of Microbiology,2011,6(1):1-24.
[3]Janda K.The lipolyticactivity of Thermomyces lanuginosus strains isolated from different natural sources[J].International Biodeterioration & Biodegradation,2005,55:149-152.
[4]Maheshwari R,Bharadwaj G,Bhat M K.Thermophilic fungi:heir physiology and enzymes[J].Microbiology and Molecular Biology Reviews,2000,64(3):461-488.
[5]Roberto FL.Lipase from Thermomyces lanuginosus:Uses and prospects as an industrial biocatalyst[J].Journal of Molecular Catalysis B:Enzymatic,2010,62(3/4):197-212.
[6]Palomo JM,Lorente GF,Guisdn JM.Modulation of immobilized lipase enantioselectivity via chemical amination[J].Advanced Synthesis& Catalysis,2007,349(7):1119-1127.
[7]Cabrera ZD,Palomo JM,Gloria FL.Partial and enantioselective hydrolysis of diethyl phenylmalonate by immobilized preparations of lipase from Thermomyces lanuginosus[J].Enzyme and Microbial Technology,2007,40(5):1280-1285.
[8]Cai J F,Guan Z,He Y H.The lipase catalyzed asymmetric C-C Michael addition[J].Journal of Molecular Catalysis B:Enzymatic,2010:1-5.
[9]Johri BN,Ahmad S.Thermophilie Moulds in Biotechnology[M].Netherlands:Kluwer Academic publishers,1999.
[10]Prathumpai W,Flitter SJ,McIntyre M.Lipase production by recombinant strains of Aspergillus niger expressing a lipase-encoding gene from Thermomyces lanuginosus[J].Applied Microbiology and Biotechnology,2004,65(6):714-719.
[11]郑艳,周波,宋宁宁,等.疏棉状嗜热丝孢菌脂肪酶基因的克隆及其在毕赤酵母中的高效表达[J].菌物学报,2009,28(2):268-274.
ABSTRACTThermomyces lanuginosus lipase is one of the most important industrial enzymes.Based on published DNA sequence,the full length cDNA of the lipase was cloned using RT-PCR method.It revealed that the cDNA of the T.lanuginosus lipase gene encoded a protein lipase of 292 amino acid residues.The open reading frame of the cDNA was cloned into the plasmid pET-28b,which was then transformed into E.coil BL21(DE3)strain.The Mr of the expression product was 32 ku by SDS-PAGE.The recombinant E.coli BL21/pET28b-TLL exhibited highest activity of 41 U/mL at 28℃ for 7 h induction with 0.1 mmol/L IPTG after screening of the best medium.
Key wordslipase,Thermomyces lanuginosus,cloning,Escherichia coli,induction expression
Gene Cloning of Lipase from Thermomyces lanuginosus ZJB09222 and Expression in Escherichia coli
Lei Li-hua,Zheng Ren-chao,Liu Zhi-qiang,Li Xiao-jun,Zheng Yu-guo
(College of Biological and Environmental Engineering,Zhejiang University of Technology,Hangzhou 310014,China)
硕士研究生(郑裕国教授为通讯作者)。
2011-12-21,改回日期:2012-03-01

