β-乳球蛋白包埋花色苷C3G对其抗氧化活性的保护*
杜文凯,蔡烈伟,李博,金建昌,杜琪珍
1(浙江工商大学食品化学研究所,浙江 杭州,310012)
2(漳州科技职业学院,福建 漳州,363202)
β-乳球蛋白包埋花色苷C3G对其抗氧化活性的保护*
杜文凯1,蔡烈伟2,李博1,金建昌1,杜琪珍1
1(浙江工商大学食品化学研究所,浙江 杭州,310012)
2(漳州科技职业学院,福建 漳州,363202)
利用热激的β-乳球蛋白(β-Lg)与矢车菊素-3-葡萄糖苷(C3G)共组装形成纳米粒以保护C3G的抗氧化活性。溶液pH值为2.5~6.5、蛋白热激温度为30~85℃及β-Lg与C3G不同摩尔比例(1∶2~1∶32)对纳米体系的粒径、Zeta电位、包埋率及单位蛋白载药量具有显著影响。在pH 6.5时能够形成稳定的纳米分散体,在热激温度85℃、β-Lg与C3G摩尔比为1∶2时,β-Lg对C3G的抗氧化活性具有最好的保护作用。
纳米粒,β-乳球蛋白,矢车菊素-3-葡萄糖苷,抗氧化活性
矢车菊素-3-葡萄糖苷(C3G)是目前研究最为广泛的花色苷单体之一,存在于黑米、越橘、桑葚等植物中,具有抗氧化、抗癌、抗炎症、抗心血管疾病、抗过敏、减肥等多种生物功能[1-3]。然而花色苷易受光、温度、pH、氧等外界因素的影响而发生变化[4]。其次由于其在肠胃停留时间有限、渗透性不足以及受pH、酶等影响[5-6],口服生物利用度低。因此,花色苷在普通和保健食品等领域的应用有较大的局限性。
纳米粒子是粒径介于1~100 nm的材料,具有独特的表面效应和量子尺寸效应[7]。纳米技术在医药学和食品科学领域具有广阔的应用前景。通过将功能因子包裹于纳米粒子内部或吸附于纳米粒子表面,能够提高生物活性成分的稳定性,促使其活性的最大发挥。
目前关于花色苷的包埋主要采用微胶囊,所制备颗粒均未达到纳米级[8-10]。本研究采用热诱导的β-LG与C3G共组装制备β-LG-C3G的纳米分散体,并研究了β-LG-C3G纳米分散体对C3G抗氧化活性的保护作用。研究结果对于花色苷在食品饮料、保健品等领域的应用具有重要意义。
1 材料与仪器设备
1.1 实验材料
矢车菊素-3-葡萄糖苷(C3G)由本实验室自黑米提取物中分离制备,纯度为94.4%[11];β-乳球蛋白(β-Lg)(纯度>90%)购自Sigma公司;色谱纯甲醇、乙腈购自天津四友精细化学品有限公司;其它试剂均为分析纯,购自华东医药股份有限公司;MILIPORE超滤浓缩离心管(3000MWCO)购自上海欧韦达仪器科技有限公司;实验用水均为超纯水。
1.2 仪器设备
TS-100B恒温摇床,上海善志仪器设备有限公司;AY-120电子天平,日本SHIMADZU;超高压液相色谱;UPLC,美国WATERS公司;JB-3涡旋仪,上海雷磁新泾仪器有限公司;VIS-723G紫外可见分光光度计,上海之信仪器有限公司;Nano-ZS型粒度仪,英国Malvern公司。
2 实验方法
2.1 β-LG–C3G纳米分散体系的制备
参照Shpigelman等的方法[8]并略做改进。配置pH 6.0~7.0的30 mmol/L磷酸盐缓冲溶液(Na2HPO4-NaH2PO4),并用磷酸调节pH 6.0的 缓冲液至pH 2.5~5.5备用。β-Lg溶于含有0.02%NaN3的(PBS)溶液中,室温下于200 r/min振荡12 h使其充分溶解。C3G溶于30 mmoL、pH2.5的磷酸缓冲液,现配现用。β-Lg溶液(1.9 mL)在不同温度下水浴热激20 min,加入0.1 mL C3G溶液,快速涡旋混合20 s,并迅速置于25℃的水浴中冷却。β-Lg终浓度为5.0 mg/mL(0.27 mmoL)。
本研究考察下述3个制备因素对β-LG–C3G纳米粒的影响:(1)β-Lg溶液的pH值(pH 2.5,4.5,5.5,6.5);(2)β-Lg 溶液热激温度(30℃,55℃,70℃ ,85℃);(3)β-Lg与 C3G的摩尔比例(1∶2,1∶4,1∶8,1∶16,1∶32)。
2.2 粒径及Zeta电位测定
溶液中颗粒的粒径和Zeta电位采用英国Malvern公司的Nano-ZS型粒度仪进行测定,散射角为173°,测试温度为25℃。
2.3 包埋率的测定
取2 mL β-LG-C3G溶液于超滤浓缩离心管,4℃条件下4000 g离心30 min,收集离心后的液体,超高效液相色谱(UPLC)定量检测超滤离心液中游离C3G的含量。UPLC检测条件为:流动相,A相:V(无水甲酸)∶V(水)=8.5∶91.5,B 相:V(无水甲酸)∶V(甲醇)∶V(乙腈)∶V(水)=8.5∶25∶25∶91.5;B 相梯度洗脱条件:0~10 min,6%~30%;10~12 min,30%~6%;12~15 min,6%。色谱柱为BEH-C18柱(1.7 μm,50 mm×2.1 mm)。检测波长 280 nm,流速0.3 mL/min,进样量5μL。配置 31.25~500 μg/ml共5个浓度梯度C3G标准液,得标准曲线Y=2×10-8X+0.0105(R2=0.996),其中 X 为峰面积,Y 为C3G 浓度(μg/mL)。

2.4 抗氧化活性测定
抗氧化活性采用FRAP法测定[12]。取0.1 mL待测溶液加入到2.9 mL FRAP反应液(由300 mmol/L pH 3.6的醋酸盐缓冲液、10 mmol/L TPTZ溶液、20 mmol/L FeCl3溶液以10∶1∶1的比例混合而成,现用现配)混匀后于37℃水浴孵育30 min,在593 nm处测定吸光值。
使用pH 2.5缓冲液配置20 mmol/L C3G溶液用于纳米粒制备,制备方法同2.1。β-LG-C3G溶液置于30℃环境中,采用2只紫外灯(30 W/只)持续照射加速花色苷降解,每隔24 h取样进行FRAP测定。
2.5 统计分析
本研究所有样品重复测定3次。两组样品间的差异显著性分析采用 Student’s t检验,组间多重比较采用 LSD检验。所有分析使用统计软件 SAS V8进行。
3 结果与分析
3.1 溶液pH值对β-LG-C3G纳米体系的影响
pH值(2.5~6.5)对β-LG-C3G纳米粒粒径、Zeta电位、包埋率和单位蛋白载药量的影响如表1所示。β-LG-C3G纳米粒和纯β-LG溶液在pH 4.5时出现混浊现象,平均粒径均达几百纳米;而在其它pH条件下澄清,粒径小于20 nm。pH 6.5的粒径大约为pH 2.5时的 1.5~2倍。当加热至 70~80℃,pH 2.5和中性条件下的β-LG发生聚集形成可溶的多聚体,而在等电点附近(pH 5.1)会形成肉眼可见的蛋白沉淀[13-14]。本研究结果与这些报道相一致。
Zeta电位是反应纳米体系稳定性的一个重要指标,高Zeta电位使小颗粒间斥力增加,不易聚集,从而更有利于稳定性。通常认为,稳定体系纳米粒Zeta电位应大于 +30 mV或小于-30 mV[15]。β-LG–C3G和β-LG纳米粒的Zeta电位均随着pH值的升高向负值转变,在 pH 6.5时 达到最大值,表明此时纳米体系最为稳定(表1)。
C3G包埋率和单位蛋白装载量随着pH的升高而增大,在pH 6.5时分别达到79.7% 和86.1 nmol/mg(表1)。这是因为在酸性条件下,β-Lg呈现闭合构象,疏水结构藏于蛋白内部,无法和小分子接触;而在中性条件下,蛋白内部的疏水结构域暴露,从而与配体小分子结合力增强[16]。
综合上述结果,β-LG-C3G在近中性条件下制备能够达到较好的澄清度、稳定性和较高的包埋率。花色苷通常在酸性条件下稳定,而在中性和碱性条件下容易降解[4]。研究结果表明,β-LG-C3G纳米粒可用于一些近中性的食品饮料中。
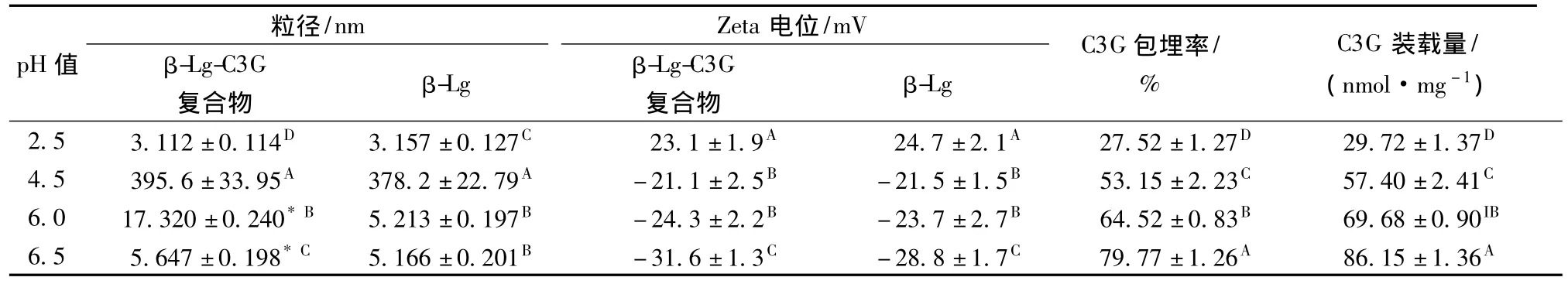
表1 pH值对β-LG-C3G颗粒粒径、Zeta电位、C3G包埋率和装载量的影响(热激温度70℃,β-LG与C3G摩尔比1∶2)
3.2 热激温度对β-LG-C3G纳米体系的影响
蛋白热激温度(30~85℃)对β-LG-C3G纳米粒粒径、Zeta电位、包埋率和单位蛋白载药量的影响如表2所示。随着热激温度的升高,纳米粒粒径、负Zeta电位值、C3G包埋率和单位蛋白装载量均增加。表明在测试范围内较高的热激温度更有利于β-LGC3G纳米粒的形成。中性条件下的β-LG在加热到70℃以上时,二聚体解聚成单体,原本位于蛋白内部的巯基和二硫键暴露,单体蛋白之间通过这些基团发生连接聚集;温度越高,这种效应越显著[17],从而导致颗粒粒径随热激温度升高而增加。
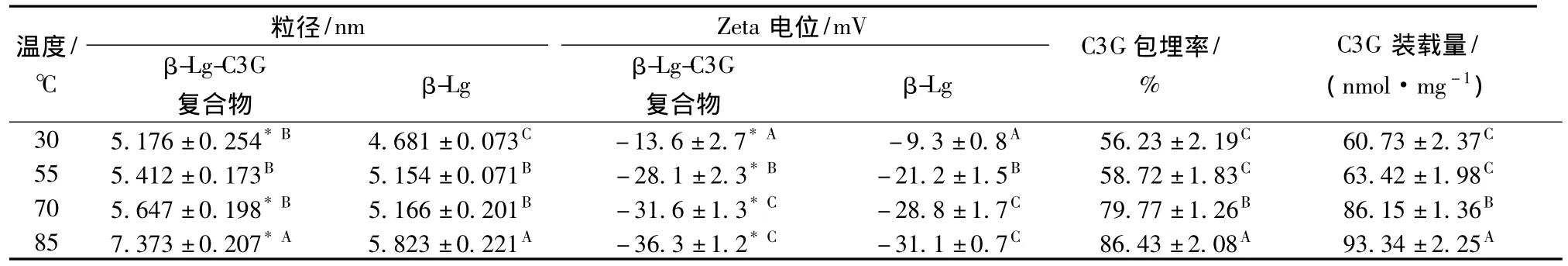
表2 热激温度对β-LG-C3G颗粒粒径、Zeta电位、C3G包埋率和装载量的影响(pH 6.5,β-LG与C3G 摩尔比 1∶2)
3.3 β-Lg与C3G摩尔比例对β-LG-C3G纳米体系的影响
β-Lg与 C3G 摩尔比例(1∶2~1∶32)对 β-LGC3G纳米粒粒径、Zeta电位、包埋率和单位蛋白载药量的影响如表3所示,随着C3G对β-Lg的摩尔比例升高,粒径、负Zeta电位值和单位蛋白载药量都出现明显升高,而包埋率却依次下降。多酚类物质在低浓度时与蛋白形成可溶复合体,而在高浓度时能够使蛋白发生聚集甚至沉淀。在中性条件下多酚类物质的羟基发生质子化,使氧原子带负电荷,因此结合的C3G越多,纳米粒上的负电荷就越多[18]。

表3 摩尔比例对β-LG-C3G颗粒粒径、Zeta电位、C3G包埋率和装载量的影响(热激温度70℃ ,pH 6.5)
3.4 β-LG-C3G纳米粒的抗氧化活性
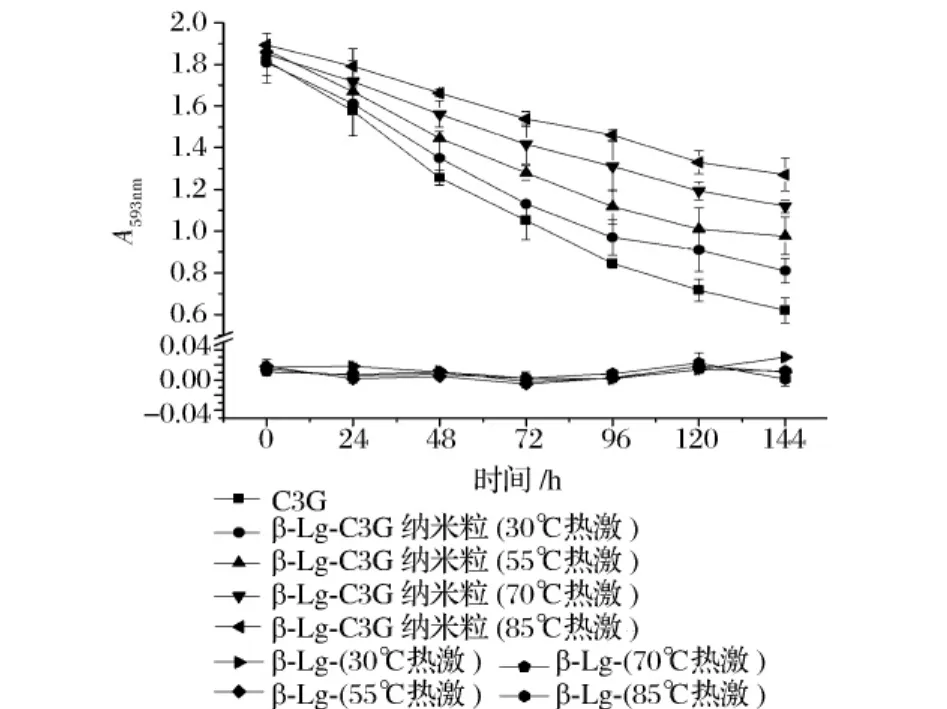
图1 不同热激温度对β-LG-C3G纳米粒的抗氧化活性保护作用的影响(pH 6.5,β-LG与C3G摩尔比1∶2)
热激温度(30~85℃)对β-LG-C3G抗氧化活性的保护作用如图1所示,随着时间的延续,相对于自由C3G,各热激温度下的β-LG-C3G抗氧化活性的降低趋势均有所减缓,热激温度越高,这种保护作用越明显。
β-LG与 C3G 摩尔比例(1∶2~1∶32)对 β-LGC3G抗氧化活性的保护作用如图2所示,β-LG相对于C3G的比例越高,对其抗氧化活性的保护作用越明显,在摩尔比例为1∶16和1∶32时,保护作用已经不明显。
4 结论
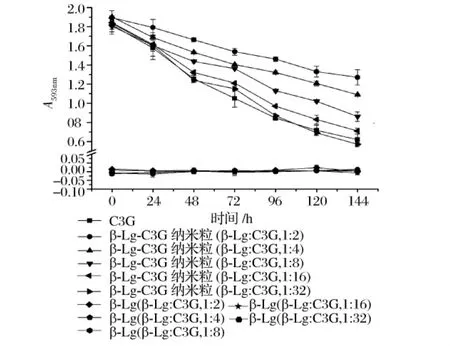
图2 不同摩尔比例对β-LG-C3G纳米粒的抗氧化活性保护作用的影响(热激温度85℃ ,pH 6.5)
溶液pH值、蛋白热激温度以及 β-Lg与C3G的摩尔比例对β-Lg-C3G纳米体系的粒径、Zeta电位、包埋率及单位蛋白载药量都有显著影响。当pH值为6.5、热激温度为85℃、β-Lg与C3G的摩尔比为1∶2时,β-Lg和C3G能够形成稳定的纳米分散体。研究表明β-Lg可作为纳米材料保护C3G稳定性和抗氧化活性,对C3G及其它花色苷在食品饮料等领域的应用具有重要意义。
[1]Wang Q,Xia M,Liu C,et al.Cyanidin-3-O-β-glucoside inhibits iNOS and COX-2 expression by inducing liver X receptor alpha activation in THP-1 macrophages[J].Life Sci,2008,83(5/6):176-184.
[2]Lim T G,Kwon J Y,Kim J,et al.Cyanidin-3-glucoside suppresses B[a]PDE-induced cyclooxygenase-2 expression by directly inhibiting Fyn kinase activity [J].Biochem Pharmacol,2011,82(2):167-174.
[3]Min S W,Ryu S N,Kim DH.Anti-inflammatory effects of black rice,cyanidin-3-O-d-glycoside,and its metabolites,cyanidin and protocatechuic acid[J].Int Immunopharmacol,2010,10(8):959-966.
[4]李颖畅,齐凤元,樊严.提高花色苷稳定性的研究进展[J].中国调味品,2009,34(11):88-90.
[5]Fang Z,Bhandari B.Encapsulation of polyphenols-a review [J].Trends Food Sci Technol,2010,21(10):510-523.
[6]McDougall G J,Fyffe S,Dobson P,et al.Anthocyanins from red wine–Their stability under simulated gastrointestinal digestion[J].Phytochemistry,2005,66(21):2540-2548.
[7]刘彩云,周围,毕阳,等.纳米技术在食品工业中的应用[J].食品工业科技,2005,26(4):185-186.
[8]Chiou D,Langrish T A G.Development and characterisation of novel nutraceuticals with spray drying technology[J].J Food Eng,2007,82(1):84-91.
[9]Ersus S,Yurdagel U.Microencapsulation of anthocyanin pigments of black carrot(Daucuscarota L.)by spray drier[J].J Food Eng,2007,80(3):805-812.
[10]Tonon R V,Brabet C,Hubinger M D.Anthocyanin stability and antioxidant activity of spray-dried acai(Euterpe oleracea Mart.)juice produced with different carrier agents[J].Food Res Int,2010,43(3):907-914.
[11]Li B,Du W,Qian D,Du Q.Combination of high-speed countercurrent chromatography and reversed phase C18chromatography for large-scale isolation of cyanidin-3-O-β-D-glucoside from black rice bran extract[J].Ind Crop Prod,2012,37(1):88-92.
[12]Shi J,Gong J,Liu J,et al.Antioxidant capacity of extract from edible flowers of Prunus mume in China and its active components [J].LWT-Food Sci Technol,2009,42(2):477-482.
[13]Schokker E P,Singh H,Pinder D N,et al.Heat-induced aggregation of β-lactoglobulin AB at pH 2.5 as influenced by ionic strength and protein concentration[J].Int Dairy J,2000,10(4):233-240.
[14]Jung J M,Savin G,Pouzot M,et al.Structure of heat-induced β-lactoglobulin aggregates and their complexes with sodium-dodecyl sulfate[J].Biomacromolecules,2008,9:2477-2486.
[15]Müller R H,Jacobs C,Kayser O.Nanosuspensions as particulate drug formulations in therapy rationale for development and what we can expect for the future[J].Ad Drug Delier Re,2001,47(1):3-19.
[16]Qin B Y,Bewley M C,Creamer L K,et al.Structural basis of the Tanford transition of bovine β-lactoglobulin[J].Biochemistry,1998,37(40):14014-14023.
[17]Schokker E P,Singh H,Pinder D N,et al.Heat-induced aggregation of β-lactoglobulin AB at pH 2.5 as influenced by ionic strength and protein concentration[J].Int Dairy J,2000,10(4):233-240.
[18]Staszewski M,Jagus R J,Pilosof A M R.Influence of green tea polyphenols on the colloidal stability and gelation of WPC [J].Food Hydrocolloid,2011,25(5):1077-1084.
ABSTRACTCyanidin-3-glucoside(C3G)was coated by heat treatment with β-lactoglobulin(β-Lg)for the preservation of antioxidant activity.The effects of pH(2.5-6.5),heating temperature of β-Lg(30-85 ℃)and the molar ratio of β-Lg to C3G(1∶2-1∶32)on the properties of β-Lg-C3G complexes were studied.All three factors significantly influenced the particle size,zeta-potential,entrapment efficiency of C3G and C3G encapsulation with β-Lg particles.Stable and clear solution could be obtained at pH 6.5.The highest protection of EGCG antioxidant activity was obtained with β-Lg heated at 85 ℃ and the molar ratio of 1∶2(β-Lg∶C3G).
Key wordsnanoparticle,β-lactoglobulin,cyanidin-3-glucoside(C3G),antioxidant activity
Preservation of Cyanidin-3-glucoside Antioxidant Properties by Coating with β-lactoglobulin Nanoparticles
Du Wen-kai1,Cai Lie-wei2,Li Bo1,Jin Jian-chang1,Du Qi-zhen1
1(The Institute of Food and Chemistry,Zhejiang Gongshang University,Hangzhou 310012,China)
2(Zhangzhou College of Science and Technology,Zhangzhou 363202,China)
硕士研究生(杜琪珍教授为通讯作者,E-mail:qizhendu@163.com)。
*教育部博士点基金项目(0113326110001),浙江省自然科学基金重点项目(Z12C160014),国家科技支撑计划课题(2011BAD01B03-5)
2012-03-26,改回日期:2012-04-28

