橘皮中橙皮苷提取的优化及其对羟自由基清除作用*
黄芳,周宏,陈华,扶庆权
1(南京晓庄学院 生物化工与环境工程学院,江苏 南京,211171)
2(重庆大学 化学化工学院,重庆,400030)
橘皮中橙皮苷提取的优化及其对羟自由基清除作用*
黄芳1,周宏1,陈华2,扶庆权1
1(南京晓庄学院 生物化工与环境工程学院,江苏 南京,211171)
2(重庆大学 化学化工学院,重庆,400030)
通过单因素试验分析了乙醇体积分数、液料比、提取温度和提取时间对橙皮苷得率的影响,在此基础上选择4因素3水平的Box-Behnken中心组合试验设计,采用响应面法对橘皮中橙皮苷的提取工艺进行了优化。结果表明:最佳提取工艺条件为溶剂中乙醇体积分数71﹪,液料比22∶1 mL/g,提取温度70℃,提取时间2.5 h。经试验验证,在此条件下,得率达4.82%。对橙皮苷提取液的抗氧化研究表明,橙皮苷对羟自由基有一定的清除作用。
响应曲面,橙皮苷,提取工艺,羟自由基
橙皮苷是一种广泛存在于柑橘类水果中的类黄酮物质,尤其是在柑、橘、橙和柠檬等的果皮中含量较高。药理研究表明,橙皮苷具有抗氧化、抗炎、抗肿瘤、降血脂、维持血管正常渗透压、增强毛细血管韧性、保护心血管等多种功效,在临床上用于心血管系统疾病的辅助治疗,也用于医药工业中制药的原料[1]。此外,橙皮苷可在食品工业中可用作天然抗氧化剂,也可用于化妆品行业,其逐渐成为食品添加剂、日用化工业关注的热点。
橙皮苷常用的提取方法有热水提取法、溶剂提取法[2]、碱提酸析法[3]、超声波提取法[4]、微波提取法[5]和酶解法[6]等。其中,热水提取法、溶剂提取法和酸提碱析法简单易操作,是传统的提取方法。传统的橙皮苷提取工艺各有优缺点:如热水提取法工艺简单,但产物杂质多,收率低。碱浸酸析法需大量使用酸碱,会产生卤盐等副产物。醇溶剂提取得到橙皮苷的纯度较高,有机溶剂可以回收,且不使用大量的酸或碱,有利于环境保护。有文献报道[3],用甲醇提取橙皮苷效率较高,但甲醇毒性较大,只适合实验室使用,而乙醇毒性小、使用安全,不仅实验室可以使用,而且适合规模化工业生产。采用响应面法优化乙醇提取橙皮苷的提取工艺尚未见报道。本研究在乙醇提取法单因素试验的基础上,采用响应面法优化橘皮中橙皮苷的提取工艺,并评价优化条件下提取物对羟自由基的清除作用,以其为橙皮苷的工业化生产和进一步开发利用提供科学参考依据。
1 材料与方法
1.1 仪器与试剂
722N型分光光度计,上海第三分析仪器厂;AUY120电子天平,日本岛津;HH-4数显恒温水浴锅,江苏省金坛市荣华仪器制造有限公司;101A-2型电热鼓风干燥箱,上海实验仪器厂有限公司。
橘皮(市售)于40℃烘箱中烘干,粉碎,过60目筛,装瓶备用。
甲醇:99.5%;双氧水30%:;硝酸铝99%;硫酸亚铁溶液(3.0 mmol/L);水杨酸-乙醇溶液(3.0 mmol/L);无水乙醇。橙皮苷标准品:购于中国药品生物制品检定所。以上试剂均为分析纯,实验用水均为二次蒸馏水。
1.2 方法
1.2.1 标准曲线的绘制
准确称取橙皮苷标准品5 mg,甲醇充分溶解并定容于50mL容量瓶中,得到橙皮苷标准储备液。分别准确吸取橙皮苷储备液 0.50、1.00、1.50、2.00、2.05、3.00、3.50、4.00 mL 置于 10 mL 容量瓶中,加入1.00 mL 5%的Al(NO3)3溶液,于80℃水浴中加热15 min后,冷却后定容至刻度。橙皮苷与 Al(NO3)3能形成黄色络合物,其最大吸收波长为390 nm,见图1。以试剂作空白,依次测定各溶液的吸光度,可得吸光度A与橙皮苷浓度c(μg/mL)的标准曲线回归方程为:A=0.003c+0.008,相关系数 R2=0.9990,见图2。试验表明,橙皮苷在5~40 μg/mL的浓度范围内有良好的线性关系。

图1 橙皮苷-Al络合物的吸收曲线

图2 橙皮苷的标准曲线
1.2.2 供试品溶液的制备和测定
准确称取5 g橘皮粉末,加入一定浓度的乙醇,回流提取。过滤后冷却,置250 mL容量瓶中定容至刻度,摇匀得提取液。精密移取一定体积提取液,置于10 mL容量瓶中,加入1.00 mL 5%的Al(NO3)3溶液,于80℃水浴中加热15 min后,冷却后定容至刻度,待测。由于橙皮苷样品未经脱色,本身含有杂质黄,在测定时设置试剂空白做对照,用总的吸光度值减去非黄酮类物质在390 nm下的吸光度值[7]。根据所得吸光度代入标准曲线方程,计算橙皮苷的含量及得率:

1.2.3 单因素试验
为确定橙皮苷的提取工艺,取定量橘皮,研究乙醇体积分数(50%~100%)、液料比(5∶1~30∶1 mL/g)、提取温度(40~90℃)及提取时间(1~3.5 h)4个因素对橙皮苷得率的影响,以确定优化设计参数范围。
1.2.4 响应面试验设计
基于单因素试验结果,以乙醇体积分数(X1)、液料比(X2),提取温度(X3)、提取时间(X4)为考察因素,以橙皮苷的得率为响应值,采用4因素3水平的Box-Behnken Design(BBD)试验设计,优化提取条件。
1.2.5 橙皮苷清除羟自由基的研究
参照文献[8]采用Fenton反应体系产生羟自由基模型。在反应体系中,H2O2与Fe2+混合反应产生·OH,但由于·OH具有很高的反应活性,存活时间短,若在反应体系中加入水杨酸,就能有效的捕捉·OH,并产生有色物质,该产物在510 nm处有强吸收。若在此反应体系中加入有清除·OH功能的被测物,便会与水杨酸竞争,从而使有色产物的生成量减少。
清除率/%=[A0-(AX-AX0)]/A0×100
式中:A0为空白对照液的吸光度;AX为加入被测物后的吸光度;AX0为不加H2O2的吸光度。
方法:在25 mL比色管中依次加入3.0 mmol/L FeSO4溶液2mL,3.0 mmol/L水杨酸-乙醇溶液2mL,2.5 mmol/L H2O22 mL,摇匀,蒸馏水定容至刻度,于37℃水浴中反应30 min,于510 nm处测定吸光度A0,在上述体系中不加H2O2的溶液测定得到AX0,分别加入不同体积的橙皮苷提取液测定吸光度为AX,所有溶液均以蒸馏水为参比。
2 结果与讨论
2.1 单因素试验
2.1.1 乙醇体积分数的影响
由图3所示,随着乙醇体积分数增大橙皮苷得率会逐渐增加,当乙醇体积分数为70%时得率最高,为4.79%。再继续增加乙醇体积分数时橙皮苷得率反而会降低,其原因可能是乙醇体积分数高,溶液所含的水分减少,不能充分浸入到橘皮里,导致得率下降[9]。因此选择乙醇体积分数为70%作后续试验继续考察。
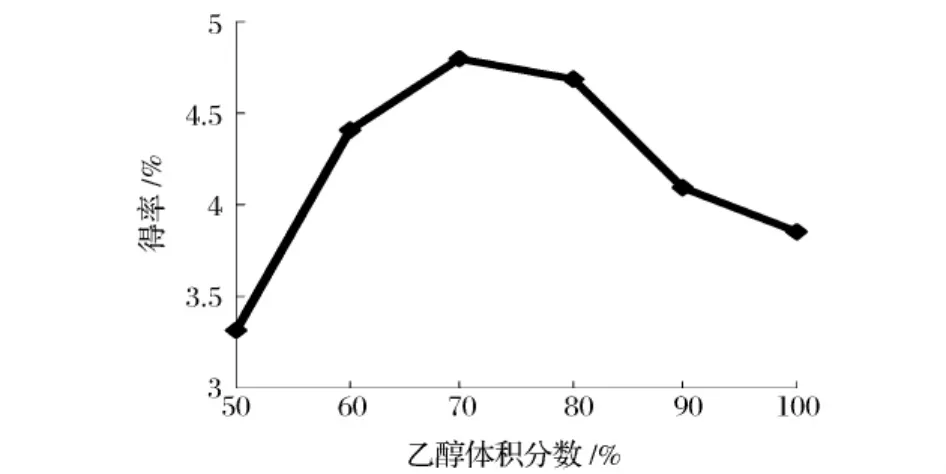
图3 乙醇浓度对得率的影响
2.1.2 不同液料比的影响
由图4可知,在液料比达到20∶1 mL/g前,橙皮苷得率随着提取液用量的增加而增加。料液比为20∶1 mL/g时,得率最大达4.73%。但再增加液料比,得率反而下降,这是因为溶剂用量达到一定程度时橘皮中橙皮苷已基本全部溶出,再增加溶剂的用量不仅增加成本,还会给后续的处理增加困难。因此选择液料比为20∶1 mL/g。
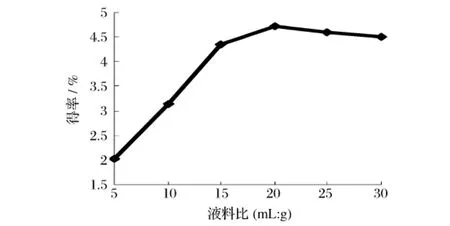
图4 液料比对得率的影响
2.1.3 提取温度的影响
温度越高,分子运动加速,溶剂提取效率越高。由图5可知,随着提取温度的增加,橙皮苷溶解度增大,得率增加,70℃时得率达4.77%。但温度高于70℃后得率呈下降趋势。可能是由于温度高而导致其它组分的溶解从而抑制了橙皮苷的溶出,同时高温也可能导致橙皮苷的结构被破坏。因此,试验选择为70℃为最佳的提取温度。

图5 提取温度对得率的影响
2.1.4 提取时间的影响
如图6所示,得率随着提取时间的增加而增加。当提取时间为2.5 h时,得率达4.62%。但提取时间超过2.5 h后,得率呈现下降趋势。提取时间较短时,橙皮苷来不及溶出,时间太长则可能会因为橙皮苷因长时间受热使结构发生变化,且随着提取时间的增加干扰成分的溶出量也随之增加,导致提取量下降。故试验选择提取提取时间为2.5 h。
2.2 响应面试验结果分析
2.2.1 橙皮苷提取工艺回归模型的建立及方差分析
在单因素试验基础上,进行4因素3水平的Box-Behnken Design(BBD)试验设计优化提取条件,试验因素水平及编码见表1。自变量的编码值1、0、-1分别代表自变量的高、中、低水平。选取了4因素3水平共29个试验点(5个中心点)的响应面分析试验,试验设计表格及试验结果见表2,回归模型的方差分析见表3。

图6 提取时间对得率的影响
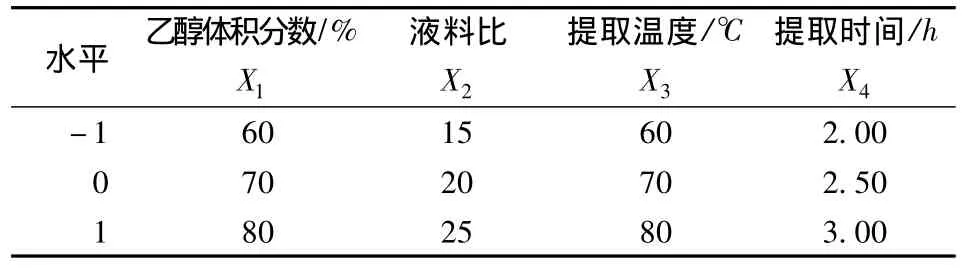
表1 响应曲面设计试验因素水平和编码

表2 响应曲面试验设计及结果
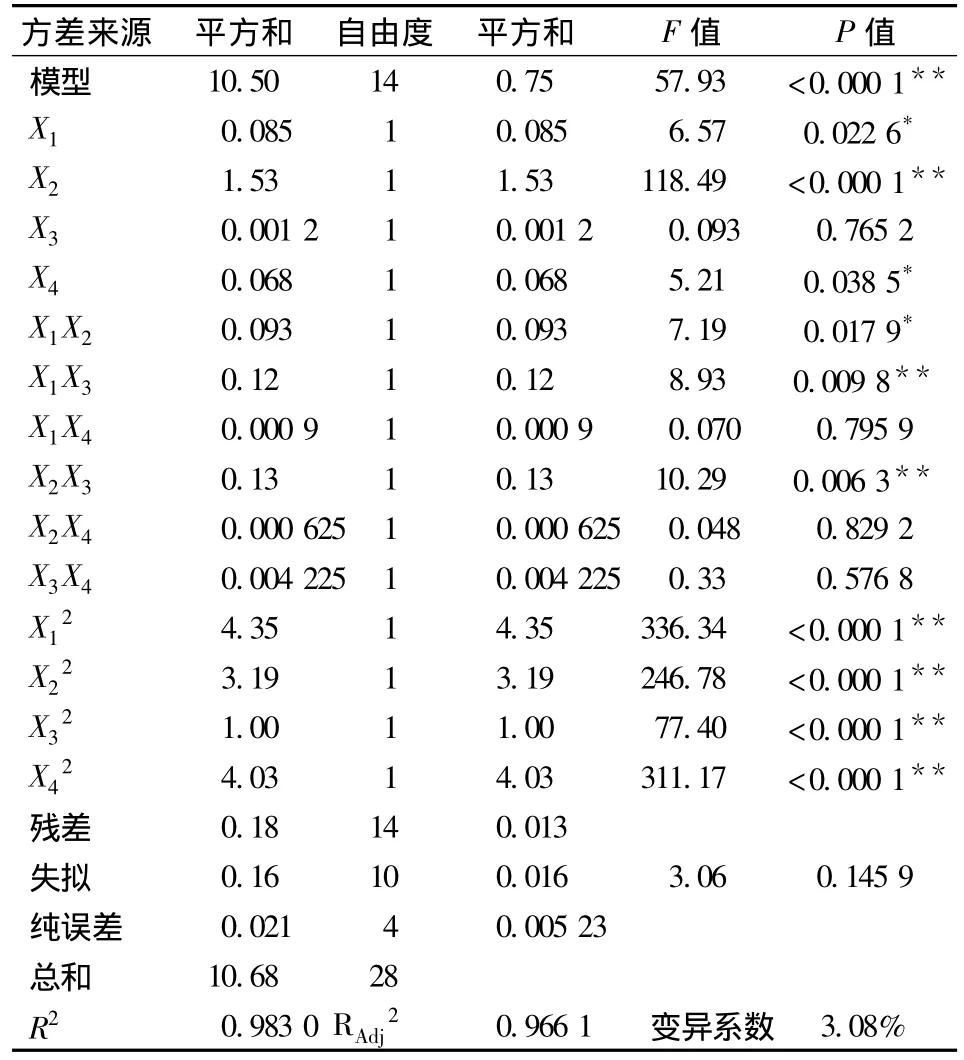
表3 回归模型的方差分析
对表2试验数据进行回归拟合,得到橙皮苷的得率对以上4个因素的二次多项回归模型为:
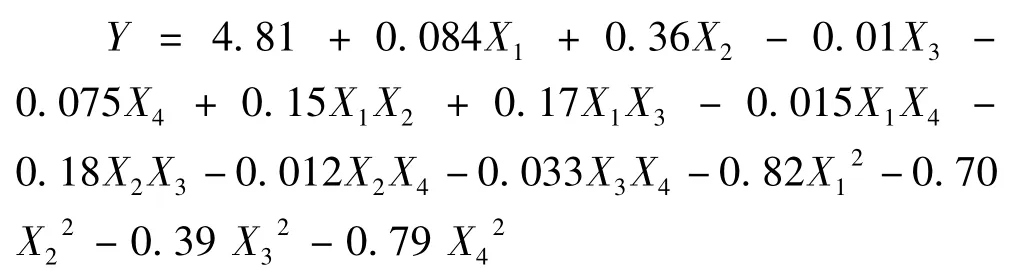
式中:Y为橘皮中橙皮苷的得率的预测值;X1、X2、X3、X4分别代表乙醇体积分数、液料比、提取温度、提取时间的编码值。表3方差结果显示,方程复相关系数的平方R2为0.9830,说明该模型极显著(P<0.01);为0.9661,说明建立的模型能够解释96.61%响应值的变化,能很好地描述橘皮中橙皮苷提取过程的得率随提取条件的变化规律。因此,该方程拟合情况合理可靠。从回归方程各项方差检验可以看出,方程的二次项的影响均极显著,交互影响显著,各一次项显著性参差不齐,表明各影响因素对橙皮苷得率的影响不是简单的线性关系,所以可以利用回归方程来确定最佳提取工艺条件。

图7 乙醇浓度(X1)、液料比(X2)、提取时间(X3)和提取温度(X4)对橙皮苷得率影响的响应面图
2.2.2 响应曲面分析与优化
各因素及其交互作用对响应值的影响结果可通过响应面分析图形象地看出来。特征值均为正值时,响应面分析图为山谷形曲面,有极小值存在;当特征值为负值时,为山丘曲面,有极大值存在;当特征值有正有负时,为马鞍形曲面,无极值存在[10]。从图7各因素间的响应曲面图可以看出,各图均为山丘曲面,即得率Y随着任意2个编码值的增加呈先升高后降低的趋势,说明各交互因子均有一个最佳编码组合使得率Y达到最高。
为了进一步确证最佳点的取值,对回归方程取一阶偏导数并令其等于零,可以得到曲面的最大点,即4个主要因素的最佳水平值,转换整理得到橙皮苷提取的最佳条件为乙醇体积分数70.7%,液料比为21.35 mL/g,提取温度为69.4℃,提取时间为2.48 h,在此条件下橙皮苷得率理论值可达4.86%。为检验响应面法所得结果的可靠性,采用上述优化提取条件进行橙皮苷的提取,考虑到实际操作的便利,将提取工艺参数修正为乙醇体积分数71.0%,液料比为22∶1 mL/g,提取温度为70℃,提取时间为2.5 h,实际测得橘皮中橙皮苷的得率为4.82%,与理论预测值比较相对误差为0.82%,说明该模型可以较好地预测橘皮中橙皮苷的提取条件与橘皮中橙皮苷的得率之间的关系,具有一定的实用价值。
2.3 橘皮中橙皮苷清除羟自由基的研究
不同浓度的橙皮苷提取液对·OH的清除结果见图8。试验表明,橙皮苷提取液对·OH有明显的清除作用。随着橙皮苷浓度的增加,对·OH的清除能力也逐渐增强,且二者间具有较好的相关性,回归方程Y=6.13X-11.801(R2=0.9778)。橙皮苷提取液对·OH的半清除率IC50=10.08 μg·mL,表明橙皮苷具有较强的抗氧化能力。
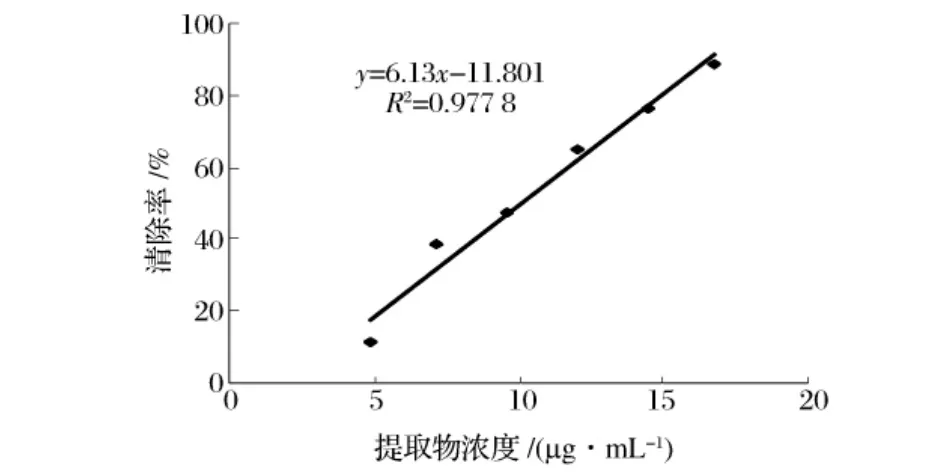
图8 橙皮苷提取液对羟自由基的清除率
3 结论
本文应用试验设计软件Design-Expert7.0,采用响应面设计中的Box-Behnken设计,利用模型的响应面及等高线对橘皮中橙皮苷提取工艺中的4个提取条件的相互作用进行了探讨,确定了最佳水平范围,优化出最优工艺条件为:以体积分数为71%的乙醇为提取溶剂,液料比22∶1 mL/g,在70℃下反应2.5 h,在此条件下橙皮苷的得率达4.82%。此外,橙皮苷提取液对羟自由基的清除作用说明,橙皮苷具有良好的抗氧化能力。
[1]方修贵,戚行江,胡安生.柑橘果实中抗癌活性物质的研究现状和前景[J〗.食品与发酵工业,2003,29(10):79-82.
[2]周建国,邵青,陈柳榕.陈皮提取工艺的优化选择[J].中国现代应用药学杂志,1998,15(2):17-18.
[3]梁开玉,罗启波,喻梅.从陈皮中提取橙皮苷工艺研究[J].重庆工商大学学报:自然科学版,2004,21(1):19-22.
[4]耿敬章,钱英,张志健,等.超声波辅助提取橘皮中橙皮苷[J].中国食品添加剂,2009,12(7):63-68.
[5]孙秀利,张力,秦培勇,等.微波法提取陈皮中橙皮苷[J].中药材,2007,30(6):712-714.
[6]曾柏全,周小芹,解西玉.纤维素酶-微波法提取脐橙皮橙皮苷工艺优化[J].食品科学,2010,34(4):85-89.
[7]陈建秋,胡志军,王南溪,等.枳实皮中橙皮苷的提取测定及对自由基清除作用的研究[J].时珍国医国药,2009,20(10):2394-2397.
[8]李贵荣,杨胜圆.党参多糖的提取及其对活性氧自由基的清除作用[J].化学世界,2001,42(3):421-422.
[9]陈晓伟,陈荣燕,韦媛媛等.碱提酸沉法提取枳实中橙皮苷的工艺优化[J].粮油加工,2010,4:109-112.
[10]Manoharcs G.An improved response surface method for the determination of failure probability and importance measures[J].Structural Safety,2004,26:123-139.
ABSTRACTFour factors including ethanol concentration,solvent to material ratio,extraction temperature and extraction time were studies on the yield of hesperidin from the citrus peel by using single factor analysis method.Then a four factor,three-level Box-Behnken central composite design(CCD)coupled with response surface analysis(RSM)was applied in optimization of the extraction.It was found that the optimum extraction conditions were:ethanol concentration 71%,solvent to material ratio 22∶1(mL/g),extraction temperature 70℃ and extraction time 2.5 h.Under the optimized extraction conditions,hesperidin extraction yield was 4.82%.The research on anti-oxidation properties showed that the extracted hesperidin had scavenging activity on free hydroxyl radical.
Key wordsresponse surface methodology,hesperidin,extraction technological conditions,hydroxyl free radical
Optimization of Total Hesperidin Extraction from Citrus Peel by Response Surface Methodology and Its Scavenging Activity on Free Hydroxyl Radial
Huang Fang1,Zhou Hong,Chen Hua2,Fu Qing-quan1
1(College of Biochemical Engineering and Environmental Engineering,Nanjin XiaoZhuang University,Nanjing 211171,China)
2(College of Chemistry and Chemical Engineering,Chongqing University,Chongqing 400030,China)
硕士研究生,讲师。
*国家自然科学基金(21171097);重庆市自然科学基金(2010BB0063)资助
2011-10-08,改回日期:2012-03-09

