黏质沙雷氏菌胞外几丁质酶的纯化及特性
施腾鑫,黄秀菁,刘嘉,贺淹才
1(福建福大百特科技发展有限公司酶高效表达国家工程实验室,福建福州,350000)
2(华侨大学工业生物技术研究所,福建泉州,362021)
黏质沙雷氏菌胞外几丁质酶的纯化及特性
施腾鑫1,黄秀菁1,刘嘉2,贺淹才2
1(福建福大百特科技发展有限公司酶高效表达国家工程实验室,福建福州,350000)
2(华侨大学工业生物技术研究所,福建泉州,362021)
黏质沙雷氏菌几丁质酶发酵上清液经硫酸铵沉淀、透析、DEAE-琼脂糖凝胶阴离子交换层析和苯基-琼脂糖凝胶疏水层析,得到电泳纯的几丁质酶和几丁质结合蛋白CBP21。该几丁质酶和CBP21分子质量分别约为58 ku和21 ku,CBP21对该几丁质酶水解几丁质增效明显。几丁质酶反应最适温度为50℃,最适pH约为6.5~7.0。该酶在55℃以下、pH 4.5~8.0范围内稳定。酶的Km值为0.22 mg/mL,Vm为1.26 μmol/(min·mg)。金属离子K+、Sn2+、Mn2+对酶有一定激活作用,而Pb2+、Hg2+和Cu2+则强烈抑制其活性。该几丁质酶的糖基含量约为3.3%。EDTA和2-ME可分别提高酶活力65%和105%。H2O2强烈抑制酶活力,提示其活性中心可能存在硫氢基。
黏质沙雷氏菌,几丁质酶,纯化,特性
几丁质(又称甲壳素)是N-乙酰-D-葡萄糖胺以2-1,4糖苷键连接起来的直链多聚物,是自然界中含量仅次于纤维素的可再生资源[1]。几丁质酶(Chitinase,EC3.4.1.14)分布广泛,几乎从微生物到高等动植物所有的生物类群中都有分布[2],其中产几丁质酶的微生物种类涵盖了细菌、放线菌和霉菌。但目前对几丁质纯品酶的研究报道尚少,已报道的得到纯化的胞外几丁质酶有绿色木霉、链霉菌、球孢白僵菌、产气肠杆菌、黄杆菌等[3-7],而且几乎所有对几丁质酶的纯化及特性的研究均集中于单酶,而未对酶或蛋白间的协同作用加以研究分析。在实际工业应用中,很多酶在降解底物上的协同作用极为明显,如纤维素酶[8]、阿魏酸酯酶[9]等,而针对几丁质酶在这方面的报道却较为罕见。因此本研究对1株黏质沙雷氏菌所产的胞外几丁质酶进行纯化,得到电泳纯几丁质酶和几丁质结合蛋白(CBP21),初步对该几丁质酶和CBP21的协同作用进行了研究,并对该几丁质酶的一系列特性进行分析探讨,对了解其结构和功能具有积极意义,为后续工作打下基础。
1 材料与方法
1.1 菌株
黏质沙雷氏菌(Serratia marcescens)分离自海滩土壤,本实验室保存。
1.2 SMCS 培 养基[10]
K2HPO4700 mg,KH2PO4300 mg,NaCl 300 mg,MgSO4·7H2O 500 mg,CaCl2300 mg,ZnSO410 mg,CoCl210 mg,FeSO4·7H2O 10 mg,胶体几丁质10 g,蒸馏水定容至1 L,pH 7.0~7.1。每250 mL三角瓶装量50 mL,8层纱布扎口。
1.3 主要试剂及仪器
几丁质、考马斯亮蓝R250、SDS、Glycin和TEMED等购自Sigma公司;低分子量标准蛋白为Takara公司产品;EDTA(乙二胺四乙酸)、DEPC(二乙基焦碳酸盐)、PMSF(苯甲基磺酰氟)、乙二醛(Glyoxal)、Ch-T(氯胺-T)、2-ME(β-巯基乙醇)均购自Sigma公司;其余试剂均为国产分析纯。
AKTA快速液相层析仪,GE;DEAE-Sepharose FF和Phenyl-Sepharose FF,Pharmacia;垂直板状电泳槽,Bio-Rad;高速冷冻离心机,Sigma;凝胶成像系统,上海天呈科技有限公司。
1.5 分析方法
1.5.1 几丁质酶活力测定
参照Nawani法[11],0.5 mL胶体几丁质与适当稀释的酶液0.5 mL于50℃水浴振荡反应1 h,用DNS法[12]测定。酶活力单位(U)定义为:在50℃下每分钟释放出相当于1 μmol N-乙酰葡萄糖胺(NAG)的还原糖所需要的酶量。
1.5.2 蛋白质含量测定
采用改进的Bradford法[13]。取100 μL样品液,加入5 mL考马斯亮蓝,30℃静置20 min后,于590nm和450 nm处分别测定吸光度值,以OD590/OD450为纵坐标,以标准蛋白浓度为横坐标。
1.5.3 电泳
采用垂直板状电泳,SDS-PAGE按标准方法进行[14]。
1.6 纯化步骤
分离纯化过程所用缓冲液均为pH 7.0、0.02 mol/L的Tris-HCl缓冲液;冷冻离心条件均为4℃,8000 r/min,15 min。
1.6.1 硫酸铵盐析
将培养液于冷冻离心,所得上清液即为粗酶液。70%饱和度硫酸铵沉淀,4℃静置过夜。冷冻离心弃上清,沉淀溶解于缓冲液中,100倍体积于相同体系中透析48 h除盐,每12 h更换1次缓冲液。
1.6.2 DEAE琼脂糖凝胶阴离子交换层析
离子交换柱为DEAE-琼脂糖凝胶柱(1 mL)。将上清液加到琼脂糖凝胶离子交换柱,用含有0~0.5 mol/L NaCl的缓冲液梯度洗脱(pH7.2,流速1 mL/min)。
1.6.3 苯基-琼脂糖凝胶疏水层析
疏水层析柱为苯基-琼脂糖凝胶柱(1 mL)。将活力组分冷冻干燥浓缩后,加硫酸铵至终浓度为1mol/L上苯基-琼脂糖凝胶疏水柱,用不含硫酸铵和含1 mol/L硫酸铵的缓冲液进行梯度洗脱(流速1 mL/min)。
1.7 酶学特性
1.7.1 表观相对分子量的测定
SDS-PAGE法测定相对分子量。
1.7.2 几丁质酶与几丁质结合蛋白的协同性
将纯化得到的几丁质酶与CBP21以一定比例混合,按标准方法测定酶活力。以不含CBP21的酶液作为对照,研究几丁质酶和CBP21对底物作用的协同性。
1.7.3 最适反应温度及热稳定性
在不同温度下按照标准方法测定酶活,以酶活最高者为100%。酶液在30~80℃下保温不同时间后,按标准方法测残余酶相对活力,以未保温的酶液的酶活力为100%。
1.7.4 酶的最适反应pH及酸碱稳定性
将酶液分别加在pH3.0~10.0的缓冲液中,按标准方法测定酶活力,以酶活最高者为100%。将酶液用不同pH的缓冲液稀释,50℃保温1 h后,测残余酶活力,以未保温的酶液的酶活力100%。
1.7.5 动力学参数测定
将酶液与不同浓度的几丁质反应后测定其酶活力。用Lineweaver-Burk双倒数作图法求出该酶的Km及Vm值[12]。
1.7.6 金属离子对酶活力的影响
用0.1mol/L的 Na2HPO4-柠 檬 酸 缓 冲 液(pH6.5)配制含5 mmol/L的金属离子缓冲液,与0.5 mL酶液50℃和1%胶体几丁质混匀,50℃反应1h后测定几丁质酶活力,以不含金属离子的反应液为对照。
1.7.7 底物特异性
在反应体系中以不同底物进行几丁质酶的酶解反应,按标准方法测定酶活力。
1.7.8 修饰实验
加入不同浓度的蛋白修饰剂于酶液中,调整至所需的终浓度,按标准方法测定酶活力。
1.7.9 糖基含量测定
采用乙酸乙酯-蒽酮-浓硫酸法[15-16]测定。利用由葡萄糖、甘露糖、鼠李糖等10种糖配制成混合糖溶液获得标准曲线。将酶液按要求加入一定量的乙酸乙酯-蒽酮混合液及浓硫酸,室温反应30 min后于620 nm比色测定,结合糖基含量标准曲线进行计算得出糖基含量(w/w)。
2 结果与分析
2.1 几丁质酶的分离纯化
2.1.1 DEAE-琼脂糖凝胶阴离子交换层析
黏质沙雷氏菌在SMCS培养基中振荡培养3天后,发酵液冷冻离心后通过硫酸铵沉淀、透析及DEAE琼脂糖凝胶离子交换层析,得到图1。有3个吸收峰,峰1的几丁质酶活力高蛋白集中,收集峰1处的活性组分进行电泳检测,发现有2条蛋白带。将收集到的组分浓缩后上苯基-琼脂糖凝胶疏水柱。
2.1.2 苯基-琼脂糖凝胶疏水层析
经离子交换层析后得到的样品上疏水柱后,用不含硫酸铵和含1 mol/L硫酸铵的缓冲液进行梯度洗脱,洗脱图谱见图2。在纯化过程中出现2个蛋白峰。通过酶活力测定,几丁质酶活力集中在峰2。收集峰2处活性液进行SDS-PAGE检测。纯化结果见表1。

图2 苯基-琼脂糖凝胶疏水柱层析图
2.1.3 酶纯度鉴定及实验结果分析
SDS-PAGE结果如图3所示,经盐析、DEAE-琼脂糖凝胶离子交换层析和苯基-琼脂糖凝胶疏水层析后所得的几丁质酶已达电泳纯。该酶分子质量为58 ku。此外,对疏水层析中收集到的峰1的蛋白液进行SDS-PAGE,亦呈单一条带,分子质量为21 ku。该蛋白无酶活性;将其与胶体几丁质混合于4℃下静置1h后离心,得到的上清中几乎不存在蛋白,表明该蛋白与几丁质结合力强;将该蛋白与纯化的几丁质酶混合,发现其对酶解几丁质有增效作用。这些特征与Kazushi等人[17]的研究结果一致。将几丁质结合蛋白和几丁质酶根据Brurberg的报道[18]进行对比,该几丁质酶和几丁质结合蛋白可能分别为ChiA和CBP21。

图3 几丁质酶SDS-PAGE电泳图谱
2.1.4 纯化结果
分别测定纯化各步骤的酶活力和蛋白量,求出纯化后的比活力、产率以及纯化倍数,纯化结果详见表1。发酵液经盐析、DEAE-琼脂糖凝胶离子交换层析和苯基-琼脂糖凝胶疏水层析后,得到纯酶,比活力由粗酶液的43.07 U/mg提高到纯酶液的1575.76 U/mg,纯化36.6倍,收率8.5%。但在纯化过程中,随着蛋白样品组分中的抑制成分或促进成分的逐步移除,酶的活力会得到较大的提升或降低。因此对于某些酶样品,根据比活力来推算纯化倍数和收率的方法,只能作为粗略方案[19]。

表1 几丁质酶纯化过程
2.2 酶学特性
2.2.1 几丁质酶与几丁质结合蛋白的协同性
将几丁质酶与CBP21以不同比例混合后测定酶活力,研究二者对底物作用的协同性,结果见图4。随着CBP21的浓度的比率的增加,几丁质酶水解效果显著增强,相对酶活力最高可达365%。这可能由于CBP21首先与底物结合,从而使底物呈现出易于被几丁质酶水解的构象[20],从而提高了酶的水解效率。

图4 几丁质酶与CBP21水解胶体几丁质的协同性
2.2.2 最适反应温度及温度稳定性
在不同温度下测定几丁质酶活力,并将几丁质酶分别保温1 h后,测定残留酶活力,结果见图5。在30℃~50℃之间,随着反应温度的升高,水解效率显著增加,50℃为酶反应最佳温度,55℃时酶活力约下降50%,70℃时酶基本失活。将酶液保温1h后按标准方法测定酶活力,酶在30~55℃较为稳定,温度大于55℃时酶活力迅速下降,超过65℃酶基本失活。
2.2.3 最适反应pH及酸碱稳定性
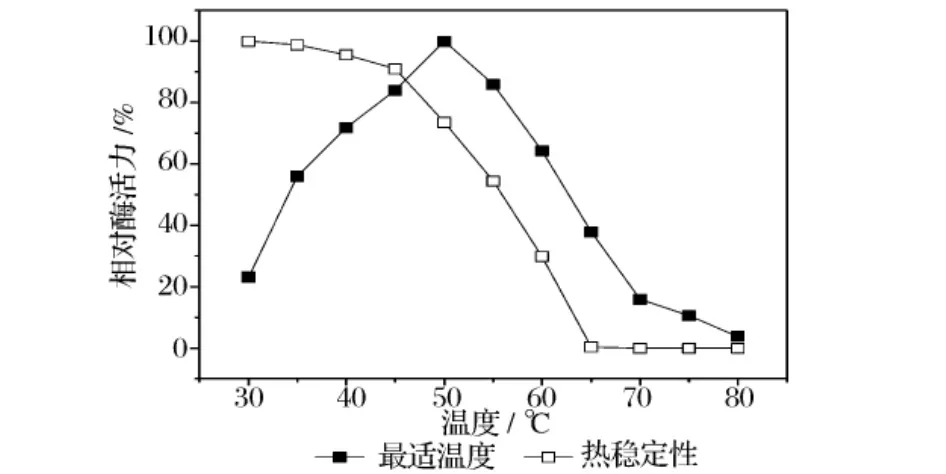
图5 温度对几丁质酶活力的影响及热稳定性
在不同pH值的缓冲液体系中测定几丁质酶活力,并将几丁质酶在不同pH的体系中放置1h后测定酶活力,结果见图6。pH 4.5~6.5时,相对酶活力在75%以上,pH 6.5左右时酶活力最高。当pH为10.0时,该几丁质酶活力仍能保持50%以上。在不同pH环境下放置1 h后测定残余酶活力发现,该酶在pH4.5~8.0,可以保持原来酶活力的50%以上,当pH低于4.5或高于8.0时酶活力迅速丧失。
2.2.4 动力学参数测定
将胶体几丁质溶于Na2HPO4-柠檬酸缓冲液(0.02 mol/L,pH 6.5)中,配成0.2~10.0 mg/mL浓度,以相同酶浓度进行反应。由Lineweaver-Burk作图法计算米氏常数,该酶的Km和Vm值分别为0.22 mg/mL和1.26 μmol/(min·mg)。

图6 pH对几丁质酶活力的影响及酸碱稳定性
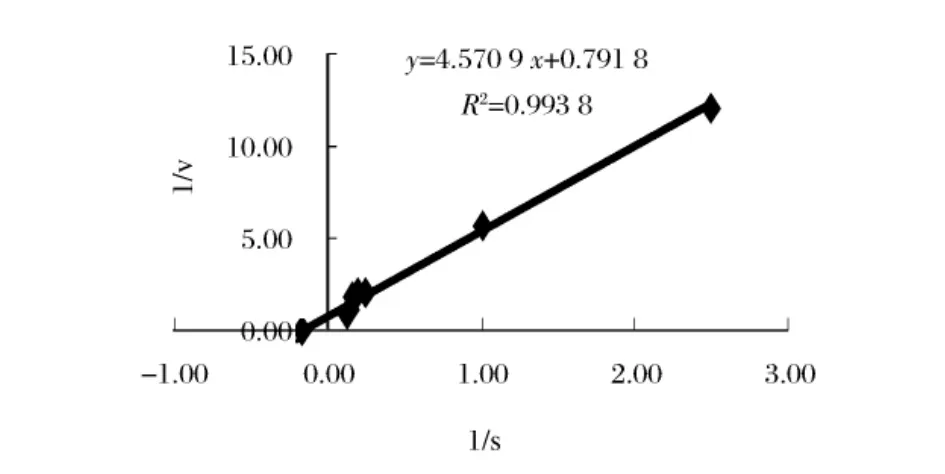
图7 黏质沙雷氏菌几丁质酶的Lineweaver-Burk图
2.2.5 金属离子对酶活力影响
在反应体系中加入不同金属离子,使其终浓度为5 mmol后,按标准方法测定几丁质酶活力,结果见表2。金属离子K+、Sn2+、Mn2+对几丁质酶酶活性有一定激活作用,而Pb2+、Cu2+和Hg2+则强烈抑制该几丁质酶活性,其中更以Hg2+抑制作用最强。

表2 不同金属离子对酶活力的影响
2.2.6 几丁质酶的底物特异性
分别以胶体几丁质、水溶性壳聚糖、微晶纤维素、羧甲基纤维素和天然虾壳粉(过60目筛)为底物测定酶活力,底物浓度均为1%,结果如图8所示。该几丁质酶对胶体几丁质具有较高的底物特异性,对天然虾壳粉的降解能力也较好。此外,该酶还有一定的壳聚糖酶活性。
2.2.7 酶的蛋白修饰
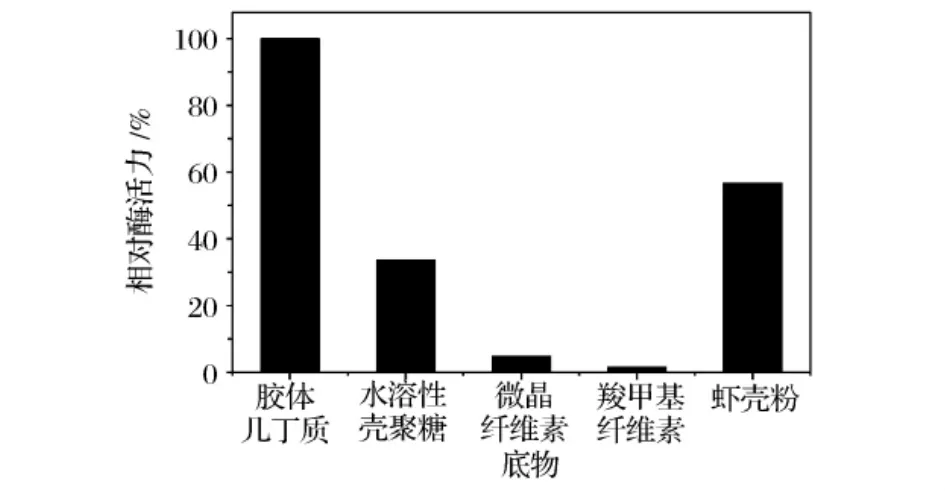
图8 几丁质酶的底物特异性
在反应体系中加入一定量的蛋白修饰剂,调整至所需的终浓度(0.3%,0.5%,0.8%,1.0%,1.5%,v/v或w/v),测定几丁质酶活力,结果如图9所示。结果表明,在所示的浓度下,DEPC对该几丁质酶有轻微的激活作用。EDTA和2-ME显著提高酶活力,最高促进率分别可分别提高65%和105%,表明该酶为非金属酶,活性中心不存在二硫键;PMSF和DEPC对酶活力没有明显影响,说明酶的活性中心不存在丝氨酸和组氨酸;H2O2强烈抑制酶活性,此外该酶也被Hg2+强烈抑制,说明该几丁质酶对氧化剂极为敏感,提示其活性中心可能存在硫氢基;CH-T和乙二醛使酶发生了一定程度的钝化,可能是由于CHT和乙二醛修饰了该酶活性中心以外的蛋氨酸残基和精氨酸残基而间接导致酶的空间构象发生改变。

图9 不同修饰剂对几丁质酶活力的影响
2.2.8 糖基含量测定
将纯化得到的纯酶采用乙酸乙酯-蒽酮-浓硫酸法对糖基含量进行测定,测得糖基含量约为3.3%。多数真菌所产几丁质酶的糖基含量较高,使得该酶显著区别于真菌几丁质酶。
3 结论
几丁质酶是一类差异较大的水解酶类,一些文献已报道了不同来源的几丁质酶的分离纯化及性质研究[4-7]。本文在几丁质酶的相对分子量、反应温度、耐酸碱性以及金属离子对酶活力的影响等方面进行了研究,与已报道纯化的黏质沙雷氏菌胞外酶[21]相比较差异较为显著。此外,本文还对几丁质酶与几丁质结合蛋白(CBP21)的协同作用、底物特异性、活性中心基团以及糖基含量方面作了研究。结果表明,CBP21对该几丁质酶有显著增效作用,可使该酶对底物的催化效率提高365%;该几丁质酶的糖基含量低,酶活力可被EDTA和2-ME试剂显著提高等特性使得该酶显著区别于一些真菌几丁质酶[22-24];该几丁质酶对天然虾壳粉的作用效果较好,表明该酶在实际应用中有着较好的应用价值。
在纯化过程的离子交换步骤中的第2个洗脱峰的蛋白液也存在酶活力。通过SDS-PAGE检验,其目的条带与主峰不同,应属于不同的几丁质酶,但由于酶活力低蛋白含量较少,故未予收集。因此,为了研究不同几丁质酶之间的协同作用,应构建含不同几丁质酶基因的工程菌以纯化出相应的几丁质酶,研究其对几丁质的水解机理以及协同增效的最适配比,为提高几丁质酶的热稳定性和酸碱稳定性而进行的固定化混合酶研究工作研究奠定基础。
[1]Berkeley R C W.In Microbial Polysacchardes and Polysaccharases[M].London,New York and San Francisco:Academic Press,1979:205-236.
[2]Felse P.A,Panda T.Production of microbial chitinases-a revisit[J].Bioprocess Engineering,2000,23:127-137.
[3]Crispinus A Omumasaba,Naoto Yoshida,Kihachiro Ogawa.Purification and characterization of a chitinase from Trichoderma viride[J].General and Applied Microbiology,2001,47:53-61.
[4]杨文博,冯波,佟树敏.链霉菌SO1菌株几丁质酶的纯化及性质[J].微生物学通报,1997,24(2):84-88.
[5]彭仁旺,管考梅,黄秀梨.球孢白僵菌两种胞外几丁质酶的诱导和纯化[J].微生物学报,1996,36(2):103-108.
[6]唐亚雄,赵建,丁诗华,等.产气肠杆菌几丁质酶的分离纯化及性质研究[J].2000,41(1):82-86.
[7]陈三凤,李季伦.黄杆菌(Flavobacterium sp.)几丁质酶的纯化和性质[J].微生物学报,1994,34(1):14-19.
[8]王春卉,汪天虹.纤维素酶分子的纤维素吸附区的研究进展[J].纤维素科学与技术,1997(4):1-10.
[9]薛枫,欧仕益,汪勇.双酶法降解细胞壁物质制备低聚木糖和阿魏酸研究进展[J].粮食与饲料工业,2005(5):28-30.
[10]Di Pietro A,Lorito M,Hayes C K.Endochitinase from Glioclad iumvirens:Isolation,characterization,and synergistic antifungal activity in combination with gliotoxin[J].Phytopathology,1993,83:308-313.
[11]Nawani N N,Kapadnis B P,Das A D,et al.Purification and characterization of a thermophilic and acidophilic chitinase from Microbispora sp.V2[J].Journal of Applied Microbiology,2002,93(6):965-975.
[12]张龙翔,张庭芳,李令媛.生化实验技术[M].北京:高等教育出版社,1997:111-116;165-171.
[13]Tsaffrir Zor,Zvi Selinger.Linearization of the Bradford Protein Assay increases its sensitivity:theoretical andexperimental studies[J].Analytical Biochemistry,1996,236:302-308.
[14]夏其昌.蛋白质化学研究技术与进展[M].北京:科学出版社,1997:102-107.
[15]张树政,孟广震,何忠效.酶学研究技术[M].北京:科学出版社,1987:86-98.
[16]吴凯,代泽友,马波,等.改进的蒽酮法检测肺炎链球菌荚膜多糖结合物中多糖浓度[J].中国生物制品学杂志,2007,20(7):538-549.
[17]Kazushi Suzuki,Taku Uchiyama,Megumi Suzuki,et al.LysR-type Transcriptional Regulator ChiR Is Essential for Production of All Chitinase and a Chitin-Binding Protein,CBP21,in Serratia marcecsens 2170[J].Bioscience,Biotechnology and Biochemistry,2001,65(2):338-347.
[18]May Bente Brurberg,Bjornar Synstad,Sonja Sletner Klemsdal,et al.Chitinases from Serratia marcescens[J].Manuscript Recent Research Developments in Microbiology.2000.12.14.
[19]Richard R.Burgess,Murray P.Deutscher.Guide to Protein Purification(Second Edition)[M].Beijing:Science Press,2009:10-19.
[20]Kazushi Suzuki,Megumi Suzuki,Mayumi Taiyoji,et al.Chitin Binding Protein(CBP21)in the Culture Supernatant of Serratia marcescens 2170[J].Bioscience,Biotechnology and Biochemistry,1998,62(1):128-135.
[21]陈明,孙昌魁,程剑锋,等.黏质沙雷氏菌L15-2几丁质酶的分离纯化与性质研究[J].生物加工过程,2006,4(2):15-19.
[22]杨革,陈洪章,李佐虎.绿僵菌几丁质酶的分离纯化及性质[J].化工学报,2005,56(4):672-676.
[23]Kihachiro Ogawa,Naoto Yoshida,Ryuichiro Ikeda,et al.Purification and characterization of a novel chitinase from Burkholderia cepacia strain KH2 isolated from the bed log of lentinus edodes,shiitake mushroom[J].The Journal of General and Applied Microbiology,2002,48(1):25-33.
[24]Woo S,Fogliano V,Scala F,Lorito M.Synergism between fungal enzymes and bacterial antibiotics may enhance biocontrol[J].Antonie van Leeuwenhoek,2002,81(1/4):353-356.
ABSTRACTAn extracellular chitinase and a chitin-binding protein(CBP21)were isolated from the culture of Serratia marcescens and purified to electrophoretic homogeneity by ordinal procedures containing ammonium sulfate precipitation,DEAE-Sepharose and Phenyl-Sepharose chromatography.Their relative molecular masses were estimated to be respectively about 58kD and 21kD by SDS-PAGE.CBP21 had great synergistic effect with the chitinase on chitin hydrolysis.The optimum temperature and pH for the enzyme activity were 50℃and 6.5 respectively.The enzyme activity was stable under 55℃and in the pH range of 4.5~8.0.Michaelis constants of the enzyme were Km 0.22 mg/mL and Vm 1.26 μmol/(min·mg)respectively.The activity was enhanced by K+,Sn2+and Mn2+and was strongly inhibited by Pb2+,Hg2+and Cu2+.EDTA and 2-mercaptoethanol(2-ME)enhanced the activity by 65%and 105%respectively.H2O2strongly inhibited chitinase activity,which indicated that hydrosulfide group was the possible essential residue for enzyme activity.
Key wordsSerratia marcescens,chitinase,purification,characterization
Purification and Characterization of Extracellular Chitinase from Serratia marcescens
Shi Teng-xi1,Huan Xiu-jing1,Liu Jia2,He Yan-cai2
1(National Engineering Laboratory for High Effective Enzyme Express in Fujian Fuda Biotech,Ltd.,Fuzhou 350002,China)
2(Institute of Industrial Biotechnology,Huaqiao University,Quangzhou 362021,China)
硕士,(贺淹才教授为通讯作者)。
2012-03-05,改回日期:2012-05-20

