蜂王浆醇溶性成分分析及其抗氧化性研究
陈波,徐德平
(江南大学食品学院,江苏无锡,214122)
蜂王浆醇溶性成分分析及其抗氧化性研究
陈波,徐德平
(江南大学食品学院,江苏无锡,214122)
蜂王浆经体积分数95%乙醇提取、MCI-Gel、ODS等反相色谱柱分离,得到单磷酸腺苷(AMP)和7种脂肪酸。采用1,1-二苯基苦基苯肼自由基(DPPH·)清除率和总抗氧化能力试剂盒(T-AOC)等方法探索蜂王浆醇溶性物质的抗氧化能力,结果表明:蜂王浆醇提后抗氧化活性提高,分离得到的AMP和3,10-二羟基癸酸(3,10-DDA)的抗氧化性相对较强,且清除DPPH·的IC50值分别为6.274 mg/mL和9.153 mg/mL,是蜂王浆中的抗氧化活性物质。
蜂王浆,分离,结构鉴定,抗氧化
蜂王浆(royal jelly,RJ)是5~15日龄的工蜂舌腺和上腭腺分泌的一种浆状物质,呈乳白色或淡黄色,有酸涩味,是蜂王幼虫整个发育期和雄蜂幼虫前期的唯一食物。蜂王浆除含有大量的蛋白质(占干物质的36%~55%)、糖类(20%以上)外,还有包括10-HDA在内的许多活性物质[1]。蜂王浆具有增强机体免疫力,延缓衰老,抗肿瘤,抗菌消炎等生理活性,广泛应用于医药、化妆品、保健食品[2]。
目前关于蜂王浆抗氧化能力的研究主要集中在蜂王浆抗氧化活性肽[3]和超氧化物歧化酶 SOD[4]上,对蜂王浆中蛋白质和肽以外的其他物质的抗氧化性研究较少。本研究用高浓度乙醇沉淀了蜂王浆中绝大部分蛋白,对得到的蜂王浆醇溶性物质进行了分离及结构鉴定,并研究了各组分及单一成分的抗氧化能力,旨在发现蜂王浆的其他抗氧化活性物质。
1 材料与方法
1.1 材料和试剂
蜂王浆,购于南京老山药业有限公司;GF254硅胶板,由山东烟台芝罘化工厂生产;总抗氧化能力(TAOC)试剂盒,南京建成生物科技有限公司生产;1,1-二苯基-2-苦基苯肼自由基(DPPH·),Sigma公司提供;其他试剂皆为分析纯,上海国药集团化学试剂有限公司生产。
1.2 仪器和设备
旋转蒸发器 RE52CS,上海亚荣生化仪器厂;暗箱式紫外透射仪ZF-90,上海顾村电光仪器厂;HL-2恒流泵,上海沪西分析仪器厂有限公司;Brucker AVance500核磁共振仪、LCQ型质谱仪,Thermo-Finnegan公司;TU-1900型双光束紫外可见分光光度计,北京普析通用仪器有限责任公司;循环水多用真空泵(SHB-III),郑州长城科贸有限公司;HH-4数显恒温水浴锅,江苏省金坛市荣华仪器厂。
1.3 实验方法
1.3.1 蜂王浆中醇溶性物质提取
蜂王浆10 kg,组织捣碎机捣碎,以体积分数95%乙醇为溶剂,料液比1∶4(g∶mL),40℃提取3h,3000 r/min离心30 min,将沉淀物按上述方法重复提取2次,合并3次提取液,减压回转蒸发浓缩,得到蜂王浆醇提物(ethanol extracts of royal jelly,ERJ)。另将蜂王浆乙醇提取后沉淀物(precipitate from royal jelly,PRJ)浓缩至干,备用。
1.3.2 蜂王浆醇提物的分离
ERJ浓缩后过MCI-Gel柱(6 cm×100 cm),流速15 mL/min,依次用去离子水、体积分数10%、30%、50%、70%、95%乙醇溶液梯度洗脱,洗出液用锥形瓶收集。TLC薄层层析法跟踪检测洗脱液,根据Rf值将洗脱液粗分为水洗脱部分(A)、10%乙醇洗脱部分(B)、30%乙醇洗脱部分(C)、50%和70%乙醇洗脱部分(D)4个部分,95%乙醇洗脱部分由于固形物量少不做研究。减压浓缩A、B、C、D 4部分,每部分取少量干燥备用。
1.3.3 MCI-Gel柱分离后各组分的成分分离与鉴定
将A、B、C、D 4个部分分别反复上 ODS-AQ(3 cm×100 cm)、ODS-A(3 cm×100 cm)、ODS-B(3 cm×100 cm)等色谱柱分离,用乙醇溶剂梯度洗脱,收集洗脱液,15 mL/管自动收集,采用TLC薄层法检测,最终得到8种化合物。以二甲基亚砜为溶剂,四甲基硅烷(TMS)为内标物,化合物经氢谱(1H-NMR)和碳谱(13C-NMR)等光谱数据分析,确定其化学结构。
1.3.4 抗氧化活性实验
1.3.4.1 清除DPPH·自由基能力
准确称取7.8 mg DPPH·,用无水乙醇定容于100 mL容量瓶中,得到0.2 mmol/L DPPH·溶液。将待测样品冷冻干燥,分别制成 1、3、5、10、15 mg/mL等浓度溶液备用。参考Sun等人[5]的方法进行测定:分别取待测样品和对照物各2 mL,各加入2 mL 0.2 mmol/L的 DPPH溶液,充分混匀,避光反应30 min后在517 nm处测吸光度(Ai);同时,取各待测样品2 mL,分别加入2 mL无水乙醇,充分混匀,测其在517 nm处的吸光度(Aj);测定空白对照在517 nm处的吸光度(Ac)。每个样品3次重复,取平均值。
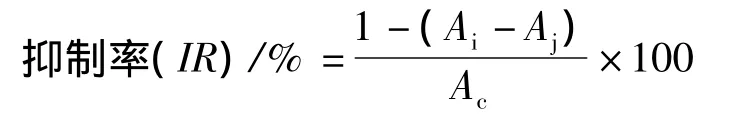
1.3.4.2 总抗氧化能力(T-AOC)
配制10 mg/mL试样,按照T-AOC试剂盒说明进行操作,在520 nm处测吸光度。试验重复3次,取平均值。本实验以样品管与对照管在520 nm处的吸光度的差值(ΔA520)大小来反应其总抗氧化能力,差值越大,总抗氧化能力越强。
2 结果与讨论
2.1 蜂王浆中不同组分的抗氧化活性
2.1.1 蜂王浆提取物对DPPH·清除率的测定
DPPH·是一种稳定的自由基,在517 nm处有强吸收。当有自由基消除剂存在时,DPPH·的单电子被配对而使其颜色变浅,在最大吸收波长处的吸光度变小,且这种颜色变浅的程度与配对电子数是成化学计量关系的[6]。因此通过检测517 nm处吸光度的变化,可以反映其消除自由基的能力,而能力的大小用抑制率表示。蜂王浆中不同组分的DPPH·清除能力如图1所示。
蜂王浆醇提物(ERJ)清除DPPH·能力提高,而醇提后沉淀物(PRJ)的DPPH·清除率较低,表明蜂王浆中具有清除DPPH·能力的物质主要存在于ERJ中。ERJ经MCI-Gel柱分离后,水洗脱部分(A)和10%乙醇洗脱部分(B)的DPPH·清除率高于ERJ,分别达到了68.9%和50.1%,C、D清除率比ERJ低。
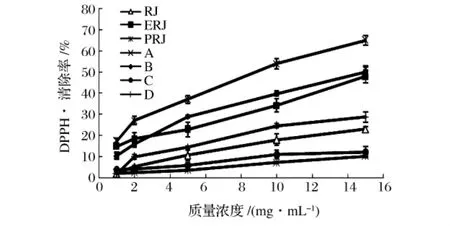
图1 蜂王浆中不同组分清除DPPH·能力
2.1.2 蜂王浆提取物总抗氧化能力(T-AOC)的测定
对总抗氧化能力的测定时利用抗氧化物质能使Fe3+还原成Fe2+,Fe2+可与菲林类物质形成稳定的络合物的性质,通过比色法可以测定样品抗氧化能力的强弱。测定管与对照管吸光度差值越大,抗氧化能力越强。考察各蜂王浆提取物在相同浓度下的总抗氧化能力,结果见图2。
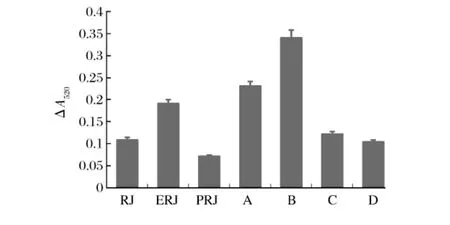
图2 蜂王浆中不同组分总抗氧化能力
由图2可知,相同浓度下,各组分的总抗氧化能力强弱顺序依次为:B>A>ERJ>RJ>C>D>PRJ。这与清除DPPH·能力相一致,表明蜂王浆中抗氧化活性物质溶于乙醇,且主要集中在组分A、B中。
2.2 MCI-Gel柱分离后各组分的成分
将 ERJ经 MCI-Gel柱分离,得到 A、B、C、D4个组分,各组分再经ODS-AQ、ODS-B等反相色谱柱柱分离,得到8种化合物,结果见表1。
由表1,从A、B、C、D中分别分离得到2种化合物,其中化合物2~8为脂肪酸。通过TLC法检测,得知这8种化合物的Rf值依次增大,说明化合物1~8的极性是逐渐变小的。其中,A中分离出的化合物1(AMP)是生物体代谢的能量源泉,是参与遗传信息贮存、遗传与表达的核酸构件,RJ中含量在5.9~2057.4 mg/kg[7];化合物 6,又称王浆酸,目前只发现在蜂王浆中存在,占新鲜蜂王浆的1.4%~2.0%,是蜂王浆中的标志性物质[8]。化合物 2、5、6、7、8 是 RJ中的短链脂肪酸,这些脂肪酸是RJ中一组特殊的C10羟基脂肪酸[9],Dragana Vucevic等曾报道 RJ中的短链脂肪酸对机体具有免疫调节作用[10]。
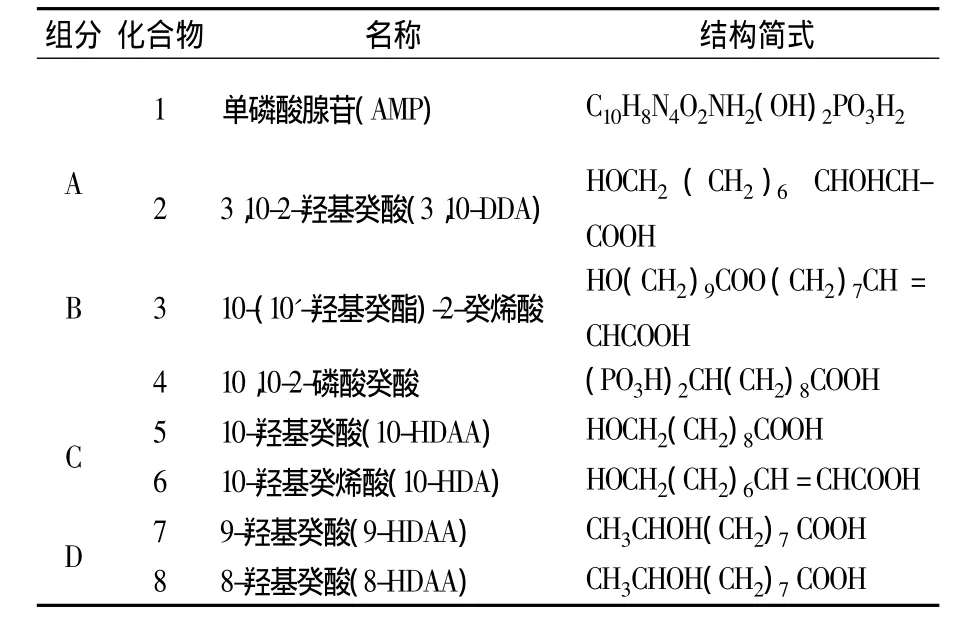
表1 ERJ色谱柱柱分离结果
2.3 蜂王浆醇溶性物质中各单一成分的抗氧化活性分析
由于分离得到的化合物在含量上有较大差异,有些化合物量较少无法进行活性试验,所以本研究对磷酸腺苷、3,10-2-羟基癸酸(3,10-DDA)、王浆酸(10-HDA)、10-羟基癸酸(10-HDAA)、9-羟基癸酸(9-HDAA)、8-羟基癸酸(8-HDAA)等6种物质进行了抗氧化活性的分析。
2.3.1 蜂王浆醇溶性物质中单一成分清除DPPH·自由基能力的测定
对蜂王浆醇溶性物质中分离得到的6种物质进行清除DPPH·能力的测定。结果见图3。
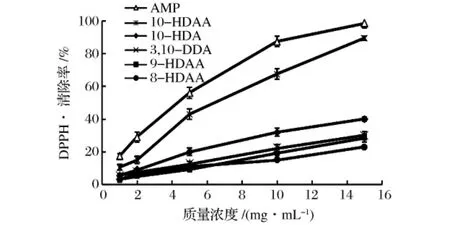
图3 蜂王浆醇溶物中各成分清除DPPH·能力
由图3可见,每种物质对DPPH·均具有一定的清除能力,且随着各物质的浓度增加,对DPPH·的清除能力也逐渐增加,具有良好的剂量效应关系。在浓度15 mg/mL时,10-HDAA、9-HDAA、8-HDAA 等的DPPH·清除率较低,均未达到30%,而AMP和3,10-HDAA在15 mg/mL时清除率分别达到了89.1%和78.3%。经计算,AMP的IC50值为6.274 mg/mL,3,10-DDA 的 IC50值为9.153 mg/mL。
2.3.2 总抗氧化能力(T-AOC)
对蜂王浆醇溶性物质中分离得到的6种物质进行总抗氧化能力的测定。结果见图4。

图4 蜂王浆醇溶性中各组分总抗氧化能力
由图4可知,AMP和3,10-DDA的总抗氧化能力很高,比较图2分别约是RJ抗氧化能力的3.4倍和6.5倍。另外,由于A的总抗氧化能力比B强,而A中分离出来的AMP的总抗氧化能力比B中的3,10-DDA弱,有理由相信A中有其他高抗氧化活性物质存在,可能是小分子物质BHT[11]或者一些酚类物质[12],需要作进一步研究。10-HDA虽然是蜂王浆的标志物质,具有生物活性,但其抗氧化能力比较弱,这与Yoshimi等的研究结果一致[13]。
3 结论
蜂王浆经体积分数95%乙醇提取所得的醇溶性成分抗氧化活性比原浆强,而醇提后的沉淀物抗氧化活性很低。经MCI-Gel、ODS等反相色谱柱分离,发现醇溶性物质中含有 AMP、3,10-DDA、10-HDA、10-HDAA、9-HDAA、8-HDAA等成分。研究发现,提取物中极性较小的短链脂肪酸的抗氧化活性较弱,王浆酸的抗氧化能力不高,而AMP、3,10-DDA具有强的抗氧化活性,其清除 DPPH·的 IC50值分别是6.274 mg/mL和9.153 mg/mL,是蜂王浆中的抗氧化活性物质。除此以外,蜂王浆中肯定还有其他抗氧化物质存在,需要作进一步研究。
[1]方国桢,方建生,田树革.蜂王浆成分及分析方法研究进展[J].中国乳品工业,1994,22(6):278-281.
[2]黄盟盟,薄文飞,张林军,等.蜂王浆的主要活性成分及其保健作用[J].中国酿造,2009,2(3):152-153.
[3]Hang Guo,Yoshiaki Kouzuma,Masami.Structures and properties of antioxidative peptides derived from royal jelly protein[J].Food Chemistry,2009,113:238-245.
[4]Kuwabara Y,Hori Y,Yoneda T,et al.The antioxidant properties of royal jelly[J].Jpn Pharmacol Ther ,1996,24:63-67.
[5]Sun T,Ho C T.Antioxidant activities of buckweat extracts[J].Food Chemistry,2005,90(37):745-746.
[6]熊双丽,卢飞,史敏娟,等.DPPH自由基清除活性评价方法在抗氧化剂筛选中的研究进展[J].食品工业科技,2012,8(33):280-284.
[7]Xue Xiao Feng,Zhou Jin Hui,Wu Li Ming,et al.HPLC determination of adenosine in royal jelly[J].Food Chemistry ,2009,115:715-719.
[8]黄文诚.王浆酸是蜂王浆的标志物[J].蜜蜂杂志,2000,25(7):23-25.
[9]Naoki Noda,Kazue Umebayashi,Takafumi Nakatani,et al.Isolation and Characterization of Some Hydroxy Fatty and Phosphoric Acid Esters of 10-Hydroxy-2-decenoic Acid from the Royal Jelly of Honeybees(Apis mellifera)[J].Lipids,2005,40(8):833-838.
[10]Dragana Vucevic,Eleni Melliou,Sasa Vasilijic,et al.Fatty acids isolated from royal jelly modulate dendritic cell-mediated immune response in vitro[J].International Immunopharmacology,2007,7:1211-1220.
[11]侯春生,刘顺春,郭正松,等.蜂王浆中小分子物质BHT的抗氧化活性研究[J].中国蜂业,2007,58(4):5-6.
[12]高慧,程妮,贾琪,等.蜂王浆冻干粉体外抗氧化作用[J].食品科学,2011,32(21):52-54.
[13]Yoshimi Nakajima,Kazuhiro Tsuruma,Masamitsu Shimazawa,et al.Comparison of bee products based on assays of antioxidant capacities[J].BMC Complementary and Alternative Medicine,2009,9(4):1-9.
ABSTRACTAfter royal jelly(RJ)was extracted with 95%ethanol and isolated with chromatographic columns MCI-Gel and ODS,adenosine monophosphate and 7 kinds of fatty acids were obtained.The scavenging free radicals(DPPH·)of 1,1-diphenyl-2-picrylhydrazyl and the total antioxidant capacity kit(T-AOC)were used to study antioxidation of alcohol soluble components.The results showed that antioxidation of royal jelly improved after extraction and the antioxidant activity of AMP and 3,10-dihydroxydecanoic acid(3,10-DDA)were relatively higher,IC50value for DPPH· scavenging activity were 6.274 mg/mL and 9.153 mg/mL respectively.They were identified as the Antioxidants in royal jelly.
Key wordsroyal jelly,isolation,structural determination,antioxidation
Structure and Antioxidation Studies of Alcohol Soluble Components in Royal Jelly
Chen Bo,Xu De-ping
(School of Food Science and Technology,Jiangnan University,Wuxi 214122,China)
硕士研究生(徐德平副教授为通讯作者,E-mail:xdp1219@sina.com)。
2012-06-05,改回日期:2012-06-26

