齐墩果酸诱导Jurkat细胞凋亡及对ROS和细胞内Ca2+含量的影响
李旸,廖爱军,潘梦瑶,周蕾,徐淑梅,刘卓刚
(1.中国医科大学附属盛京医院血液病治疗中心,沈阳 110004;2.辽宁省抚顺市公安局监管支队,辽宁 抚顺 113000)
齐墩果酸(oleanlic acid,OA)又名庆四素,属五环三萜类化合物,是从木犀科植物齐墩果叶片中提取出的主要活性成分,在山楂、丁香、大枣中含量丰富。OA具有较多的生物学活性,其主要作用有抗肿瘤、保肝、降糖、降脂、调节免疫、抗氧化等。本研究以OA作用于人T淋巴细胞白血病Jurkat细胞株,探讨其对肿瘤细胞抑制增殖、诱导凋亡的效应,并分析凋亡过程中活性氧(reactive oxygen species,ROS)和细胞内钙离子浓度(intracelluar Ca2+concentration,[Ca2+]i)的变化情况,为其抗T淋巴细胞白血病的新用途提供实验依据。
1 材料与方法
1.1 药品与试剂
OA、DMSO(美国 Sigma公司),RPMI 1640培养基(Gibco公司),标准胎牛血清(天津澋洋生物制品有限公司),Annexin V/PI试剂盒(北京众康志恒生物科技公司),MTT试剂盒、细胞周期试剂盒、钙离子荧光探针、活性氧检测试剂盒(均为上海碧云天生物技术研究所)。
1.2 药物配制与细胞培养
OA用二甲基亚砜(DMSO)稀释成50 mmol/L,-20℃分装保存,使用前解冻。Jurkat细胞由白求恩医科大学附属第一医院血液科惠赠。细胞悬浮生长于含10%小牛血清、100 U/ml青霉素和100 μg/mL链霉素的RPMI1640培养液中,置于37℃、5%CO2的饱和湿度培养箱中培养。1~2 d传代1次,取对数生长期细胞为实验对象。
1.3 MTT法检测细胞增殖抑制率
取对数生长期的Jurkat细胞,以4×104/mL的细胞密度接种于96孔板,100 μL/孔。OA处理组分别加入终浓度为 20,40,80,160 μmol/L 的 OA 稀释液,每组均设3个复孔,分别培养12 h、24 h和48 h。实验设无药对照组(OA,0 μmol/L)和空白组(不含有细胞的RPMI 1640培养基)。实验终止前4 h加入MTT,20 μL/孔,培养结束时,离心弃上清,每孔加入DMSO 200 μL,振荡器充分震荡10 min后,用酶标仪测定570 nm波长处吸光度(optical density,OD)。计算细胞增殖抑制率:细胞增殖抑制率(%)=[(对照组OD值-实验组OD值)/(对照组OD值-空白组OD值)]×100%,实验重复3次。
1.4 细胞凋亡率的流式细胞术检测
分别用 40,80和160 μmol/L浓度的OA处理Jurkat细胞24 h后收集细胞,预冷的PBS洗涤细胞2次,将细胞重悬于200 μL结合缓冲液中,加入10 μL Annexin V-FITC和10 μL PI,轻轻混匀,避光4℃反应30 min,加入300 μL结合缓冲液,1 h内检测,激发波长为488 nm,实验重复3次。
1.5 细胞周期分析
细胞处理方法同凋亡率检测。离心弃上清,残留约50 μL培养液,预冷的PBS洗涤细胞1次。加入1 mL预冷70%乙醇中,吹打混匀,4℃固定过夜。再次收集细胞,预冷的PBS洗涤后,每管细胞样品中加入0.5 mL碘化丙锭染色液(包括染色缓冲液、碘化丙锭染色液、RnaseA),充分重悬细胞沉淀,37℃避光温浴30 min,进行流式检测,用Cell-Modifit软件分析细胞周期。实验重复3次。
1.6 流式细胞仪检测细胞中ROS含量
细胞处理方法同凋亡率检测。各组细胞离心去上清,残留约50 μL培养液,预冷的PBS洗涤细胞3次。加入1 mL 10 μmol/L DCFH-DA稀释液重悬细胞,混匀后避光37℃孵育20 min。用无血清细胞培养液洗涤细胞3次弃去未反应的DCFH-DA,再次重悬细胞,使用488 nm激发波长,525 nm发射波长上流式细胞仪检测。实验重复3次。
1.7 细胞中[Ca2+]i测定
细胞处理方法同凋亡率检测。各组细胞离心去上清,残留约50 μL培养液,预冷的PBS洗涤细胞3次。加入1 mL 5 μmol/L Fluo-3AM钙离子荧光探针稀释液重悬细胞,混匀后避光37℃孵育30 min。离心弃去上清,1 mL无血清1640培养基重悬细胞,流式细胞仪检测细胞内钙离子含量。实验重复3次。1.8 统计学处理
2 结果
2.1 OA对Jurkat细胞增殖的影响
320 μmol/L浓度范围的OA均可使Jurkat细胞生存率下降,20 μmol/L OA对Jurkat细胞作用较轻微,而40 μmol/L以上浓度的OA对细胞的增殖抑制率明显增高,呈时间和浓度依赖关系(表1)。
表1 OA作用于Jurkat细胞后的增殖抑制率(±s,%)Tab.1 The inhibitory effect of OA on proliferation of Jurkat cells(±s,%)
1)P<0.05,2)P<0.01 vs control.
Item Control 20 μmol/L 40 μmol/L 80 μmol/L 160 μmol/L 320 μmol/L 12 h 0 15.69±2.341) 41.01±5.132) 57.67±5.522) 60.72±6.571)) 73.33±3.811)24 h 0 25.47±6.541) 53.94±5.332) 61.98±1.821) 64.86±4.691) 79.10±1.852)48 h 0 39.82±4.522) 64.20±3.372) 69.86±5.761) 90.16±2.302) 92.09±1.211)
2.2 OA对Jurkat细胞凋亡的影响
流式细胞仪测定结果显示,凋亡细胞比例40 μmol/L 组[(19.8±1.59)%]、80 μmol/L 组[(29.39±0.64)%]、160 μmol/L 组[(34.72±0.94)%],较对照组[(7.36±0.40)%]明显升高,差异均有统计学意义(P<0.05)。
2.3 OA对Jurkat细胞周期的影响
经40 μmol/L OA处理24 h后,Jurkat细胞即出现G0/G1期阻滞,且随药物浓度逐渐增大,这种趋势越来越明显。80 μmol/L和160 μmol/L组的周期图谱中可见亚G1期凋亡小峰,且凋亡小峰随给药浓度的增加有所增长。见图1、表2。
表2 OA对Jurkat细胞周期的影响(±s,%)Tab.2 The effect of OA on the cell cycle of Jurkat cells(±s,%)
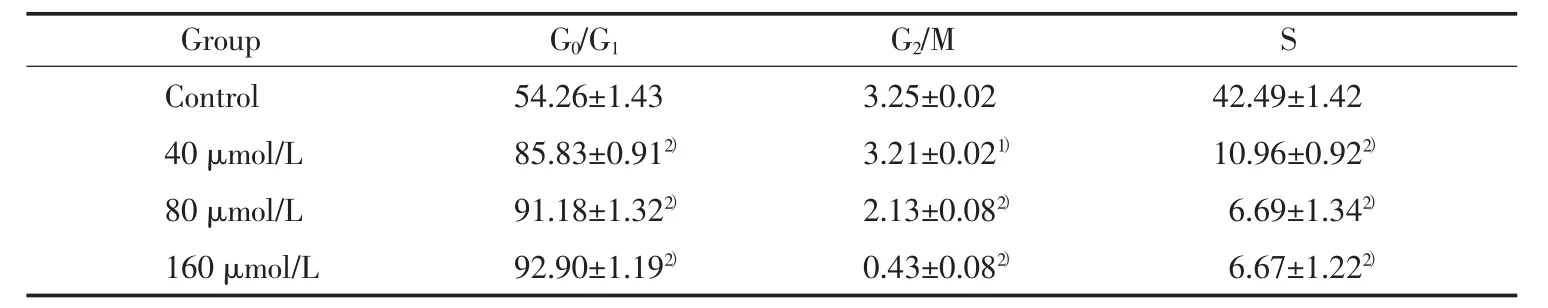
表2 OA对Jurkat细胞周期的影响(±s,%)Tab.2 The effect of OA on the cell cycle of Jurkat cells(±s,%)
1)P<0.05,2)P<0.01 vs control group.
Group G0/G1 G2/M S Control 54.26±1.43 3.25±0.02 42.49±1.42 40 μmol/L 85.83±0.912) 3.21±0.021) 10.96±0.922)80 μmol/L 91.18±1.322) 2.13±0.082) 6.69±1.342)160 μmol/L 92.90±1.192) 0.43±0.082) 6.67±1.222)
2.4 OA对细胞内ROS水平的影响
流式检测结果显示细胞内ROS的产生随给药浓度的增加而升高。40 μmol/L浓度组与对照组比较差别不大,而80 μmol/L和160 μmol/L浓度组ROS水平明显升高(P<0.05),见图2。ROS的平均荧光强度与凋亡细胞比例呈正相关(r=0.97,P<0.05)。
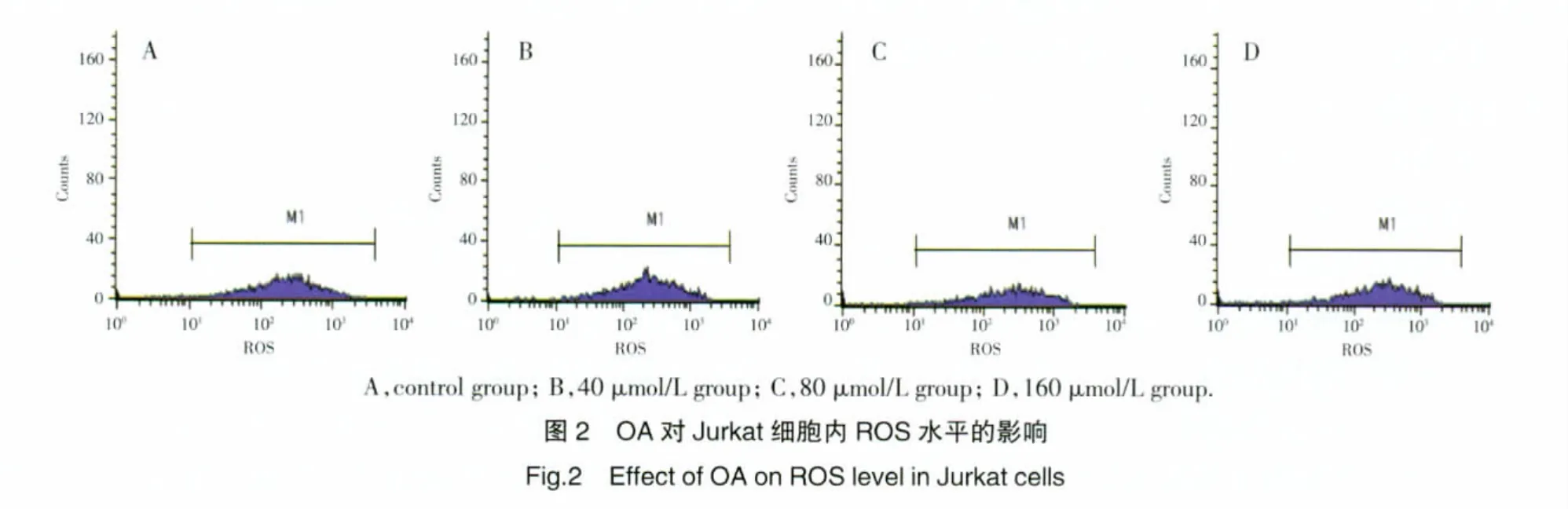
2.5 OA 对[Ca2+]i水平的影响
流式细胞仪结果显示,40 μmol/L OA作用细胞24 h 后[Ca2+]i显著提高,且[Ca2+]i随给药浓度增加而持续增加,呈剂量依赖性,160 μmol/L浓度组[Ca2+]i达到峰值,与对照组及其他浓度组比较差异均有统计学意义(P 均<0.01),见图 3。[Ca2+]i的平均荧光强度与凋亡细胞比例呈显著正相关(r=0.95,P<0.05)。
3 讨论
OA作为一种天然萜类化合物,具有广泛的生物学功能,近年来其抗肿瘤效应越来越受到人们的关注。OA抗瘤谱广,对肝癌、结肠癌、星型胶质细胞瘤等多种实体肿瘤细胞均有生长抑制作用[1]。OA对白血病细胞株也有杀伤作用,主要表现为诱导肿瘤细胞凋亡[2]。其具体的机制是多方面的,目前研究认为OA抗白血病效应可能与Bax基因家族表达上调、Bcl-2基因家族表达下调、caspase蛋白家族活化、细胞色素C释放增加、Fas参与的凋亡信号途径激活等因素有关[2]。本研究选用白血病T淋巴细胞株为细胞模型,观察OA对Jurkat细胞的诱导凋亡作用。结果表明,OA对Jurkat细胞具有明显的细胞毒作用。经Annexin V/PI双染色后流式细胞仪检测发现OA能诱导Jurkat细胞发生凋亡,这是OA处理后细胞存活率下降的主要原因。细胞周期分析进一步表明在0~160 μmol/L浓度范围内,G0/G1期细胞比例随OA浓度增加而增加,该结果说明OA对于Jurkat细胞株的作用有周期特异性,能使细胞生长停滞于G0/G1期。
ROS是真核细胞有氧呼吸的产物,包括超氧阴离子(O2-)、羟自由基(OH·)、过氧化氢(H2O2)等,因其含有不成对电子,具有较强的氧化能力。正常情况下,细胞内存在的巯基还原体系和抗氧化酶类能不断清除细胞代谢过程中产生的ROS,维持机体及细胞内氧化还原平衡。当这种平衡状态遭到破坏,ROS作为细胞有氧代谢的产物,首先具有一定的细胞毒性,能够攻击胞内大分子,表现为脂质过氧化、蛋白质氧化和损伤DNA等有害效应[3]。其次,ROS还是体内重要的氧化还原信号分子,在细胞的增殖、分化和凋亡过程中发挥重要的介导和调节作用,细胞内ROS水平的轻微升高促进细胞的增殖和分化,而ROS的显著增高则促发凋亡或坏死[4]。现有研究证明,阿霉素、三氧化二砷等多种抗肿瘤药物诱导肿瘤细胞DNA片段化并引发凋亡作用都与ROS密切相关。我们的研究发现,80 μmol/L和160 μmol/L的OA作用于Jurkat细胞24 h后,细胞中ROS水平升高,与对照组比较差异有统计学意义(P<0.05),且细胞凋亡率与ROS水平之间呈正相关(r=0.97)。由此推测,刺激细胞产生活性氧自由基而诱导细胞凋亡可能是OA诱导Jurkat细胞凋亡的机制之一。
对于凋亡的线粒体通路的研究已证实,在凋亡因子的刺激下,线粒体膜通透性转运孔(permeability transiton pore,MPTP)开放,线粒体跨膜电位降低或丧失,线粒体基质中释放出凋亡蛋白,促发细胞凋亡。Ca2+是细胞代谢活动重要的第二信使,也是使MPTP开放的刺激信号[5],同时作为金属辅助因子激活Ca2+/Mg2+依赖性核酸内切酶而使DNA降解或激活转录因子,促进参与凋亡的基因表达。研究表明,细胞在凋亡早期即出现细胞内[Ca2+]i迅速上升[6],证实细胞内钙超载与凋亡信号的启动和传导密切相关。另有研究也证实在纳秒级陡脉冲诱导SKOV3细胞凋亡的过程中,细胞内游离的Ca2+增高有可能通过内质网通路参与凋亡通路的调节[7]。而Ca2+拮抗剂可以通过阻断钙内流、防止细胞内钙超载对细胞起到保护作用[8]。本研究结果显示,OA在诱导Jurkat细胞凋亡过程中细胞内游离Ca2+水平明显升高,且与相同药物浓度作用下细胞凋亡率的升高呈正相关(r=0.95),证明细胞内钙超载参与了OA诱导的Jurkat细胞凋亡。
ROS和Ca2+均为细胞凋亡的早期信号,作用于线粒体,使线粒体通透性改变,跨膜电位降低,细胞色素C释放,激活Caspase级联反应最终导致凋亡。损伤的线粒体又释放更多的ROS和Ca2+,进一步加速凋亡。需要指出的是,ROS和钙信号通路并非互相独立,而是存在密切的交互作用。ROS可以反馈性调节[Ca2+]i,而[Ca2+]i升高又是线粒体代谢酶的直接刺激信号,能引起线粒体氧化呼吸链受抑,ROS大量释放[9]。本研究证明OA能诱导白血病T淋巴细胞Jurkat细胞株凋亡,凋亡过程中伴有ROS及游离Ca2+水平升高,且二者均与细胞凋亡率呈显著正相关,该结果提示OA与外源活性氧或Ca2+激动剂联合应用可能对临床T淋巴细胞白血病的治疗具有潜在应用价值。
[1]Ruben M,Juliana C,Elvira I,et al.Acidic triterpenes compromise growth and survival of astrocytoma cell lines by regulating reactive oxygen species accumulation[J].Cancer Res,2008,67 (8),3741-3751.
[2]Zhang PX,Li HM,Chen D,et al.Oleanolic acid induces apoptosis in human leukemia cells through caspase activatio and poly(ADP-ribose)polymerase cleavage[J].Acta Biochimicaet Biophysica Sinica,2007,39(10):803-809.
[3]谢芳,赵明峰.活性氧物质对骨髓造血功能的影响[J].中华血液学杂志,2011,32(2):67-69.
[4]Ki YW,Lee JE,Park JH,et al.Reactive oxygen species and mitogenactivated protein kinase induce apoptotic death of SH-SY5Y cells in response to fipronil[J].Toxicol Let,2012,211(1):18-28.
[5]Kuhr FK,Smith KA,Song MY,et al.New mechanisms of pulmonary arterial hypertension:role of Ca2+signaling[J].Am J Physiol Heart Circ Physiol,2012,302(8):H1546-H1562.
[6]Uguz AC,Naziroglu M,Espino J,et al.Selenium modulates oxidative stress-induced cell apoptosis in human myeloid Hl-60 cells through regulation of calcium release and caspase-3 and-9 activities[J].J Membrane Biol,2009,232(1-3):15-23.
[7]刘丽娟,赵东阳,王建,等.钙离子在纳秒级陡脉冲诱导卵巢癌细胞SKOV3凋亡通路中的作用[J].南方医科大学学报,2011,31(5):341-343.
[8]王鹏雁,安建多,王池,等.槲芪散及槲寄生提取物对肝癌细胞内游离钙离子浓度的影响[J]. 首都医科大学学报,2012,33(3):145-148.
[9]Camello-Almaraz C,Gomez-Pinilla PJ,Pozo MJ,et al.Mitochondrial reactive oxygen species and Ca2+signaling [J].Cell Physiol,2008,291(05):1082-1088.

