肾内血管紧张素系统在2型糖尿病大鼠的肾脏发育中异常活化的机制
孙永新,范愈燕,支楠,西山成,刘雅,黄雯,姚丽
(1.中国医科大学附属第一医院康复科,沈阳 110001;2.香川大学医学部药理科,香川 671-0793,日本;3.首都医科大学北京同仁医院传统医学科,北京 100730;4.首都医科大学北京同仁医院肾脏内科,北京 100730;5.中国医科大学附属第一医院肾脏内科,沈阳110001)
近来众多的研究表明,肾素—血管紧张素系统(renin-angiotensin system,RAS)在糖尿病肾病的发生和发展中起到重要的作用。大规模的临床试验[1~3]证明,血管紧张素转换酶抑制剂和血管紧张素受体拮抗剂在临床上的疗效远远超出了其对控制血压和改善血流动力学的影响,说明RAS是导致糖尿病肾病微量蛋白尿的重要原因之一。我们先前的研究也证明,糖尿病OLETF大鼠在糖尿病发生早期肾内血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)已经异常升高[4,5]。然而,对早期糖尿病肥胖动物模型中肾内RAS异常激活的具体年龄阶段目前尚无报道。本研究中,我们为了明确肾内的RAS系统被异常激活的情况,观察在糖尿病OLETF大鼠出生后第一天、哺乳期、断奶后到成熟阶段,肾脏发育过程中肾内AngⅡ含量及RAS系统组成成分基因表达水平的改变。
1 材料与方法
1.1 材料
1.1.1 试验动物:雌性妊娠晚期糖尿病OLETF大鼠和正常LETO大鼠均由日本大冢制药公司提供(日本德岛)。在雌性妊娠大鼠正常分娩后,取出生后第1、5和 14天及第 4、7、11、18和 30周的正常生长的雄性糖尿病OLETF大鼠和正常LETO大鼠断头取材,每组8~12只。
1.1.2 仪器:无创血压检测仪(BP-98A,日本Softron有限公司);大鼠血糖检测仪(日本Wako工业株式会社);DNA扩增仪(OSO-406型,德国Biometra公司)。
1.1.3 试剂:尿中白蛋白检测试剂盒(日本Shibayagi公司);肌酐测定试剂盒(日本Wako工业株式会社);PT-PCR的SYBR GreenⅠ和TaqMan探针检测试剂盒(美国Applied Biosystems公司);RNase-Free(美国Invitrogen公司)。
1.2 检测项目
1.2.1 平均血压测定和标本收集:在大鼠清醒状态下通过无创血压仪检测平均血压,取每只大鼠反复测定6次的平均值[6];在大鼠生长过程中,从第6周开始每隔2周收集24 h的尿样。大鼠断头后,左侧肾脏的三分之一固定在10%的甲醛液体中保存,剩下部分分离出来的皮质经RNase-Free水处理后,保存在-80℃;右侧肾脏快速在液氮中冻结后,-80℃保存。
1.2.2 肾脏指数测定:取肾后剥去脂肪等组织,用滤纸吸干表面液体,立即称取右侧每一个完整肾脏的湿重,并按每100 g体质量计算肾脏指数[6]。
1.2.3 实时定量PCR:检测 GAPDH、肾素(renin)、血管紧张素原(angiotensinogen,AGT)、血管紧张素转换酶(angiotensin-converting enzyme,ACE)、血管紧张素Ⅱ受体1A亚型(angiotensinⅡreceptor type 1a,AT1AR)、血管紧张素Ⅱ受体1B亚型(angiotensinⅡreceptor type 1b,AT1BR)、血管紧张素Ⅱ受体2亚型(angiotensinⅡreceptor type 2,AT2R)、转化生长因子 β(transforming growth factor β,TGF-β)、结缔组织生长因子(connective tissue growth factor,CTGF)、Ⅰ型胶原(collagen typeⅠ,ColⅠ)、Ⅳ型胶原(collagen typeⅣ,ColⅣ)的基因表达,通过QuantiTect SYBR Green PCR试剂盒、TaqMan ABI PRISM 7300实时PCR系统(美国Applied Biosystems公司)对来自各组大鼠肾脏皮质的cDNA模板进行定量扩增,所用引物同文献[7,8]。每次进行PCR扩增时均采用等量的蒸馏水替代模板作为阴性对照,采用GAPDH作为加样对照。所测目标基因mRNA的绝对值可通过以其GAPDHmRNA含量进行校正而获得。
1.2.4 光学显微镜检查:10%甲醛固定的肾脏组织,石蜡包埋,3 μm切片,采用PAS和Mass三色染色。通过自动图像处理系统对PAS和Masson三色染色切片进行分析[6,9~11],评估肾小球硬化和肾小管纤维化程度。
1.2.5 其他检查:通过尿蛋白试剂盒和尿肌酐检测试剂盒[6]检测大鼠尿中白蛋白和尿肌酐浓度;餐后血糖水平测定采用Wako工业株式会社的血糖仪;尿中AGT检测采用大鼠AGT的夹心酶联免疫吸附试验方法[10];在肾内AngⅡ含量提取过程中,肾内组织在冷处理的甲醇中粉碎后,通过放射免疫方法检测[6]。
1.3 统计学分析
2 结果
2.1 一般状况和肾功能的影响
6~30周龄时,LETO大鼠的平均血压(91~102 mmHg)和尿白蛋白/尿肌酐的比值(0.6~14.8 mg/g)无明显变化(图1A和1B)。糖尿病OLETF大鼠随着年龄的增长发生高血压(图1A);11~30周龄,糖尿病OLETF大鼠的尿白蛋白/尿肌酐的比值明显高于LETO大鼠(P<0.05,图1B)。从7周龄开始,糖尿病OLETF大鼠体质量明显高于LETO大鼠(P<0.05,表1)。大鼠断奶后(出生后2周),糖尿病OLETF大鼠右侧肾质量/体质量的比值明显高于LETO大鼠(P<0.05,表1)。18~30周龄时,糖尿病OLETF大鼠的餐后血糖明显高于LETO大鼠(P<0.05,表1)。
2.2 RAS系统成分的改变
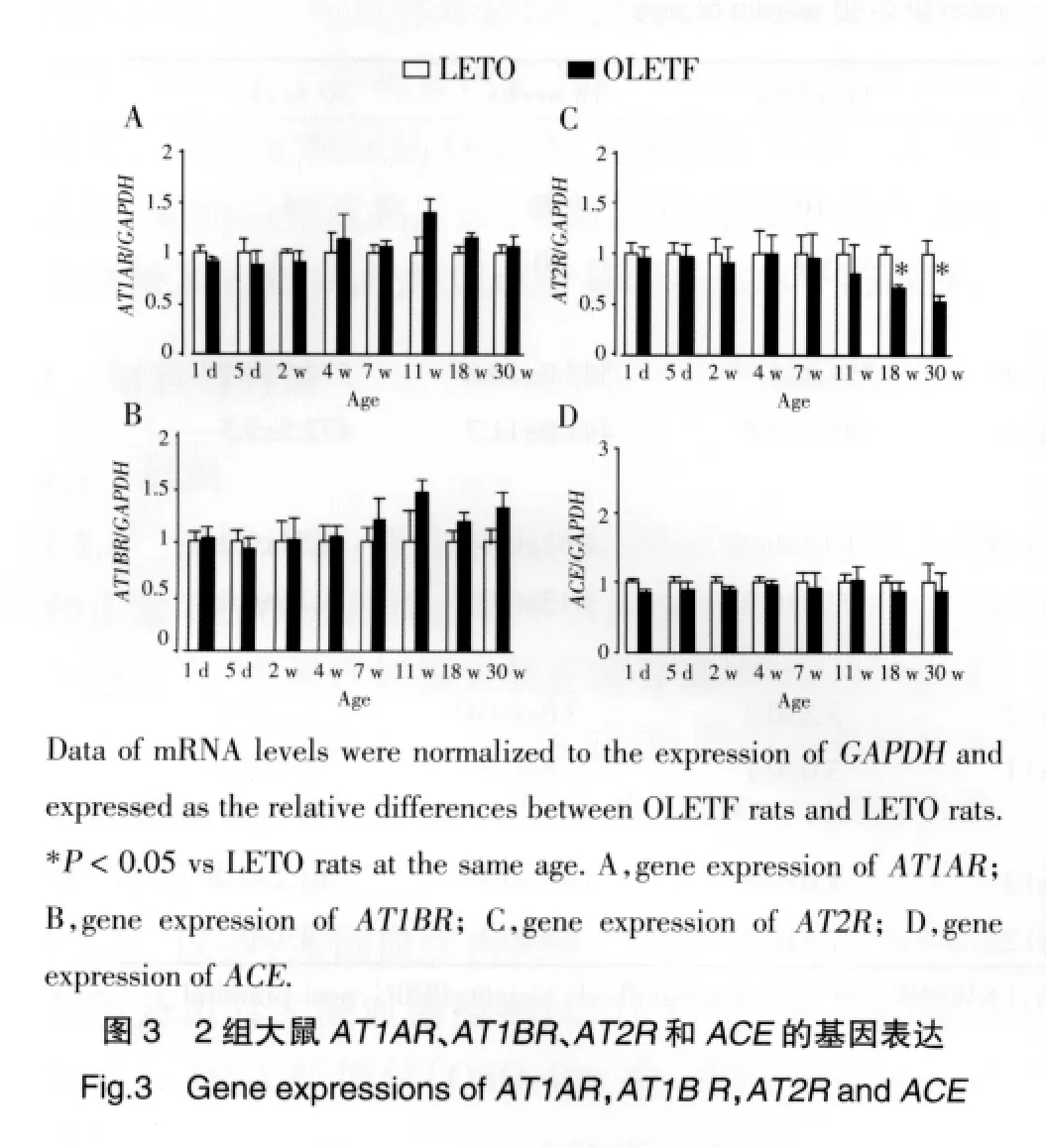
肾内AngⅡ含量的最高峰出现在糖尿病OLETF大鼠和LETO大鼠出生后第1天,从断奶前到断奶后(出生后1 d~4周)随着年龄增长逐渐下降。从出生到4周龄,糖尿病OLETF大鼠和LETO大鼠比较,肾内AngⅡ含量和RAS组成成分AGT、renin、ACE、AT1AR、AT1BR、AT2R 的基因表达无明显改变(P>0.05,图 2A、2B、2C 和图 3)。但是从 11周开始,糖尿病OLETF大鼠肾内AngⅡ含量明显高于LETO大鼠(P<0.05),同时11~30周龄糖尿病OLETF大鼠AGT、renin的mRNA表达也明显高于LETO大鼠(P<0.05,图2B和2C)。糖尿病OLETF大鼠尿中AGT的排泄率与LETO大鼠相比,也从11周开始明显增加,11周龄时分别为(358±14)和(80±11)ng/d,18 周龄时分别为(426±28)和(92±11)ng/d,30周龄时分别为(487±35)和(103±14)ng/d(均 P<0.05,图 2D)。无论肾内 ACE还是 AT1AR和AT1BRmRNA水平,2组比较差异均无统计学意义(P>0.05,图 3A、3B、3D)。然而,18~30周龄糖尿病OLETF大鼠与LETO大鼠比较,肾内AT2RmRNA
水平明显降低(P<0.05,图3C)。
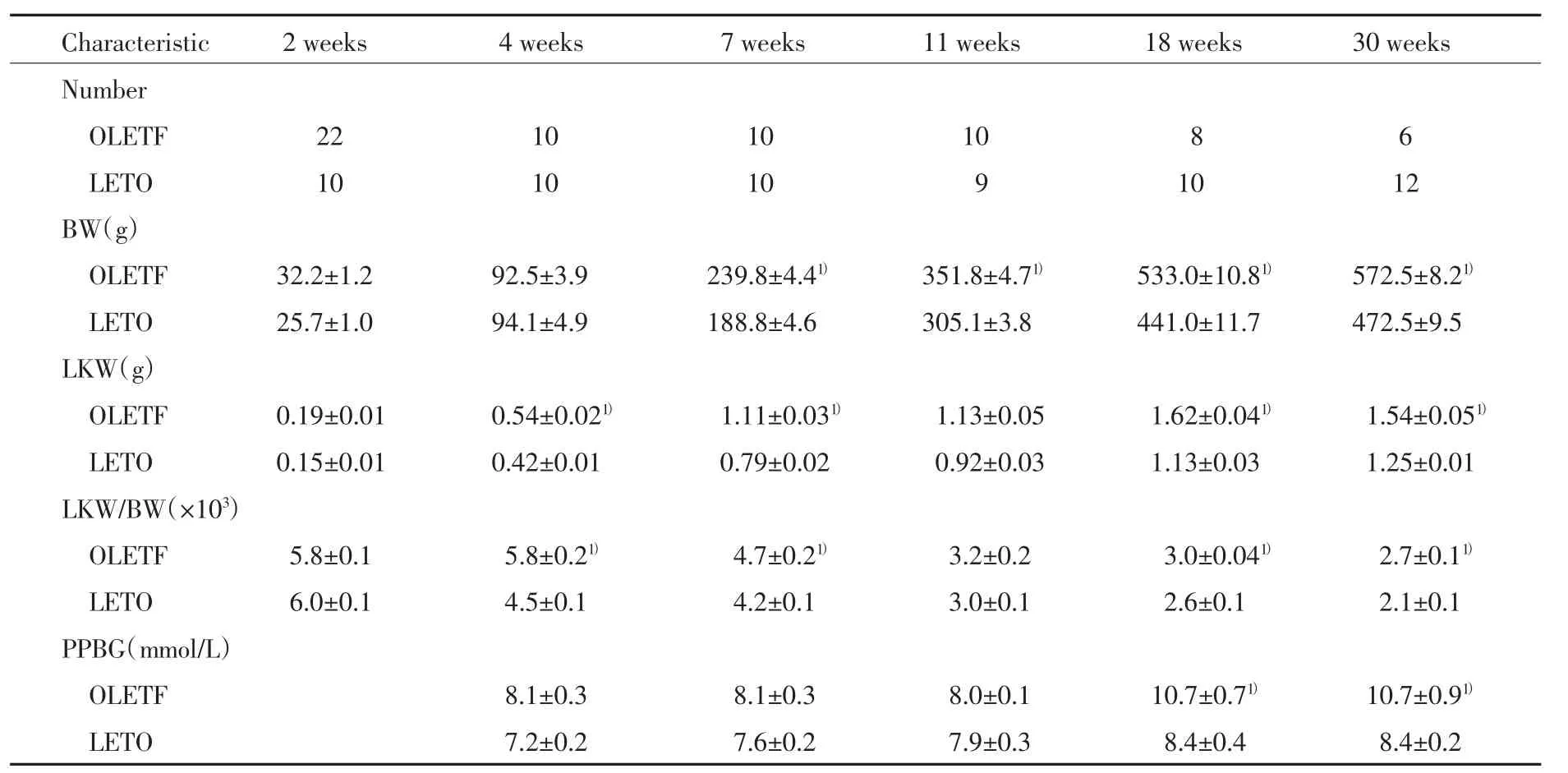
表1 2组大鼠2~3 0周龄时的特征比较Tab.1 Characteristics of each group at 2-30 weeks of age


2.3 肾内皮质胶原、TGF-β和CTGF基因表达的改变
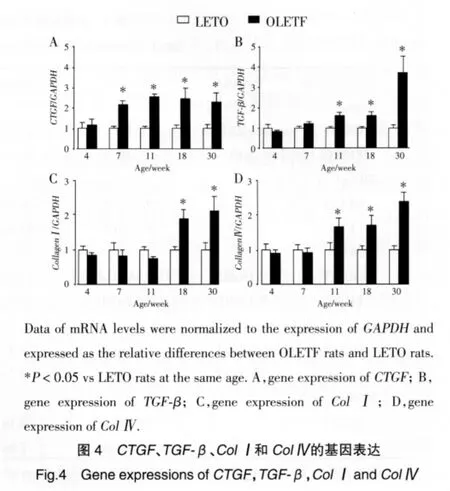
肾内皮质的ColⅠ、ColⅣ、TGF-β和 CTGF的基因表达如图4所示,7~30周龄糖尿病OLETF大鼠CTGF基因表达水平是LETO大鼠2倍(P<0.05,图4A);与LETO大鼠比较,糖尿病OLETF大鼠TGF-β基因水平表达已开始逐渐升高,18~30周龄时迅速增加(P<0.05,图4B)。同样,糖尿病OLETF大鼠与LETO大鼠比较,18~30周龄及11~30周龄时肾内皮质的ColⅠ或ColⅣmRNA也分别明显升高(P<0.05,图 4C、4D)。另一方面,7~11周龄时 2组大鼠均无肾内免疫形态学改变。正如我们前期实验所见[4],18~30周龄糖尿病OLETF大鼠才出现了明显的肾小球硬化和肾小管纤维化。
3 讨论
我们在之前的研究中发现,OLETF糖尿病肥胖大鼠在发生糖尿病前肾内AngⅡ水平从11周已经开始显著增加[4]。但是,我们不清楚在糖尿病OLETF大鼠的成熟过程中,糖尿病早期肾内AngⅡ水平是否已经开始异常增加。本研究发现,LETO和糖尿病OLETF大鼠在出生后到断奶期间(从出生后第1天至4周龄),肾内AngⅡ水平在出生后第1天达到高峰,随着年龄增长会逐渐下降,这与前人对正常SD大鼠肾内RAS的研究结果一致[12]。在第1天至4周龄,肾内AngⅡ水平在糖尿病OLETF大鼠与正常LETO大鼠之间没有差异。同样,在青春期开始(7周龄)时OLETF和LETO大鼠肾内AngⅡ水平无统计学差异。然而,在青春期(7~11周龄)期间,LETO大鼠肾内AngⅡ水平不断下降,但是这种下降趋势却没有在糖尿病前期OLETF大鼠中观察到。这些数据表明,在糖尿病OLETF大鼠的糖尿病早期,肾内AngⅡ水平适当减少的发育缺陷会导致肾脏AngⅡ水平异常升高。
我们以前的研究发现,在糖尿病早期短期应用血管紧张素受体拮抗剂治疗干预有助于减轻糖尿病OLETF大鼠的肾脏损伤。最近,对奥美沙坦和预防微量白蛋白尿的研究(ROADMAP)审查中发现,血管紧张素受体拮抗剂可以阻止微量白蛋白尿的发生[13]。这表明,如果2型糖尿病患者早期应用血管紧张素受体拮抗剂奥美沙坦治疗,可以显著减少微量白蛋白尿的发生率[13]。本研究发现,在青春期(18~30周龄)糖尿病OLETF大鼠肾内AngⅡ水平一直都维持在异常的高水平。这些数据支持一个假设,即异常的肾内AngⅡ水平调控了2型糖尿病肾病的发病,而早期应用血管紧张素受体拮抗剂治疗可能在以后的生活中有效的预防糖尿病肾病的发生和发展,具有非常重要的意义。
从出生到断奶期间(出生后第1天至4周龄),糖尿病OLETF和LETO大鼠肾皮质的AGT、ACE和renin基因表达没有差异。同样,在青春期开始(7周龄)时2组肾内RAS组成成分的基因表达没有变化。然而到青春期的后期(11周龄),糖尿病OLETF大鼠的AGT和renin基因表达明显高于LETO大鼠。巧合的是,这个时期的糖尿病OLETF大鼠肾内AngⅡ也同样高于正常LETO大鼠。这些数据说明,糖尿病OLETF大鼠肾组织的AGT和reninmRNA异常高表达会导致青春期肾内AngⅡ水平异常升高的发育缺陷。然而,对于糖尿病大鼠肾内AGT和renin基因表达异常升高的具体病因机制不是很清楚,但是不能简单的归结于血糖升高。因为糖尿病OLETF大鼠表现出肾内AGT和renin基因异常高表达发生在青春期11周龄的糖尿病前期,早于血糖升高的糖尿病期。另外,糖尿病OLETF和正常LETO大鼠肾皮质中AT1受体的AT1AR和AT1BR基因表达没有明显差异。但是AT2R基因在糖尿病OLETF大鼠肾皮质中的表达明显低于正常LETO大鼠,这些生理、病理变化需要进一步的研究。
据报道,TGF-β/CTGF所依赖的途径可以激活包括胶原在内的细胞外基质蛋白化合物[14~16]。本研究发现,相对于LETO大鼠,OLETF大鼠在青春期(7或11周龄)CTGF、TGF-β和ColⅣ基因表达明显增加。另一方面,ColⅠ基因在糖尿病OLETF大鼠18~30周龄时明显增加,这与我们过去的研究结果一致[4]。本研究中,我们没有观察到糖尿病OLETF大鼠在青春期11周龄时肾组织免疫形态学发生改变,但肾脏功能已经轻微改变(如CTGF、TGF-β、ColⅣ),这可能是导致后期糖尿病肾病的重要病理基础。
总之,本研究表明,糖尿病OLETF大鼠在青春期缺乏维持肾内低水平AngⅡ的发育缺陷是导致肾内AngⅡ异常升高的重要原因,与肾内AGT和renin基因的高表达密切相关。在糖尿病早期,肾内RAS异常激活可能是导致以后生活中糖尿病肾病发生发展的重要原因。
[1]Lewis EJ,Hunsicker LG,Clarke WR,et al.Renoprotective effect of the angiotensin-receptor antagonist irbesartan in patients with nephropathy due to type 2 diabetes [J].N Engl J Med,2001,345(12):851-860.
[2]Brenner BM,Cooper ME,de Zeeuw D,et al.Effects of losartan on renal and cardiovascular outcomes in patients with type 2 diabetes and nephropathy[J].N Engl J Med,2001,345(12):861-869.
[3]Ihara G,Kiyomoto H,Kobori H,et al.Regression of superficial glomerular podocyte injury in type 2 diabetic rats with overt albuminuria:effect of angiotensin II blockade[J].J Hypertens,2010,28(11):2289-2298.
[4]Nagai Y,Yao L,Kobori H,et al.Temporary angiotensin Ⅱ blockade at the prediabetic stage attenuates the development of renal injury in type 2 diabetic rats[J].J Am Soc Nephrol,2005,16(3):703-711.
[5]Sofue T,Kiyomoto H,Kobori H,et al.Early treatment with olmesartan prevents juxtamedullary glomerular podocyte injury and the onset of microalbuminuria in type 2 diabetic rats [J].Am J Hypertens,2012,25(5):604-611.
[6]Fan YY,Baba R,Nagai Y,et al.Augmentation of intrarenal angiotensinⅡ levels in uninephrectomized aldosterone/salt-treated hypertensive rats;renoprotective effects of an ultrahigh dose of olmesatan[J].Hypertens Res,2006,29(3):169-178.
[7]Nishiyama A,Yao L,Nagai Y,et al.Possible contributions of reactive oxygen species and mitogen-activated protein kinase to renal injury in aldosterone/salt-induced hypertensive rats [J].Hypertension,2004,43(4):841-848.
[8]Nishiyama A,Nakagawa T,Kobori H,et al.Strict angiotensin blockade prevents the augmentation of intrarenal angiotensinⅡand podocyte abnormalities in type 2 diabetic rats with microalbuminuria[J].J Hypertens,2008,26(9):1849-1859.
[9]Han SY,So GA,Jee YH,et al.Effect of retinoic acid in experimental diabetic nephropathy [J].Immunol Cell Biol,2004,82 (6):568-576.
[10]Kobori H,Katsurada A,Miyata K,et al.Determination of plasma and urinary angiotensinogen levels in rodents by newly developed ELISA [J].Am J Physiol Renal Physiol,2008,294 (5):F1257-F1263.
[11]Sun GP,Kohno M,Guo P,et al.Involvements of Rho-kinase and TGF-beta pathways in aldosterone-induced renal injury[J].J Am Soc Nephrol,2006,17(8):2193-2201.
[12]Yosipiv IV,el-Dahr SS.Activation of angiotensin-generating systems in the developing rat kidney[J].Hypertension,1996,27(2):281-286.
[13]Haller H,Ito S,Izzo JL Jr,et al.ROADMAP Trial Investigators.Olmesartan for the delay or prevention of microalbuminuria in type 2 diabetes[J].N Engl J Med,2011,364(10):907-917.
[14]Riser BL,Denichilo M,Cortes P,et al.Regulation of connective tissue growth factor activity in cultured rat mesangial cells and its expression in experimental diabetic glomerulosclerosis [J].J Am Soc Nephrol,2000,11(1):25-38.
[15]Yokoi H,Mukoyama M,Nagae T,et al.Reduction in connective tissue growth factor by antisense treatment ameliorates renal tubulointerstitial fibrosis[J].J Am Soc Nephrol,2004,15(6):1430-1440.
[16]Weston BS,Wahab NA,Mason RM.CTGF mediates TGF-betainduced fibronectin matrix deposition by upregulating active alpha5beta1 integrin in human mesangial cells[J].J Am Soc Nephrol,2003,14(3):601-610.

