缺血后处理对糖尿病大鼠缺血再灌注心肌的保护作用
邹国良,仲维莉,刘莉,胡健
(1.中国医科大学附属第一医院心内科,沈阳 110001;2.黑龙江中医药大学附属第一医院心内科,哈尔滨 150040)
再灌注策略能够挽救急性心肌梗死时濒临坏死的心肌,但再灌注后可引起心肌损伤加重,发生缺血再灌注损伤(ischemia/reperfusion injury,I/RI)[1]。缺血后处理(ischemic postconditioning,IPostC),即心肌缺血后,在长时间的灌注之前,进行1次或数次短暂重复的心肌缺血再灌注,能提高心肌对之前发生的较长时间缺血的耐受性[2],在抗心肌细胞凋亡、减少心肌梗死面积、保护内皮功能等方面发挥保护作用[3~8]。然而,IPostC对于糖尿病I/RI性心肌是否具有同样的保护作用及其发生机制仍有待探讨。本研究应用糖尿病大鼠模型,结扎大鼠冠状动脉左前降支(left anterior desscending coronary artery,LAD)模拟在体心肌缺血再灌注,通过观察心肌梗死面积、心肌细胞凋亡指数(apoptotic index,AI)的变化,评价IPostC对糖尿病大鼠心肌I/RI的影响。
1 材料与方法
1.1 材料
1.1.1 动物:健康12周龄雄性SD大鼠48只,购于哈尔滨医科大学实验动物中心。
1.1.2 主要试剂:氯化三苯基四氮唑、台盼蓝(武汉博士德公司),TUNEL凋亡检测试剂盒(上海碧云天生物制剂有限公司),CK-MB试剂盒、链脲佐菌素(北京博奥森生物制剂有限公司)。
1.2 方法
1.2.1 动物模型制备:经尾静脉注射2%链脲佐菌素溶液(45 mg/kg),24 h内给予不限制饮用10%葡萄糖溶液,72 h后采尾血测血糖,连续测3 d,若血糖持续≥16.7 mmol/L,则视为造模成功。糖尿病大鼠适应性饲养1周后进行下一步实验。
1.2.2 动物分组及处理:随机将大鼠分为:(1)正常组:正常大鼠自由饲食水,不做任何手术处理;(2)假手术(sham)组:糖尿病大鼠开胸后在LAD下穿线,不结扎;(3)缺血再灌注(IR)组:糖尿病大鼠结扎LAD 造成缺血 30 min,再灌注 2 h;(4)缺血后处理(IPostC)组:糖尿病大鼠结扎LAD 30 min,再灌注30 s,阻断 30 s,重复 3 次,再灌注 2 h。
1.2.3 肌酸激酶同工酶(creatine kinase workers MB,CK-MB)的测定:实验结束时由颈动脉采血,室温静置 10 min,10 000 r/min 离心 15 min,取上清,-20 ℃冻存。采用全自动生化分析仪测定血清中的CKMB。
1.2.4 心肌梗死范围测定:经颈动脉采血后,IR组、IPostC组每组随机选取6只大鼠,原位结扎LAD,从右颈动脉注入1%台盼蓝3 mL/kg,使之灌注蓝染非缺血区心肌。随即取下整个心脏,以PBS冲洗,剪去心房,置-20℃冷冻20 min后,沿心脏长轴等分为4~5份,切片;置于1%TTC溶液中37℃孵育30 min,缺血的心肌组织被染成砖红色,梗死心肌呈灰白色。通过Optimax图像处理软件进行分析,并计算梗死面积(infarct size,IS)与缺血区面积(area at risk,AAR)的比值(IS/AAR)。
1.2.5 心肌细胞凋亡检测:应用TUNEL法检测AI,根据试剂盒说明书操作。采用彩色病理图文分析系统(OLYPUS BX-6.0显微照相仪),在光学显微镜下,对TUNEL染色切片行显微摄像及检测。取阳性染色区域不同的5个视野,由强至弱取图5幅,检测心肌细胞凋亡阳性细胞和阴性细胞的个数,以心肌凋亡阳性细胞数占总心肌细胞数的百分比作为心肌AI。
1.3 统计学分析
2 结果
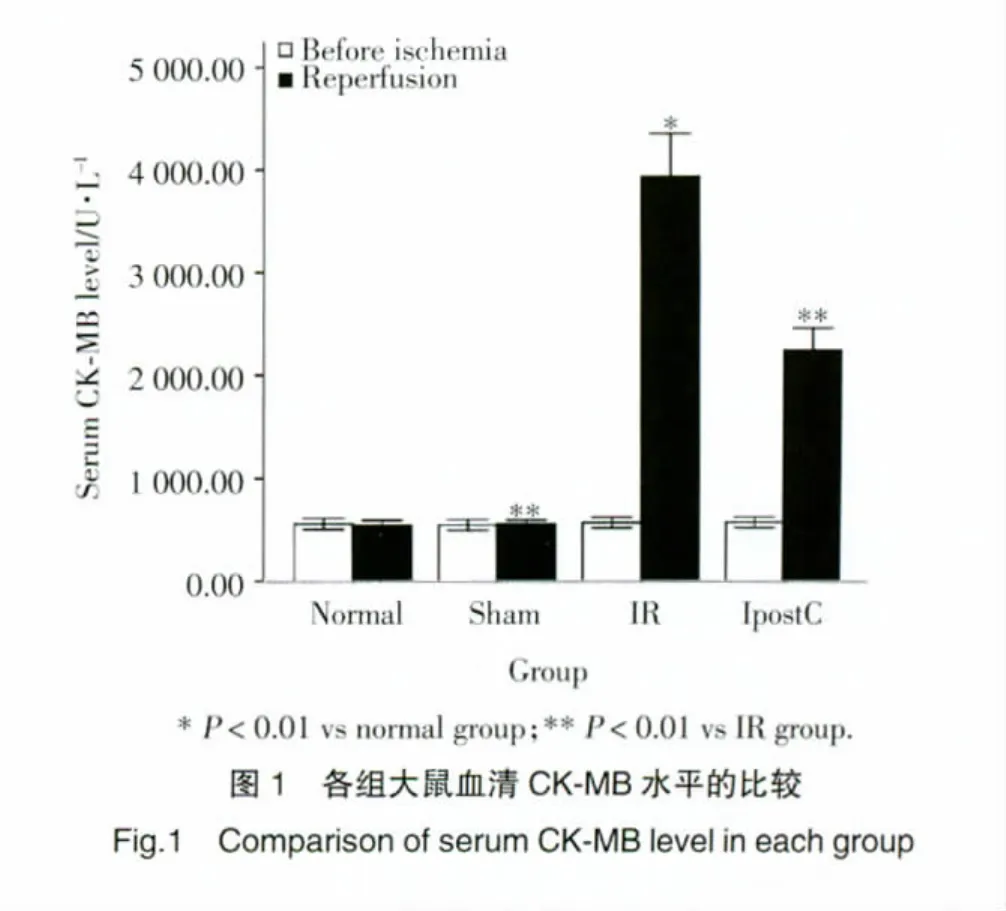
2.1 各组大鼠血清中CK-MB水平的比较
比较缺血前各组大鼠血清CK-MB,无统计学差异(P>0.05);再灌注2 h后,IR组血清CK-MB明显升高,与正常组、sham组比较,差异有统计学意义(P<0.01),IPostC组血清CK-MB水平明显低于IR组,差异有统计学意义(P<0.01)。见表1,图1。
表1 各组大鼠血清中C K-M B水平的比较(±s,n=1 2)T a b.1 C o m p a r i s o n o f s e r u m C K-M B l e v e l i n e a c h g r o u p(±s,n=1 2)

表1 各组大鼠血清中C K-M B水平的比较(±s,n=1 2)T a b.1 C o m p a r i s o n o f s e r u m C K-M B l e v e l i n e a c h g r o u p(±s,n=1 2)
1)P<0.0 1 v s n o r m a l g r o u p;2)P<0.0 1 v s I R g r o u p.
?
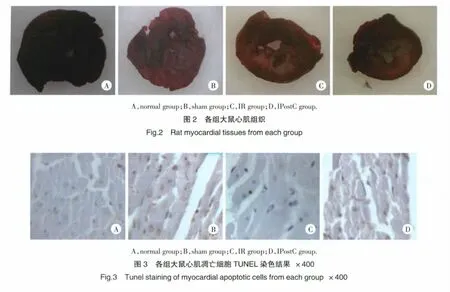
2.2 各组大鼠心肌梗死面积的比较
非缺血心肌被染成蓝色,缺血心肌被染成砖红色,梗死心肌呈灰白色。经图像分析系统计算IS/AAR,结果显示:IR组可见明显的梗死心肌,IS/AAR为29.6%±4.3%,与IPostC组(16.9%±2.6%)比较,心肌梗死面积明显减小,差异有统计学意义(P<0.05)。见图2。
2.3 各组大鼠心肌细胞AI的比较
TUNEL染色结果(图3)显示:凋亡细胞胞核被染成棕黄色,正常组、sham组仅可见少量的凋亡细胞,IR组凋亡细胞明显增多,计算AI结果显示:IR组AI(25.1%±4.0%)高于正常组(3.6%±0.6%)和sham组(3.8%±0.4%),差异有统计学意义(P<0.01)。IPostC 组 AI(15.9%±2.9%)明显低于 IR 组(25.1%±4.0%),差异有统计学意义(P<0.01)。
3 讨论
IPostC可减轻心肌I/RI,但其作用机制目前尚不完全清楚。研究证实,在心肌I/RI中,梗死和凋亡是细胞数量减少的原因,它们共同参与了I/RI中心肌细胞的死亡过程。本研究采用梗死面积和AI作为检测糖尿病大鼠心肌I/RI的指标。采用TTC染色法检测了大鼠心肌梗死面积,非缺血心肌被染成蓝色,缺血心肌被染成砖红色,梗死心肌呈灰白色。结果显示:IPostC能减小大鼠心肌梗死面积,降低IS/AAR比值。CK-MB是心肌受损的重要指标,当心肌受损时CK-MB从心肌细胞释放入血中。本研究结果显示:IPostC在减小大鼠心肌梗死范围的同时,能够降低大鼠血清中CK-MB水平,提示IPostC能够减轻糖尿病大鼠心肌I/RI的程度。
细胞凋亡是指在一定的生理或病理条件下遵循自身的程序,由基因调控的主动的死亡过程。它是扩大心肌梗死范围的一个独立因子,不仅可影响心肌梗死的面积,而且能够促使心脏重构[9]。心肌凋亡细胞主要位于心肌梗死区周围。心肌细胞被多种病理性因素(如血管堵塞、缺氧及生物毒性等)刺激后,通过细胞信号传导系统诱发凋亡程序启动。细胞凋亡是I/RI的特征性改变,细胞凋亡的发现对I/RI预后的判断具有重要意义。提示我们可以从细胞凋亡角度对缺血再灌注后心功能的恢复及心肌保护进行研究[9,10]。本研究采用TUNEL法进行心肌细胞凋亡检测,凋亡细胞胞核被染成棕黄色。结果显示:IPostC可明显抑制I/RI引起的心肌细胞凋亡,降低I/RI的程度,从而起到保护心肌的作用。
本课题组已证实IPostC可通过激活PI3K/AKT信号通路,调控Bcl-2、Bax蛋白的活化,从而发挥对糖尿病大鼠缺血再灌注心肌的保护作用,但PI3K/AKT信号通路激活下游后如何发挥心肌保护作用还有待进一步研究[11]。
[1]Zhao JL,Yang YJ,You SJ,et a1.Different effects of postconditioning on myocardial no-reflow in the normal and hypercholesterolemic mini-swines[J].Microvasc Res,2007,73(2):137-142.
[2]Zhao ZQ,Corvera JS,Halkos ME,et al.Inhibition of myocardial injury by ischemic postconditioning during reperfusion:comparison with ischemic preconditioning[J].Am J Physiol Heart Circ Physio1,2003,285(2):H579-H588.
[3]Yang XM,Philipp S,Downey JM,et al.Postconditioning′s protection is not dependent on circulation blood factors or cells but involves adenosine receptors and requires PI3-kinase and guanylate cyclase activation[J].Basic Res Cardiol,2005,100(1):57-63.
[4]Song WY,Dong HL,Cheng Q,et al.Ischemic postconditioning induces neuroprotectionvia up-regulationof endogenous antioxidant en-zyme activities:experiment with rabbits [J].Zhonghua Yi Xue Za Zhi,2008,88(33):2355-2359.
[5]Zhang YM,Wang Y,Liu XH,et al.Cardioprotective effect of edaravone pharmacological postconditioning on acute myocardial ischemia/reperfusion injury:experiment with rat[J].Zhonghua Yi Xue Za Zhi,2008,88(36):2558-2561.
[6]Wang KX,Hu SY,Jiang XS,et al.Protective effects of ischaemic postconditioning on warm/cold ischaemic reperfusion injury in rat liver:a comparative study with ischaemic preconditioning[J].Chin Med J,2008,121(20):2004-2009.
[7]孙凯,刘志苏,孙权.缺血后处理对肝脏缺血再灌注损伤的保护作用[J].南方医科大学学报,2009,29(12):2480-2484.
[8]朱伟伟,王鹏程,李小松.IL-17在缺血再灌注损伤中作用的研究进展[J].首都医科大学学报,2011,32(2):304-307.
[9]Gross ER,Gross GJ.Ligand triggers of classical preconditioning and postconditioning[J].Cardiovasc Res,2006,70(2):212-221.
[10]PaillardM,GomezL,Augeul L,et al.Postconditioning inhibits mPTP opening independent of oxidative phosphorylation and membrane potential[J].J Mol Cell Cardiol,2009,46(6):902-909.
[11]邹国良,仲维莉,胡健.缺血后处理对糖尿病大鼠缺血再灌注心肌细胞凋亡的影响[J].中国医科大学学报,2009,38(10):745-748.

