婴儿双歧杆菌介导HSV-TK/GCV自杀基因治疗系统对大鼠膀胱癌组织细胞凋亡及Fas/FasL表达的影响
喻备,王亚荣,殷祥瑞,唐伟
(重庆医科大学附属第一医院泌尿外科,重庆 400016)
膀胱癌是严重威胁人类健康的疾病,是泌尿系统中最常见的恶性肿瘤之一。手术、化疗及放疗后患者复发率高,生存率不理想。肿瘤的基因治疗是国内外研究的热点,单纯疱疹病毒胸苷激酶基因(herpes simplex virus thymidine kinase,HSV-TK)/丙氧鸟苷(ganciclovir,GCV)是目前研究最早最彻底的,广泛用于肿瘤基因治疗的自杀基因系统,而寻找肿瘤特异的靶向基因治疗载体是肿瘤基因治疗成功的关键技术,也是肿瘤基因治疗的难点。国内外研究已证实[1~3],双歧杆菌对肿瘤组织的厌氧坏死区有特异的靶向性,同时对人体具有较高的安全性,是一种良好的肿瘤基因治疗靶向载体。作者前期研究曾利用婴儿双歧杆菌(bifidobacterium infantis,BI)介导pGEX-TK/GCV治疗大鼠膀胱癌,发现其疗效显著,膀胱肿瘤细胞凋亡明显增加[4],但是其机制仍不十分清楚。研究证实[5],Fas/FasL信号通路介导的细胞凋亡在肿瘤的发生发展过程中扮演了重要角色。本实验在验证双歧杆菌介导pGEX-TK/GCV治疗大鼠膀胱癌疗效的同时,探讨Fas/FasL介导的死亡受体信号通路是否参与了双歧杆菌介导pGEX-TK/GCV治疗系统诱导大鼠膀胱癌细胞凋亡的过程,旨在进一步明确其抑癌作用的分子机制。
1 材料与方法
1.1 材料
1.1.1 药品与试剂:婴儿双歧杆菌-pGEX-TK菌种、婴儿双歧杆菌-pGEX-5X-1菌种由本实验室保存,N-甲基亚硝基脲(N-Nitroso-N-methylurea,MNU)购自美国Sigma公司,TUNEL试剂盒购于瑞士Roche公司,RT-PCR试剂盒(DRR037S)、DNAMakerDL2000购于TaKaRa公司,兔抗大鼠Fas、FasL多克隆抗体购自Santa Cruz公司(北京中杉生物技术公司分装),兔抗大鼠GAPDH购于武汉三鹰生物技术有限公司,山羊抗兔二抗、多聚甲醛、PVDF膜购于北京鼎国生物试剂公司,GCV购于宜昌长江药业有限公司(批号1011001)。PMSF、BCA法蛋白定量试剂盒、SDS-Page凝胶电泳试剂盒和ECL显影剂均购自碧云天生物技术有限公司。
1.1.2 动物:选用健康成年雌性SD大鼠70只,8~10周龄,体质量180~200 g,饲养环境为重庆医科大学动物实验中心无特定病原体(specific pathogen free,SPF)动物房。动物房温度为(25±2)℃,湿度为(60±5)%,12 h昼夜节律。大鼠可以自由饮水和进食。
1.1.3 仪器:光学显微镜、荧光显微镜BX51(日本Olympus),低温高速离心机(长沙湘仪公司),PCR仪、凝胶成像系统(BIO-RAD公司),紫外分光仪(GE公司)。
1.2 方法
1.2.1 大鼠膀胱癌模型的建立及分组:采用MNU膀胱灌注法[6]建立SD大鼠膀胱癌模型,选取荷瘤大鼠54只。将54只荷瘤大鼠随机分成3组,每组18只,分别为:生理盐水对照组(生理盐水组)、BI-pGEX-5X-1组(空质粒组)、BI-pGEX-TK组(重组质粒组)。分别经尾静脉注射生理盐水、BI-pGEX-5X-1菌液、BI-pGEX-TK菌液0.5 mL(含重组婴儿双歧杆菌约4.4×109个),间隔7 d重复注射1次,共4次。从处理第1天开始,各组大鼠连续28 d腹腔注射GCV(50 mg/kg)。于治疗结束后第1天采用断颈法处死大鼠,解剖膀胱肿瘤,4%多聚甲醛固定,常规石蜡包埋、切片、HE染色。
1.2.2 各组荷瘤大鼠膀胱质量测定:于治疗结束后采用断颈法处死大鼠,沿大鼠腹壁中线逐层进入腹腔,仔细分离膀胱,去除膀胱周围脂肪组织,紧贴膀胱壁离断输尿管,向下解剖暴露膀胱颈部至前列腺,于前列腺上缘离断膀胱。纵行解剖膀胱,观察膀胱内肿瘤生长情况,然后用滤纸吸干液体,称取各组荷瘤大鼠膀胱的质量。
1.2.3 TUNEL法原位检测膀胱肿瘤细胞的凋亡及半定量分析:实验步骤按TUNEL试剂盒说明书操作。在荧光显微镜下观察拍照后,加HRP标记的抗荧光素抗体,DAB显色,普通光学显微镜观察。细胞核固缩、染色质凝集成块、呈棕褐色染色者为凋亡细胞。每张切片计数5个视野,每个视野计数100个细胞,凋亡指数计算(apoptotic index,AI),AI=凋亡细胞数/细胞总数。
1.2.4 半定量RT-PCR检测Fas、FasLmRNA水平:取50 mg大鼠膀胱肿瘤组织用眼科剪剪碎,放入灭酶的匀浆器中,加入1 mL TRIzol提取各组膀胱肿瘤总RNA,紫外分光光度计定量,各取2 μg总RNA为模板逆转录为cDNA,用1 μL cDNA为模板分例进行PCR扩增。根据大鼠Fas/FasLcDNA序列由上海生工设计并合成RT-PCR引物,见表1。PCR扩增体系体积为25 μL,反应条件:预变性95℃5 min,变性 95 ℃ 30 s,退火 58 ℃ 30 s,延伸 72 ℃ 30 s,30个循环,72℃延伸10 min,4℃终止反应。每例取5 μL RT-PCR产物在2.0%琼脂糖凝胶中电泳,以GAPDH作为内参照,凝胶成像系统摄像并用Quantity One软件测定各条带与GAPDH的积分光密度(integrated optical density,IOD)值,其比值为各目的基因的相对表达量。实验重复3次。
1.2.5 Western blot检测大鼠膀胱肿瘤Fas/FasL蛋白表达:将100 mg大鼠膀胱肿瘤用眼科剪剪碎为小块,放入匀浆器中,加入990 μL RIPA及10 μL 10 mg/mL PMSF溶液,用力研磨成均匀一致的悬液,收集悬液,12 000 r/min,4℃离心15 min,吸取上清液至1.5 mL EP管中,用BCA蛋白定量试剂盒测定蛋白浓度。于总蛋白中加入SDS-PAGE蛋白上样缓冲液后在沸水中处理10 min,取总蛋白40 μg上样,8%SDS-PAGE电泳,切胶,半干电转膜仪电转移至硝酸纤维素膜上,5%脱脂奶粉37℃封闭1.5 h,然后分别加入兔抗大鼠GAPDH、Fas、FasL一抗,4℃孵育过夜,TBST漂洗3次,10 min/次。加入HRP标记的山羊抗兔二抗,37℃孵育1 h,TBST漂洗3次,10 min/次。ECL显色,凝胶成像系统摄像并测定各目的条带与GAPDH条带的灰度值,目的条带/GAPDH条带比值为各目的蛋白的相对表达量。

表1 RT-PCR引物序列Tab.1 Primer sequences for RT-PCR
1.3 统计学处理
2 结果
2.1 大鼠膀胱癌建模及病理结果
大鼠膀胱癌建模过程中死亡11只,其中2只在膀胱灌注第8周死亡,解剖发现膀胱内有新生物,病理证实为膀胱移行细胞癌。选取的54只荷瘤大鼠在治疗过程中无死亡,其中有8只出现肉眼血尿,2只出现明显脓尿。
生理盐水组及空质粒组肉眼观察及HE染色结果可见大鼠膀胱壁增厚,其表面可见米粒样、菜花样新生物,基底宽,有的表面有溃疡伴出血性坏死。细胞异形性明显,表现为细胞大小不一,排列紊乱,极性消失;核畸形,核染色质呈粗颗粒状,常堆积于核膜下;核膜增厚,核仁肥大,核质比例大,核分裂像明显,部分表现为癌细胞高度未分化,移行上皮结构特征消失,呈弥漫分布或排列成实体性癌,多乳头粗短融合,伴局灶性黏膜下、肌层浸润(图1A、1B)。重组质粒婴儿双歧杆菌组:相对于生理盐水组,肿瘤体积变小,部分出现肿瘤细胞坏死,肿瘤细胞形态变化不大,间质有炎细胞侵润(图1C)。各组其他脏器均未见异常。

2.2 各组荷瘤大鼠膀胱质量比较
与生理盐水组及空质粒组比较,重组质粒组荷瘤大鼠膀胱质量明显降低(P<0.05)。空质粒组与生理盐水组比较,荷瘤大鼠膀胱癌的质量无统计学差异(P>0.05)。表明双歧杆菌介导HSV-TK/GCV能明显抑制荷瘤大鼠膀胱癌生长。见表2。
表2 各组荷瘤大鼠膀胱质量及AI值(±s)Tab.2 The bladder weights and apoptotic index in rat bladder tumor model(±s)
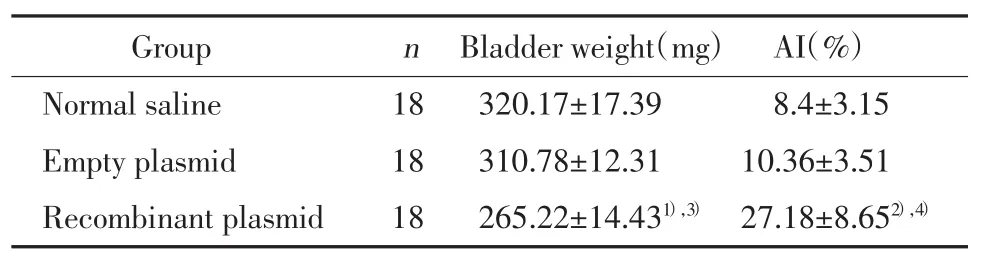
表2 各组荷瘤大鼠膀胱质量及AI值(±s)Tab.2 The bladder weights and apoptotic index in rat bladder tumor model(±s)
1)P<0.05,2)P<0.01 vs normal saline group;3)P<0.05,4)P<0.01 vs empty plasmid group.
GroupnBladder weight(mg)AI(%)Normal saline 18 320.17±17.39 8.4±3.15 Empty plasmid 18 310.78±12.31 10.36±3.51 Recombinant plasmid 18 265.22±14.431),3) 27.18±8.652),4)
2.3 大鼠膀胱肿瘤组织中凋亡细胞分布及变化
TUNEL法原位检测发现各组荷瘤大鼠膀胱肿瘤组织均出现不同程度的凋亡细胞(图2),以重组质粒组最多。与生理盐水组及空质粒组比较,重组质粒组AI值显著增高(P<0.01);空质粒组与生理盐水组AI值比较无统计学差异(P>0.05),见表2。

2.4 大鼠膀胱肿瘤组织Fas/FasLmRNA表达
RT-PCR结果显示,与空质粒组及生理盐水组比较,重组质粒组Fas/FasLmRNA水平显著增高(P<0.05),空质粒组与生理盐水组比较,Fas/FasLmRNA水平无统计学差异(P>0.05)。见图3。

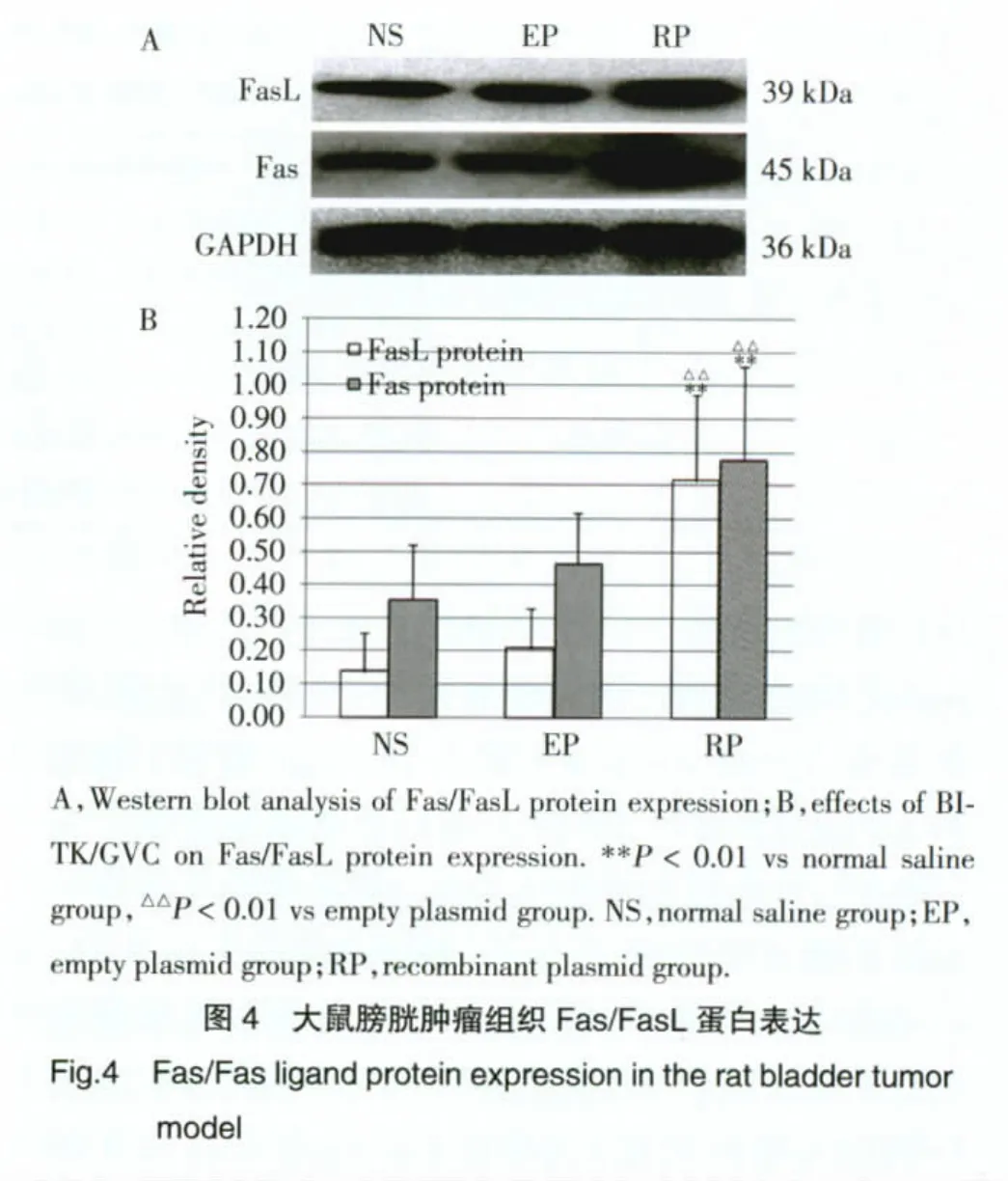
2.5 大鼠膀胱肿瘤组织Fas/FasL蛋白表达
Western blot结果显示,重组质粒组Fas/FasL蛋白表达水平明显高于空质粒组及生理盐水组(P<0.01),空质粒组和生理盐水组比较,Fas/FasL蛋白表达无统计学差异(P>0.05)。见图4。
3 讨论
HSV-TK/GCV是目前广泛用于肿瘤基因治疗研究的自杀基因系统之一,其产生自杀作用的确切效果已被许多研究所证实[7],并已经开始进行临床试验[8]。寻找一种安全、高效、特异的靶向性载体成为其推广应用的关键。Li等[9]研究证实婴儿双歧杆菌介导可溶性VEGF受体能抑制小鼠肺癌生长,Yazawa等[10]研究证实人工诱导乳腺瘤的大鼠经尾静脉注射人源双歧杆菌后能特异性地在瘤内增殖,并引起肿瘤组织萎缩,延长荷瘤鼠的生存期。这些研究均表明,双歧杆菌作为载体治疗实体肿瘤是可行的。本实验发现,重组质粒组处理荷瘤大鼠膀胱癌,大鼠膀胱质量显著降低,对实验大鼠心、肝、肾和脑组织切片观察,未发现明显异常。结果表明,双歧杆菌介导pGEX-TK/GCV治疗系统治疗荷瘤大鼠膀胱癌是安全、有效的。
HSV-TK/GCV治疗肿瘤的机制也已经有了比较广泛和深入的研究。目前认为,其主要机制为:一是自杀效应,另一个是旁观者效应,它们可能部分通过诱导肿瘤细胞凋亡产生效应[11~13]。叶刚等[14]利用逆转录病毒携带HSV-TK基因膀胱灌注治疗大鼠膀胱肿瘤,发现大鼠膀胱癌体积有所缩小,肿瘤细胞发生明显凋亡。作者利用双歧杆菌作为载体,成功构建了婴儿双歧杆菌介导pGEX-TK/GCV治疗系统,并初步证实了其治疗荷瘤大鼠膀胱癌的疗效,同时发现婴儿双歧杆菌介导pGEX-TK/GCV处理后,大鼠膀胱癌组织细胞凋亡明显增加,caspase 3表达也显著增高[4]。本实验中,重组质粒组荷瘤大鼠膀胱癌组织细胞凋亡显著增加,而空质粒组与生理盐水组比较无统计学差异,表明婴儿双歧杆菌介导pGEX-TK/GCV治疗荷瘤大鼠膀胱癌,其主要机制可能是通过诱导膀胱癌组织细胞凋亡实现的。
细胞凋亡是由死亡信号诱发的受调节的细胞死亡过程,因此诱导肿瘤细胞凋亡是治疗肿瘤的一种有效途径。细胞凋亡的信号通路主要有两条:一是细胞外信号激活胞内凋亡酶而诱发凋亡,即死亡受体信号通路;另一条是通过细胞内线粒体释放凋亡酶激活因子激活凋亡酶而发生凋亡。研究证实[5,15],Fas/FasL是死亡受体信号通路诱导凋亡的一个重要途径。Fas是一种属于肿瘤坏死因子受体超家族成员的膜蛋白,在细胞凋亡过程中起着重要的作用,与其配体FasL结合后,激活下游效应蛋白caspase 3诱导表达Fas蛋白的细胞发生凋亡。研究证实[16,17],膀胱肿瘤细胞的凋亡与Fas/FasL死亡受体信号通路密切相关。本实验中,重组质粒组大鼠膀胱肿瘤细胞凋亡明显增加,Fas/FasLmRNA及蛋白表达均显著增高,说明Fas/FasL死亡受体信号通路可能参与了婴儿双歧杆菌介导pGEX-TK/GCV治疗荷瘤大鼠膀胱癌所诱导的凋亡。此外,除了本实验所证实Fas/FasL死亡受体信号通路表达变化对婴儿双歧杆菌介导pGEX-TK/GCV治疗荷瘤大鼠膀胱癌诱导凋亡有影响外,其他诱导凋亡的途径(如胞内线粒体控制的凋亡途径)在婴儿双歧杆菌介导pGEX-TK/GCV治疗荷瘤大鼠膀胱癌诱导凋亡所起的作用还有待进一步研究。本实验结果结合前期所证实caspase 3蛋白表达上调[4]提示,激活Fas/FasL死亡受体信号通路,引起下游caspase 3蛋白表达上调,从而诱导膀胱肿瘤细胞凋亡可能是婴儿双歧杆菌介导pGEXTK/GCV治疗荷瘤大鼠膀胱癌发挥抑癌作用的机制之一。
[1]Fujimori M,Amano J,Taniguchi S.The genus bifidobacterium for cancer gene therapy[J].Curr Opin Drug Discov Devel,2002,5(2):200-203.
[2]Li X,Fu GF,Fan YR,et al.Bifidobacterium adolescentis as a delivery system of endostatin for cancer gene therapy:selective inhibitor of angiogenesis and hypoxic tumor growth[J].Cancer Gene Ther,2003,10(2):105-111.
[3]Lee do K,Jang S,Kim MJ,et al.Anti-proliferative effects of bifidobacterium adolescentis SPM0212 extract on human colon cancer cell lines[J].BMC Cancer,2008,27(8):310-317.
[4]Tang W,He YF,Zhou SC,et al.A novel bifidobacterium infantismediated TK/GCV suicide gene therapy system exhibits antitumor activity in a rat model of bladdercancer[J].ExpClinCancerRes,2009,16(28):155-161.
[5]Nagata S,Golstein P.The Fas death factor[J].Science,1995,267(5203):1449-1456.
[6]Irving CC,Cox R,Murphy WM,et al.Influence of dose of N-nitrosourea on the induction of urinary bladder cancer in rats[J].Cancer letter,1979,8(1):3-7.
[7]曾曙光,刘启才,王素文,等.mtHSP70/HSV-tk重组沙门菌抗小鼠黑色素瘤的作用[J].南方医科大学学报,2012,32(1):101-105.
[8]Herman JR,Adler HL,Aguilar-Cordova E,et al.In situ gene therapy for adenocarcinoma of the prostate:a phase I clinical trial[J].Hum Gen Ther,1999,10(7):1239-1250.
[9]Li ZJ,Zhu H,Ma BY,et al.Inhibitory effect of bifidobacterium infantis-mediated sKDR prokaryotic expression system on angiogenesis andgrowthoflewislungcancerinmice[J].BMCCancer,2012,12:155-166.
[10]Yazawa K,Fujimori M,Nakamura T,et a1.Bifidobacterium longum as a delivery system for gene therapy of chemically induced rat mammarytumors[J].BreastCancerResTreatment,2001,26(2):165-170.
[11]Hamel W,Magnelli L,Chiarugi VP,et al.Herpes simplex virus kinase/gancicliv-mediated apoptotic death of bystander cells[J].Cancer Res,1996,56(12):8699-8704.
[12]Jiang W,Liu XX,Kang Y,et al.Therapeutic effect of ovarian intraarterial infusion of GE7-delivery system-mediated HSVl-tk/ganciclovir gene therapy in a rat model of malignant ovarian tumor[J].Zhonghua Zhong Liu Za Zhi,2012,34(4):245-248.
[13]Christian B,Simone F,Thomas K,et al.Mitochondrial amplification of death signals determines thymidine kinase/ganciclovir-triggered activation of apoptosis[J].Cancer Res,2000,60(12):3212-3217.
[14]叶钢,宋晓峰,张荣贵,等,膀胱灌注逆转录病毒载体HSV—TK基因治疗大鼠膀胱癌[J].华南国防医学,2004,18(6):18-21.
[15]郑佳,刘复强.Fas/FasL及其临床意义[J].首都医科大学学报,2004,25(3):411-414.
[16]韩斌,吴斌,杜强.FAS系统和p27蛋白在膀胱移行细胞癌中的表达及临床意义[J].中国医科大学学报,2005,34(2):155-156.
[17]Li CG,Li MO,Shu XH,et al.Antitumor effects of recombinant human Interleukin-6 on mouse bladder carcinoma through Fas-mediated apoptosis[J].Cancer Chemother Pharmacol,2010,66(5):981-986.

