氧化苦参碱对高果糖喂养诱导大鼠脂肪肝和肝脏内质网应激的干预作用
任路平,宋光耀,霍丽静,刘娜,陈树春
(河北省人民医院1.内分泌科;2.检验科,石家庄 050051)
近年来,非酒精性脂肪肝(nonalcoholic fatty liver disease,NAFLD)的发病率逐年升高,膳食因素中糖的过量摄入可促进脂肪肝发生发展[1],NAFLD具体的发病机制尚不明确,研究表明可能与肝脏内质网应激等有关[2],目前尚缺乏有效治疗NAFLD的药物。
氧化苦参碱是苦参碱类生物碱之一,常用于治疗慢性肝炎,既往研究发现,苦参碱可降低实验性大鼠脂肪肝的肝损伤[3],但具体机制尚未阐明。本研究应用氧化苦参碱干预慢性高果糖喂养诱导的大鼠脂肪肝,观察氧化苦参碱对大鼠胰岛素抵抗和肝脏脂质沉积影响;观察高果糖喂养和氧化苦参碱干预对肝脏内质网应激(endoplasmic reticulum stress,ERS)标志物的影响,旨在探讨高果糖摄入引起脂肪肝的机制及氧化苦参碱改善脂肪肝的可能机制。
1 材料与方法
1.1 实验动物
成年雄性Wistar大鼠由河北医科大学实验动物中心提供。按照随机分组的原则分为对照组、高果糖组和氧化苦参碱组,每组大鼠为15~16只,体质量250~280 g,对照组进食普通饲料;果糖组果糖占总热量34.5%,高果糖饲料配方参考文献[4],具体为:果糖34.5%,淀粉34.5%,脂肪9%,蛋白质21%;喂养4周后,氧化苦参碱组每日灌胃给予氧化苦参碱(苦参素胶囊,江苏正大天晴药业股份有限公司,40 mg/kg);3组每日进食热量基本相等,喂养16周后处死大鼠,采血测定相关指标及肝总质量,留取肝组织。
1.2 检测指标及方法
1.2.1 血液学指标测定:各组大鼠喂养16周后禁食10 h,采用快速血糖测定仪测定空腹血糖(FBG);颈动脉取血,分离血清,用放射免疫法测定空腹血胰岛素(FINS);HOMA 胰岛素抵抗指数(HOMA index of insulin resistance,HOMA-IR)计算方法:HOMA-IR=空腹血糖(mmol·L-1)×空腹胰岛素(μIU·mL-1)/22.5。全自动生化分析仪测定大鼠血清谷丙转氨酶(ALT)、谷草转氨酶(AST)。
1.2.2 肝脏甘油三酯(TG)测定:取肝脏组织30 mg经氯仿/甲醇抽提甘油三酯后,加入0.6%NaCl分离水相和有机相,吸取有机相待干燥后溶于100%乙醇 (500 μL),应用 GPO-PAP 试剂盒(boehringer mannheim,Germany)测定 TG 含量。
1.2.3肝脏病理变化检查——油红O染色步骤:新鲜肝组织冰冻切片7 μm,风干载玻片30 min,10%中性甲醛中固定10~15 min,然后水洗;置于密封容器盛装的脂肪染色剂内(稀释后的油红染液)10~15 min;用60%乙醇分色、水洗;苏木精淡染核30 s,1%磷酸氢二钠冲洗至变蓝;稍干后甘油明胶封固。
1.2.4 肝脏内质网应激分子标志物基因表达测定:采用Trizon提取组织总RNA,采用SYBR Green实时检测的逆转录聚合酶链反应(RT-PCR)检测内质网应激分子标志物糖调节蛋白78(glucose-regulated protein,GRP78)和 C/EBP 同源蛋白(C/EBP-homologous protein,CHOP)基因的表达(PE9600荧光定量仪,美国 Perkin Elmer)[5]。PCR 体系 50 μL,5×SYBR Green10 μL,2 U/μLTaq 酶 1.5 μL,25 mmoL/L 脱氧核苷三磷酸 0.5 μL,10 μmoL/L 上游引物 10 μmoL/L下游引物 1 μL,cDNA 模板 5 μL,双蒸水 30 μL。于循环延伸反应最后时刻收集荧光信号。标准曲线制备:10倍梯度稀释标准品,各取2.5 μL做定量模板,反应体系及条件同上,同时设阴性对照。以稀释倍数的对数为横坐标,循环域值(Ct)为纵坐标,软件分析系统可自动绘制出标准曲线,并得到相应各待测样本的值和起始拷贝数。每组随即选取6只小鼠进行基因检测。GRP78基因检测引物序列:上游5′-AGGACAAGAAGGAGGATGTGGG-3′,下游 5′ACCG AAGGGTCATTCCAAGTG-3′;CHOP 基因检测引物序列:上游 5′-TTCACTACTCTTGACCCTGCGTC-3′,下游 5′-CACTGACCACTCTGTTTCCGTTTC-3′。 内参GAPDH的引物序列:上游5′-CATCACCATCTTCC AGGAGCG-3′,下游:5′-TCACCTTGCCCACAGCCTT G-3′。
1.2.5 肝脏ERS标志物蛋白表达测定:采用Western blot法测定磷酸化胰腺内质网激酶(phosphorylated pancreatic ER kinase,p-PERK)、磷酸化山梨醇要求激酶1(phosphorylated inositol-requiring enzyme 1,p-IRE1)和活化转录因子 6(activating transcription factor-6,ATF-6)蛋白表达。于肝脏组织匀浆中加入10倍裂解液,13 000 r/min离心15 min,BCA法测蛋白含量。取20 μg蛋白进行10%聚丙烯凝胶电泳,湿法电转移至硝酸纤维素膜上,5%脱脂奶粉室温封闭1 h后,加入1∶1 000稀释的抗体,4℃摇床过夜,TTBS缓冲液洗膜后加入1∶10 000稀释的辣根过氧化物酶标记的山羊抗兔抗体,室温孵育1 h,最后用ECL化学发光法检测,膜与化学发光底物孵育,经X胶片曝光显影。用IMAGEJ软件分析,以目的蛋白的灰度值除以内参14-3-3的灰度值以校正误差,所得结果代表某样品的目的蛋白相对含量。每组随机选6例样本进行蛋白表达分析。p-PERK抗体(磷酸化位点:Thr980)由 cell signaling 公司提供,p-IRE1(磷酸化位点:Ser724)抗体、总IRE-1抗体由ABCAM公司提供,ATF-6由Santa Cruz公司提供。内参抗体GADPH由Kangchen公司提供。
1.3 统计学处理
2 结果
2.1 实验16周后各组大鼠指标检测结果
各组大鼠实验起始体质量无统计学差异(P>0.05),饲料喂养16周后高果糖组大鼠体质量高于对照组(P<0.01);氧化苦参碱组体质量较高果糖组大鼠体质量明显减轻(P<0.01),而与对照组比较无统计学差异(P>0.05)。高果糖组的血葡萄糖、血胰岛素及HOMA指数较对照组明显增加(P<0.01),经氧化苦参碱干预后血葡萄糖、血胰岛素及HOMA指数较高果糖组显著降低(P<0.01)。与对照组比较,高果糖组的血清ALT、AST、肝质量及肝脏TG水平显著增高(P均<0.01),氧化苦参碱组上述指标均显著低于高果糖组(P均<0.01),见表1。
表1 各组大鼠喂养16周时的基本指标(±s)Tab.1 Basic characteristics in rats after 16-week feeding(±s)

表1 各组大鼠喂养16周时的基本指标(±s)Tab.1 Basic characteristics in rats after 16-week feeding(±s)
1)P < 0.05,2)P < 0.01 vs control group;3)P<0.05,4)P<0.01 vs high fructose group.
GroupBody mass(g)FBG(mmol/L)FINS(mIU/L)HOMA indexSerum ALT(IU/L)Serum AST(IU/L)Liver weight(g)Liver TG(μmol/g)Control group 434±23 5.4±0.4 11.5±3.4 2.76±0.36 38.2±4.8 82.5±10.1 12.2±0.3 8.6±0.2 High fructose group 489±201) 6.6±0.52) 17.9±2.12) 5.26±0.342) 54.1±3.92) 104.8±8.22) 16.4±0.72) 28.2±2.32)Oxymatrine group 452±183) 5.9±0.64) 12.8±1.84) 3.36±0.414) 48.6±3.54) 94.3±9.84) 13.9±0.32),4) 16.1±1.81),4)
2.2 肝组织油红O染色结果
对照组大鼠肝细胞排列紧密,边缘清晰,胞质未见脂滴;高果糖组大鼠肝细胞内可见大量脂滴;而氧化苦参碱组大鼠肝细胞脂滴较对照组明显减少(图1)。

2.3 各组小鼠肝脏内质网分子伴侣GRP78、CHOP的基因表达水平
与对照组比较,高果糖组GRP78、CHOPmRNA水平显著增高(P<0.01),而氧化苦参碱组的GRP78、CHOPmRNA水平较对照组显著下降(P<0.01),见表2。
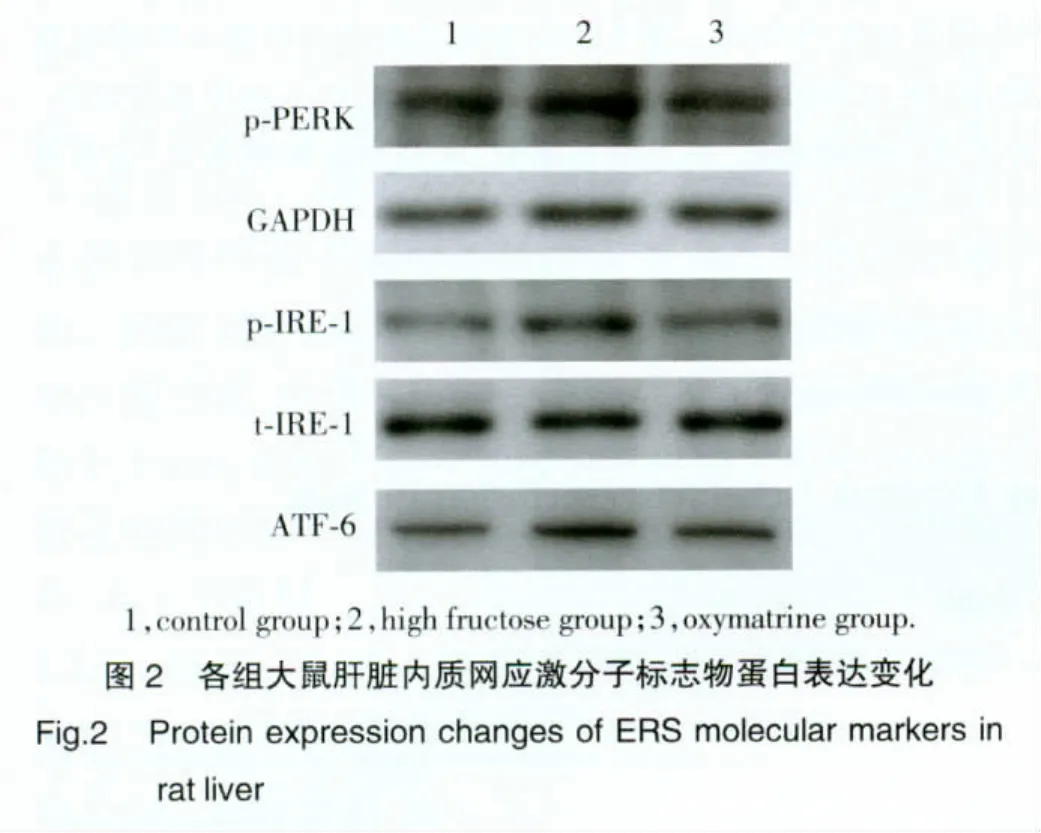
2.4 各组肝脏ERS标志物的蛋白表达
与对照组比较,高果糖组p-PERK、p-IRE-1/t-IRE-1和ATF-6蛋白表达均明显增加(P<0.01),而氧化苦参碱组大鼠的上述蛋白表达水平较高果糖组显著下降(P<0.01),见图 2,表 3。
表2 各组大鼠内质网伴侣分子GRP78和CHOP的基因表达(±s)Tab.2 Gene expression of ER chaperonsGRP78andCHOPin rats(±s)

表2 各组大鼠内质网伴侣分子GRP78和CHOP的基因表达(±s)Tab.2 Gene expression of ER chaperonsGRP78andCHOPin rats(±s)
1)P < 0.05,2)P < 0.01 vs control group;3)P<0.01 vs high fructose group.
Group GRP78/GADPH CHOP/GADPH Control group 1.00±0.16 1.00±0.13 High fructose group 2.01±0.242) 1.83±0.122)Oxymatrine group 1.43±0.121),3) 1.41±0.161),3)
3 讨论
NAFLD是一组和代谢综合征相关的脂质沉积肝病的疾病,包括单纯性脂肪肝、非酒精性脂肪性肝炎、肝硬化甚至肝细胞癌[6]。近年来,NAFLD是西方国家最常见的慢性肝病,在我国也较常见,尚缺乏特效的治疗药物。本研究通过16周的慢性高果糖喂养诱导出大鼠肝脏脂质沉积和肝细胞损伤(表现为血 AST、ALT升高),同时伴有 FBG、FINS、HOMA 指数增高等胰岛素抵抗的表现,表明了果糖过量摄入对机体代谢的危害,与既往的研究一致[7]。同时,研究发现,通过氧化苦参碱的干预,高果糖喂养的大鼠肝脏TG显著减少,肝损伤减轻,并伴有糖代谢指标的显著改善,表明氧化苦参碱是一个治疗NAFLD和改善IR的药物。
表3 各组大鼠肝脏内质网应激分子标志物蛋白表达比较(±s)Tab.3 Protein expression in ERS molecular markers in liver in rats(±s)
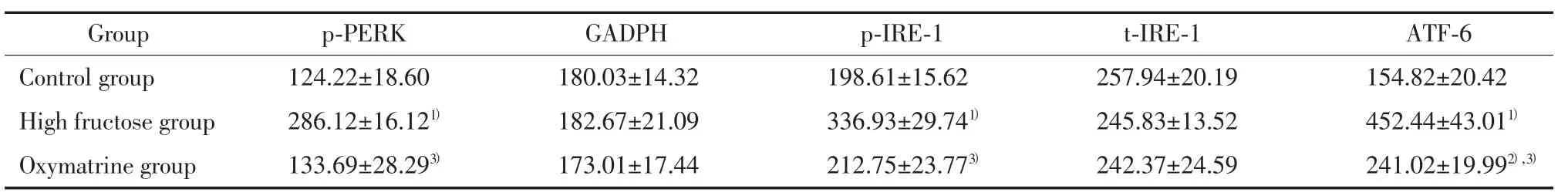
表3 各组大鼠肝脏内质网应激分子标志物蛋白表达比较(±s)Tab.3 Protein expression in ERS molecular markers in liver in rats(±s)
1)P < 0.01,2)P < 0.05 vs control group;3)P<0.01vs high fructose group.
Group p-PERK GADPH p-IRE-1 t-IRE-1 ATF-6 Control group 124.22±18.60 180.03±14.32 198.61±15.62 257.94±20.19 154.82±20.42 High fructose group 286.12±16.121) 182.67±21.09 336.93±29.741) 245.83±13.52 452.44±43.011)Oxymatrine group 133.69±28.293) 173.01±17.44 212.75±23.773) 242.37±24.59 241.02±19.992),3)
近年研究证明ERS与脂肪肝的发生发展有关,通过对ERS的抑制可改善ob/ob小鼠的脂肪肝[8]。当病毒感染、饮食因素失调等引起非折叠蛋白在内质网腔内堆积时,即出现ERS,同时伴有非折叠蛋白反应(unfolded protein response,UPR)。UPR 是ERS的保护机制,目前尚无直接反应ERS的标志物,UPR的通路激活即标志了ERS的发生。UPR有3条途径,分别为磷酸化细胞外信号调节激酶-真核细胞转录起始因子α亚单位(p-PERK-eIF2α)通路、肌醇要求酶1-X盒连接蛋白1(IRE-1-XBP-1)通路和ATF-6通路[9]。本研究检测了慢性高果糖喂养后大鼠肝内3条UPR通路的上游标志物p-PERK、IRE-1和ATF-6,经过16周高果糖饮食喂养,大鼠肝内3种蛋白表达均明显升高,提示反映ERS的UPR的3条途径均被激活,并伴随ERS伴侣分子GRP78和CHOP基因表达的增加,表明高果糖喂养诱导的脂肪肝的发生发展与ERS有关。然而,根据本研究结果,尚不能明确脂肪肝发生与ERS的因果关系,ERS介导果糖诱导的脂肪肝可能有两种机制:一种可能是果糖首先刺激脂质合成[10],继之出现ERS。ER是脂质合成的器官,当果糖诱发肝内大量脂质合成时,ER的工作负荷加重,从而出现ERS;另一个可能是果糖本身在肝脏的大量存在改变了细胞内的营养状态,出现ERS,继之ERS直接促进了脂质沉积。
与高果糖组比较,氧化苦参碱组大鼠的UPR上游标志物的蛋白表达和ERS伴侣分子表达均减少,ERS较高果糖组改善,提示氧化苦参碱减轻高果糖喂养大鼠肝脂质沉积和肝损伤与其改善ERS有关。ERS的改善可能是氧化苦参碱改善大鼠肝脏脂质沉积的始动机制,亦有可能是苦参碱通过其他机制改善肝脏脂质沉积后,脂质沉积减轻后ERS相应缓解,具体的机制尚待进一步研究。
值得提出的是,本研究中慢性高果糖喂养引起小鼠肝脏CHOP基因表达增高。CHOP是反应细胞凋亡的内质网伴侣分子,ERS时CHOP经上游转录元件IREI、PERK和ATF6调控。有研究发现CHOP基因敲除可增强细胞对抗ERS所致凋亡的能力[11]。CHOP对细胞增生及分化具有十分重要的作用,是一个由抗凋亡向促凋亡转换的重要信号分子。通过本研究可以看出,经过16周高果糖喂养后,大鼠肝内CHOP表达升高,提示肝组织内存在肝细胞凋亡事件;而氧化苦参碱组CHOP基因表达降低,提示肝细胞凋亡减轻。
总之,本试验结果表明了果糖过量摄入对肝脏脂质代谢的危害和氧化苦参碱对NAFLD可能的治疗作用,氧化苦参碱治疗可改善高果糖喂养大鼠的肝脏脂质沉积和胰岛素抵抗,其机制可能与氧化苦参碱改善肝细胞ERS有关,具体机制尚需深入研究。
[1]Nseir W,Nassar F,Assy N.Soft drinks consumption and nonalcoholic fatty liver disease[J].World J Gastroenterol,2010,16(21):2579-2588.
[2]Lee AH,Scapa EF,Cohen DE,et al.Regulation of hepatic lipogenesis by the transcription factor XBP1[J].Science,2008,320(5882):1492-1496.
[3]梁建新,屈杏芬,曾文铤,等.氧化苦参碱在治疗慢性乙型肝炎中抗肝纤维化的作用机制[J]. 南方医科大学学报,2010,30(8):1871-1873.
[4]Thorburn AW,Strolien LH,Jenkins AB,et al.Fructose-induced in vivo insulin resistance and elevated plasma triglyceride levels in rats[J].Am J Clin Nutr,1989,49(6):1155-1163.
[5]闫颖,赵咏梅,赵志炜,等.内质网应激通路相关分子GRP78及CHOP在糖尿病脑病小鼠海马表达的变化[J].首都医科大学学报,2011,32(1):190-194.
[6]Moore JB.Non-alcoholic fatty liver disease:the hepatic consequence of obesity and the metabolic syndrome[J].Proc Nutr Soc,2010,69(2):211-220.
[7]Begriche K,Igoudjil A,Pessayre D,et al.Mitochondrial dysfunction in NASH:causes,consequences and possible means to prevent it[J].Mitochondrion,2006,6(1):1-28.
[8]Ozcan U,Yilmaz E,Ozcan L,et al.Chemical chaperones reduce ER stress and restore glucose homeostasis in a mouse model of type 2 diabetes[J].Science,2006,313(5790):1137-1140.
[9]Lee AH,Glimcher LH.Intersection of the unfolded protein response and hepatic lipid metabolism[J].Cell Mol Life Sci,2009,66(17):2835-2850.
[10]Miyazaki M,Dobrzyn A,Man WC,et al.Stearoyl-CoA desaturase 1 gene expression is necessary for fructose-mediated induction of lipogenic gene expression by sterol regulatory element-binding protein-1c-dependent and-independent mechanisms[J].J Biol Chem,2004,279(24):25164-25171.
[11]Oyadomari S,Mori M.Roles of CHOP/GADD153 in endoplasmic reticulum stress[J].Cell Death Different,2004,11(4):381-389.

