增殖细胞核抗原和caspase-3在单侧输尿管梗阻大鼠模型中的表达及其意义
李 里,宫 亮,吴玉斌
1 材料与方法
1.1 材料 2011年5—12月选取清洁级Wistar大鼠48只,雄性,体质量120~150 g,4~6周龄,均购自中国医科大学附属盛京医院实验动物中心。
1.2 方法
1.2.1 分组 48只大鼠采用随机数字表法分为两组,假手术组 (sham组)和模型组 (UUO组)各24只,每组术后3、7、14 d分为3组,每组8只。
1.2.2 动物模型的制备 以10%的水合氯醛 (0.3 ml/kg)腹腔注射麻醉,于左侧耻骨上切口,沿左肾下极寻找到左输尿管,UUO组在输尿管上用4号丝线上下结扎两处,从中剪断输尿管,分层缝合后关闭腹腔;Sham组分离输尿管不结扎,随即缝合腹腔,完成手术。
1.2.3 标本的采集和处理
1.2.3.1 尿 术后3、7、14 d收集24 h内的新鲜尿样,以离心半径8 cm,3 000 r/min,离心15 min,除去沉渣,放置在-80℃的冰箱内,检测β2微球蛋白水平。
1.2.3.2 血术后3、7、14 d大鼠腹主动脉采血4 ml,离心半径8 cm,3 000 r/min,离心10 min,后置于-80℃冰箱保存,检测血肌酐水平。
从图谱中可以看出,我国武术文化研究的作者合作知识图谱呈现集中—分散的状态。每一个节点代表一个发文作者,节点大小代表作者发文数量的多寡,线条数量和粗细代表了作者之间的合作关系及强度。作者的科研能力与发文数量和载文期刊质量成正比,科研团队合作不仅能够促进知识、资源共享,更有助于提高科研产出与学术影响力。
1.2.3.3 肾组织 术后3、7、14 d处死大鼠。留取左侧肾组织,以无菌0.9%氯化钠溶液冲洗,滤纸吸干表面水分,一部分置4%多聚甲醛中固定,制成冷冻切片,待做病理形态学检测和免疫组化。余下分离肾脏皮质和髓质,至-80℃冰箱,待做蛋白印迹 (Western blot)。
1.3 观察指标及检测方法
1.3.1 肾功能检测 全自动生化分析仪 (中国医科大学附属盛京医院检验科)检测尿β2微球蛋白和血肌酐水平。
1.3.2 肾组织形态学检测 苏木素-伊红 (HE)染色,观察肾小管间质损伤的程度。
1.3.3 免疫组织化学染色 (SABC)法检测肾皮质PCNA、caspase-3的表达 实验步骤按照说明书进行。PCNA抗体购自北京生物技术公司。caspase-3(1∶40)为兔抗人多克隆抗体 (美国Zymed公司),SABC试剂盒 (武汉博士德生物公司)。PBS替代一抗作为阴性对照。结果判断:PCNA细胞核染成棕褐色为阳性反应。caspase-3阳性染色主要分布于细胞质中,少部分染于细胞核,呈棕黄色或棕褐色。
1.3.4 阳性细胞百分率和平均灰度测定 应用HPIAS-1000计算机病理图文系统对免疫组化结果进行分析。每张切片随机选取10个不重叠的高倍视野 (×400),分别计肾小管、肾间质阳性细胞和阴性细胞数。阳性细胞百分率=阳性细胞数÷(阳性细胞数+阴性细胞数) ×100%[3]。
1.3.5 Western blot法测定肾皮质PCNA、caspase-3的相对表达量 取大鼠肾皮质100 mg,加入裂解液 (上海吉凯公司提供)500 μl研磨,取出置 EP管中,离心半径 8 cm,12 000 r/min,4℃,离心10 min,取上清液用BCA法检测样品蛋白质水平。50 μg蛋白于SDS-聚丙烯酰胺凝胶中电泳,电转至PVDF膜。5%脱脂牛奶封闭4℃过夜,分别加PCNA、caspase-3(1∶1 000) 以及内参 β-actin,37℃ 2 h;洗膜3次,每次10 min;加HRP标记羊抗兔IgG(1∶20 000,美国Santa Cruz提供),37℃ 1 h,洗膜;将适量DAB显色液平铺在二抗杂交后的膜上,室温放置观察,可出现明显的棕褐色蛋白显色带。半定量方法分析肾组织PCNA、caspase-3的表达,将膜上条带扫描存入电脑,应用凝胶成像系统软件分析条带的光密度,结果用β-actin校正。
1.4 统计学方法 采用SPSS 13.0统计软件进行统计学处理,计量资料以 (±s)表示,两组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 两组术后肾功能的改变 术后3、7 d两组尿β2微球蛋白水平比较,差异均无统计学意义 (P>0.05);术后14 d两组尿β2微球蛋白水平比较,差异有统计学意义 (P<0.05)。术后3、7、14 d两组血肌酐水平比较,差异均无统计学意义(P>0.05,见表1)。
表1 两组术后肾功能的改变比较 (±s)Table 1 Comparison of renal function changes after operation between two groups
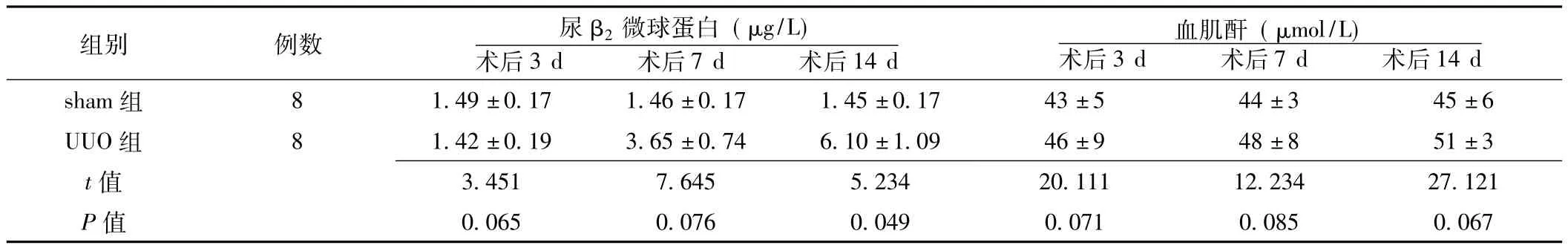
表1 两组术后肾功能的改变比较 (±s)Table 1 Comparison of renal function changes after operation between two groups
组别 例数 尿β2微球蛋白 (μg/L)术后3 d 术后7 d 术后14 d 14 d sham组 8 1.49±0.17 1.46±0.17 1.45±0.17 43±5 44±3 45±6血肌酐 (μmol/L)术后3 d 术后7 d 术后UUO组 8 1.42±0.19 3.65±0.74 6.10±1.09 46±9 48±8 51±3 t 3.451 7.645 5.234 20.111 12.234 27.121 P值值0.065 0.076 0.049 0.071 0.085 0.067
2.2 肾组织形态学检测 HE染色显示,sham组大鼠肾脏肾小管排列紧密、整齐;UUO组术后3 d,可见肾小管肿胀,部分肾小管轻度扩张,小管间质区域出现炎性浸润;术后7 d肾小管壁扩张,肾间质水肿;术后14 d肾小管结构已经完全被破坏,管腔塌陷 (见图1)。
2.3 SABC法检测PCNA、caspase-3的表达
2.3.1 PCNA在大鼠肾脏中的表达变化 PCNA阳性染色主要分布于细胞核,染成棕黄色或棕褐色。sham组PCNA阳性细胞核在肾小管上皮细胞及肾间质细胞表达极少。UUO组术后3、7、14 d PCNA在肾间质细胞核表达明显增加 (见图2)。两组术后3、7、14 d,肾小管内PCNA阳性细胞百分率比较,差异无统计学意义 (P>0.05);肾间质内PCNA阳性细胞百分率比较,差异均有统计学意义 (P<0.05,见表2)。
2.3.2 caspase-3在大鼠肾脏中的表达变化 caspase-3阳性染色主要分布于细胞质中,为棕黄色。sham组caspase-3在肾小管及肾间质有少量表达,在UUO组表达增加,以肾小管上皮细胞表达增加为主 (见图3)。两组术后3、7、14 d,肾小管内caspase-3阳性细胞百分率比较,差异均有统计学意义(P<0.05);肾间质内caspase-3阳性细胞百分率比较,差异均有统计学意义 (P<0.05,见表3)。
表2 两组术后PCNA阳性细胞百分率比较 (±s,%)Table 2 Comparison of percentage of positive cells of PCNA protein expression between two groups
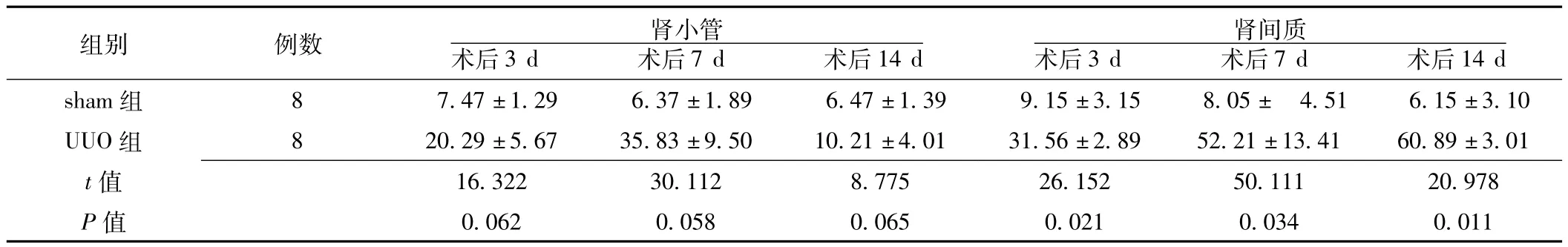
表2 两组术后PCNA阳性细胞百分率比较 (±s,%)Table 2 Comparison of percentage of positive cells of PCNA protein expression between two groups
组别 例数 肾小管术后3 d 术后7 d 术后14 d 14 d sham组 8 7.47±1.29 6.37±1.89 6.47±1.39 9.15肾间质术后3 d 术后7 d 术后±3.15 8.05± 4.51 6.15±3.10 UUO组 8 20.29±5.67 35.83±9.50 10.21±4.01 31.56±2.89 52.21±13.41 60.89±3.01 t 16.322 30.112 8.775 26.152 50.111 20.978 P值值0.062 0.058 0.065 0.021 0.034 0.011
2.4 Western blot法测定肾皮质PCNA、caspase-3的相对表达量 Western blot法结果显示,sham组肾皮质中有微量PCNA、caspase-3的表达;UUO组术后PCNA、caspase-3蛋白表达增加,梗阻时间延长表达增加 (见图4)。
表3 两组术后caspase-3阳性细胞百分率比较 (±s,%)Table 3 Comparison of percentage of positive cells of caspase-3 protein expression between two groups
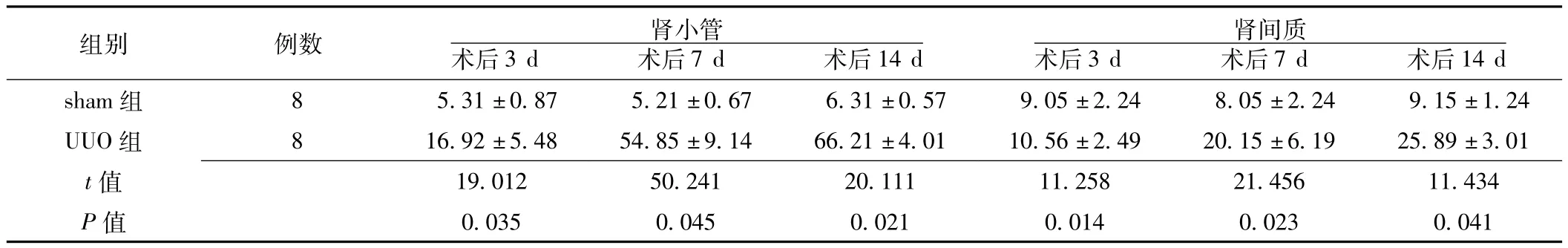
表3 两组术后caspase-3阳性细胞百分率比较 (±s,%)Table 3 Comparison of percentage of positive cells of caspase-3 protein expression between two groups
组别 例数 肾小管术后3 d 术后7 d 术后14 d 14 d sham组 8 5.31±0.87 5.21±0.67 6.31±0.57 9.05肾间质术后3 d 术后7 d 术后±2.24 8.05±2.24 9.15±1.24 UUO组 8 16.92±5.48 54.85±9.14 66.21±4.01 10.56±2.49 20.15±6.19 25.89±3.01 t 19.012 50.241 20.111 11.258 21.456 11.434 P值值0.035 0.045 0.021 0.014 0.023 0.041
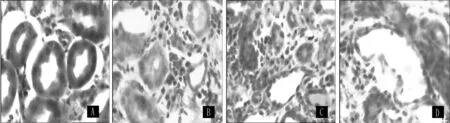
图1 肾组织形态学改变Figure 1 Histomorphology changes of the renal tissues
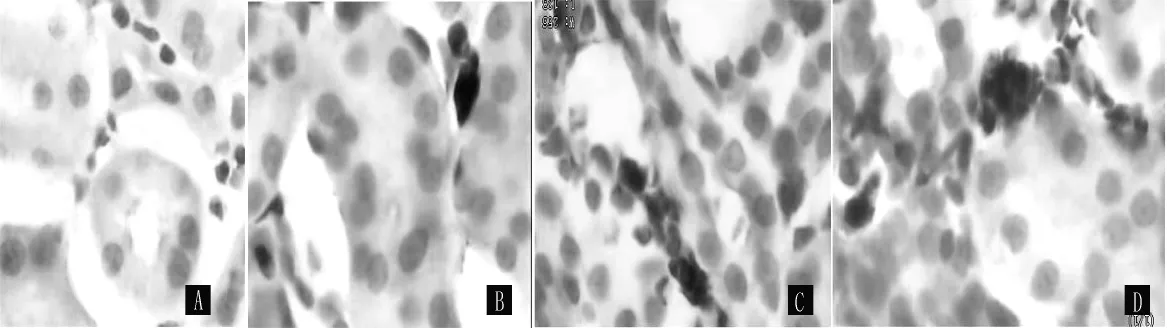
图2 SABC法检测PCNA的表达Figure 2 Expression of PCNA proteins by SABC method
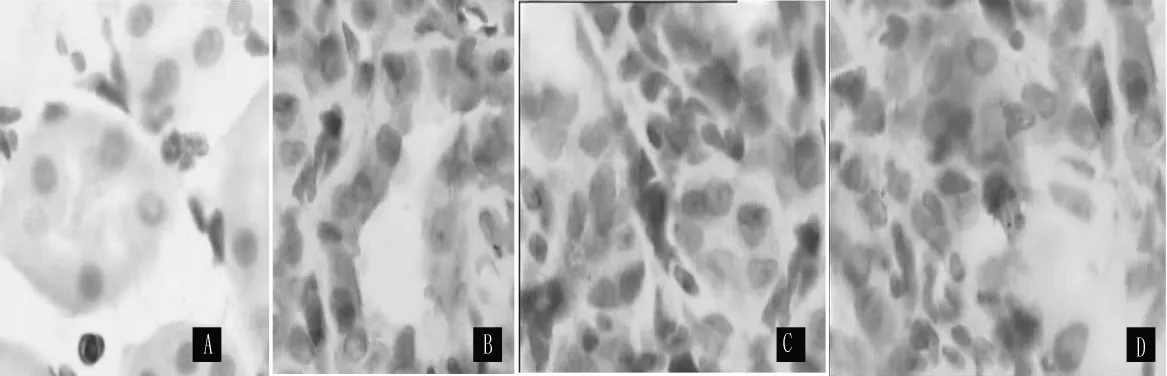
图3 SABC法检测caspase-3的表达Figure 3 Expression of caspase-3 proteins by SABC method
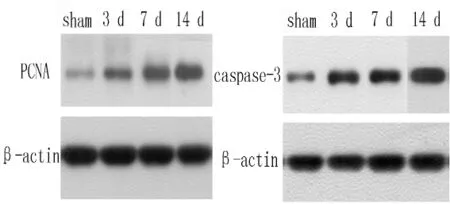
图4 PCNA、caspase-3的相对表达量Figure 4 Relative expression quantities of PCNA and caspase-3 proteins
3 讨论
在引发婴幼儿肾衰竭的病因中,尿路梗阻所引致的梗阻性肾病是极其常见的[3]。而肾纤维化则是所有梗阻性肾病病程最终的共同途径。UUO是诱导肾纤维化最经典的模型,该模型易于制作,具备良好的重复性和较高的成功率。在本研究中,通过HE染色观察到尿路梗阻后肾小管扩张、萎缩、管腔塌陷,肾间质增宽等肾纤维化表现,表明UUO模型造模成功。
本实验采用全自动生化分析仪检测不同时间点大鼠尿中β2微球蛋白水平,术后14 d UUO组较sham组明显升高,表明术后14 d UUO组大鼠肾小管已经受到明显破坏,存在大量的淋巴细胞浸润。由于β2微球蛋白的合成与分泌主要是通过淋巴细胞来实现,因此,尿中β2微球蛋白的排出增加。
本实验血肌酐水平测定结果表明,两组血肌酐水平无明显差异,其原因可能是:本研究中损伤的大部分是肾小管,而肾小球功能的良好与否是通过血肌酐来反映的;另一方面在常用肾功能检查的指标中可应用血肌酐指标,但在肾功能损伤早期并不灵敏。
PCNA是DNA多聚酶的辅助蛋白,是DNA复制的必需物质,其水平反映了细胞增殖程度[4],是细胞增殖的标志物。本实验结果表明,sham组PCNA阳性细胞核在肾小管上皮细胞及肾间质细胞表达极少。UUO组术后14 d PCNA在肾小管上皮细胞及肾间质细胞核表达明显增加。两组术后14 d肾小管内PCNA阳性细胞百分率无明显差异,肾间质内PCNA阳性细胞百分率差异明显。PCNA的合成和表达的量与细胞增殖指数及细胞所处周期有关,已用于恶性肿瘤的诊断和判断预后[5]。因此,PCNA可作为评价细胞增殖的指标[6]。
近年来关于梗阻性肾病的发病机制已经在分子水平上研究,研究结果显示细胞凋亡参与输尿管梗阻后的肾病理生理过程,caspase-3家族是细胞凋亡下游的关键酶,大多数触发细胞凋亡的因素通过caspase-3介导的信号传导途径引发细胞凋亡[7]。本实验SABC法结果显示,caspase-3在sham组肾小管及肾间质有少量表达,在UUO组表达增加,以肾小管上皮细胞表达增加为主。两组术后14 d肾小管内caspase-3阳性细胞百分率差异明显。两组术后14 d肾间质内caspase-3阳性细胞百分率有明显差异。Western blot法结果显示,sham肾皮质中有微量caspase-3的表达;UUO组术后caspase-3表达增加,梗阻时间延长表达增加。提示caspase-3活性增强参与梗阻肾的病理生理过程。梗阻肾组织caspase-3表达随梗阻时间延长而增强,肾小管中表现更为明显,说明梗阻肾caspase-3表达增强是肾损伤、肾小管萎缩乃至肾衰竭的重要原因之一。这为在梗阻尚未解除时如何减轻或延缓肾功能损害以及梗阻解除后如何促进肾功能恢复提供新的防治方向。
细胞增殖与细胞凋亡之间的平衡是维持肾脏正常结构形成的关键,如何调控细胞凋亡,拮抗细胞增殖,阻止肾纤维化的进一步发展有待进一步研究。
1 Liu Y.Renal fibrosis:new insights into the pathogenesis and therapeutics[J].Kidney Int,2007,69(2):213 -217.
2 Li L,Zepeda-Orozco D,Black R.Autophagy is a component of epithelial cell fate in obstructive uropathy [J].Am J Pathol,2010,176(4):1767-1778.
3 Chen F.Genetic and developmental basis for urinary tract obstruction[J].Pediatr Nephrol,2009,24(9):1621 -1632.
4 Mazzei LJ,García IM,Altamirano L.Rosuvastatin preserves renal structure following unilateral ureteric obstruction in the neonatal rat[J].Am J Nephrol,2012,35(2):103 -113.
5 Mizuguchi Y,Miyajima A,Kosaka T,et al.Atorvastatin ameliorates renal tissue damage in unilateral ureteral obstruction [J].J Urol,2007,172(6 Pt 1):2456-2459.
6 Yang B,Nahas ME,Thomas GL,et al.Caspase-3 and apoptosis in experimental chronic renal scarring[J].Kidney Int,2009,60(6):1765-1776.
7 Rohatgi R,Flores D.Intratubular hydrodynamic forces influence tubulointerstitial fibrosis in the kidney [J].Curr Opin Nephrol Hypertens,2010,19(1):65-71.

