L-鸟氨酸-L-门冬氨酸治疗肝硬化肝性脑病的Meta分析
王旷靖,宋汉明
肝性脑病 (hepatic encephalopathy,HE)是由各种急慢性肝功能衰竭或门体分流引起的,以代谢紊乱为基础的一系列中枢神经精神异常和功能失调综合征,以神经精神症状为主要临床表现[1]。HE是肝硬化最常见的并发症和死亡原因之一,肝硬化并发HE患者预后极差、死亡率高[2]。肝硬化HE发病机制复杂,目前尚未完全阐明,相关假说有氨中毒学说、锰中毒学说、氨基酸失衡学说、假性神经递质学说、γ-氨基丁酸/苯二氮卓复合受体学说等。随着研究的深入,各假说间倾于融合,其中高血氨症是各假说的共同通路,多因素对中枢神经系统的协同毒性可能在HE的发病机制中起重要作用[3]。L-鸟氨酸-L-门冬氨酸 (L-ornithine-L-aspartate,LOLA)是一种促进血氨代谢的药物,目前已广泛应用于各类急慢性肝病引发的血氨升高及HE的治疗。本研究采用Meta分析方法,全面收集有关LOLA治疗肝硬化HE的临床试验研究,评价其疗效和安全性,以期为临床实践提供可靠的循证医学依据。
1 资料与方法
1.1 纳入和排除标准
1.1.1 纳入标准 (1)公开发表的LOLA治疗肝硬化HE的临床随机对照试验;(2)纳入的患者均为肝硬化且符合HE诊断标准者;(3)干预措施:LOLA组使用LOLA,对照组使用安慰剂或空白对照;(4)Jadad评分≥3分的高质量研究。
1.1.2 排除标准 (1)文献综述; (2)重复发表的文献;(3)非临床随机对照试验;(4)LOLA与其他药物疗效比较的临床随机对照试验;(5)Jadad评分≤2分的低质量研究。
1.2 检索策略 采用计算机检索 MEDLINE、PubMed、EMBase、The Cochrane Central Register of Controlled Trials、中国生物医学文献数据库、中国科技期刊数据库 (维普)、中国期刊全文数据库和万方数字化期刊全文数据库;中文检索词为:L-鸟氨酸-L-门冬氨酸、肝硬化、肝性脑病、随机对照试验;英文检索词为:L-ornithine-L-aspartate,hepatic cirrhosis,hepatic encephalopathy,randomized controlled trial。检索关于LOLA治疗肝硬化HE的临床随机对照试验,截止时间为2012-03-31。
1.3 资料提取和质量评价
1.3.1 资料提取 建立文献登记表和信息采集表,内容包括研究设计者、年份、受试者例数、临床用药、疗程、评价指标、不良反应等。由两名评价员独立检索文献全文并提取资料,按统一规范的评价方法独立评价,意见不一致时双方通过讨论协商解决。
1.3.2 质量评价 采用Jadad评分量表对纳入的研究质量进行评价[4]: (1)作者叙述为随机法; (2)随机方法正确或(和)采用分配隐藏;(3)双盲; (4)描述盲法,指出对照和研究干预的不可辨别性;(5)全程随访并描述失访例数及退出理由。每项1分,共计5分,总分0~2分为低质量研究,总分3~5分为高质量研究。
1.4 统计学方法 采用Cochrane协作网提供的Review Manager 3.4软件进行Meta分析。采用I2检验对纳入研究的临床异质性和方法学异质性进行检验,以P≥0.05表示研究间无统计学异质性,采用固定效应模型;以P<0.05表示研究间有统计学异质性,采用随机效应模型。处理效应量为数值变量资料时,采用加权均数差值 (WMD)进行比较;处理效应量为二分类变量时,采用相对危险度 (RR)进行比较。两者均采用95%CI表示,以P<0.05为差异有统计学意义。
2 结果
2.1 纳入研究的一般特征和质量评价 通过计算机检索共检出相关文献566篇,阅读标题、摘要后,排除不合格文献495篇,进一步阅读全文,剔除不符合标准的文献,最终纳入6篇文献[5-10],共包括512例肝硬化HE患者。纳入研究的主要结局指标有:(1)疾病临床缓解率;(2)血氨值;(3)缩短数字连接试验A(NCT-A)反应时间;(4)药物不良反应发生情况 (见表1)。纳入研究的Jadad评分为3~5分,均为高质量临床随机对照研究 (见表2),得出的结论可信度好,临床参考价值较高。
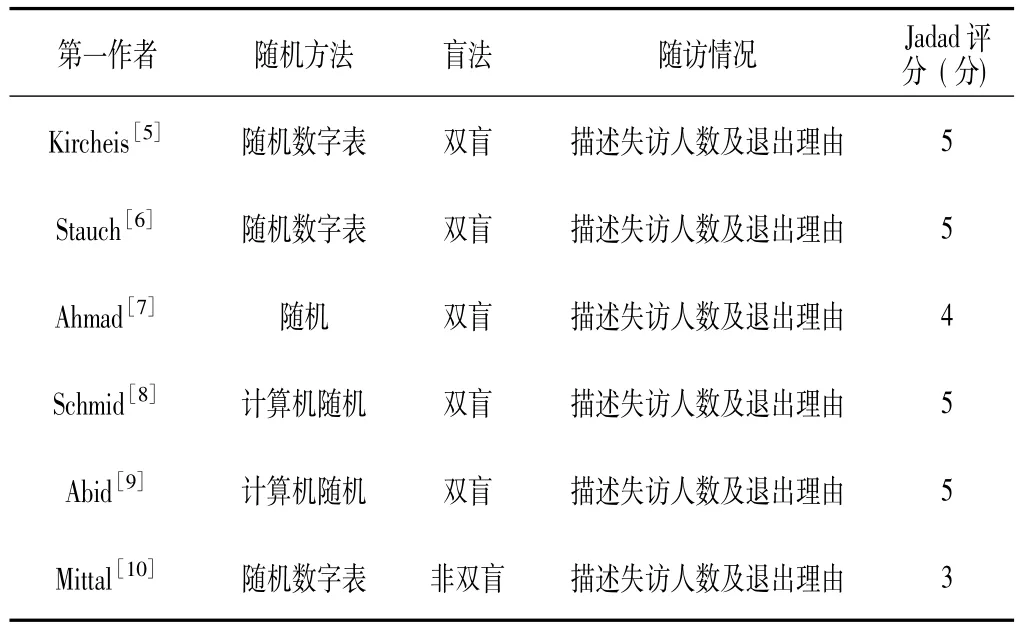
表2 纳入研究的方法学质量评价Table 2 Jadad quality score of the included RCTs for Meta-analysis
2.2 Meta分析结果
2.2.1 两组肝硬化HE临床缓解率比较 肝硬化HE临床缓解是指HE患者经治疗后临床症状West-Haven分级至少降低1个等级。共5项研究进行了HE临床缓解率的比较,各研究间有统计学异质性 (I2=75.6%,P=0.003),采用随机效应模型进行分析,Meta分析结果显示,LOLA肝硬化HE临床缓解率高于 对照组 〔RR=1.49,95%CI(1.10,2.01),P=0.010,见图1〕。
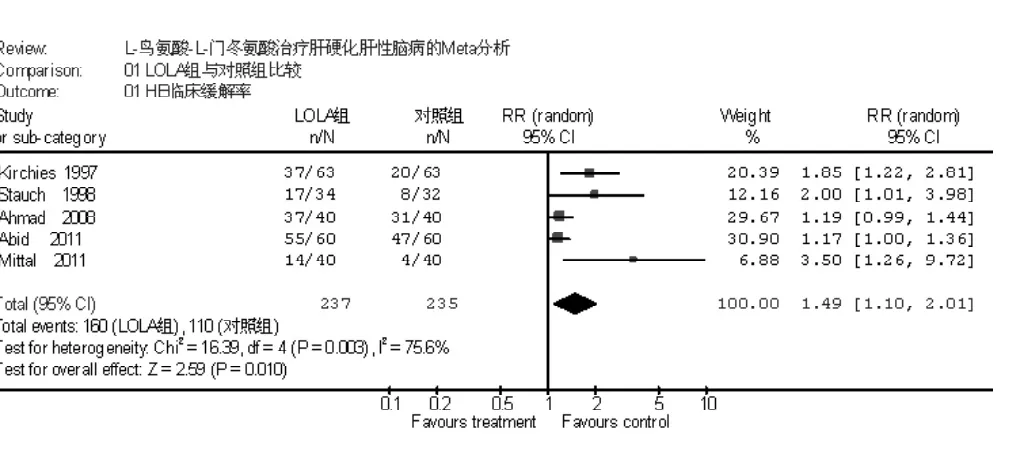
图1 LOLA组与对照组肝硬化HE临床缓解率比较Figure 1 Comparison of clinical improvement of HE between LOLA group and control group
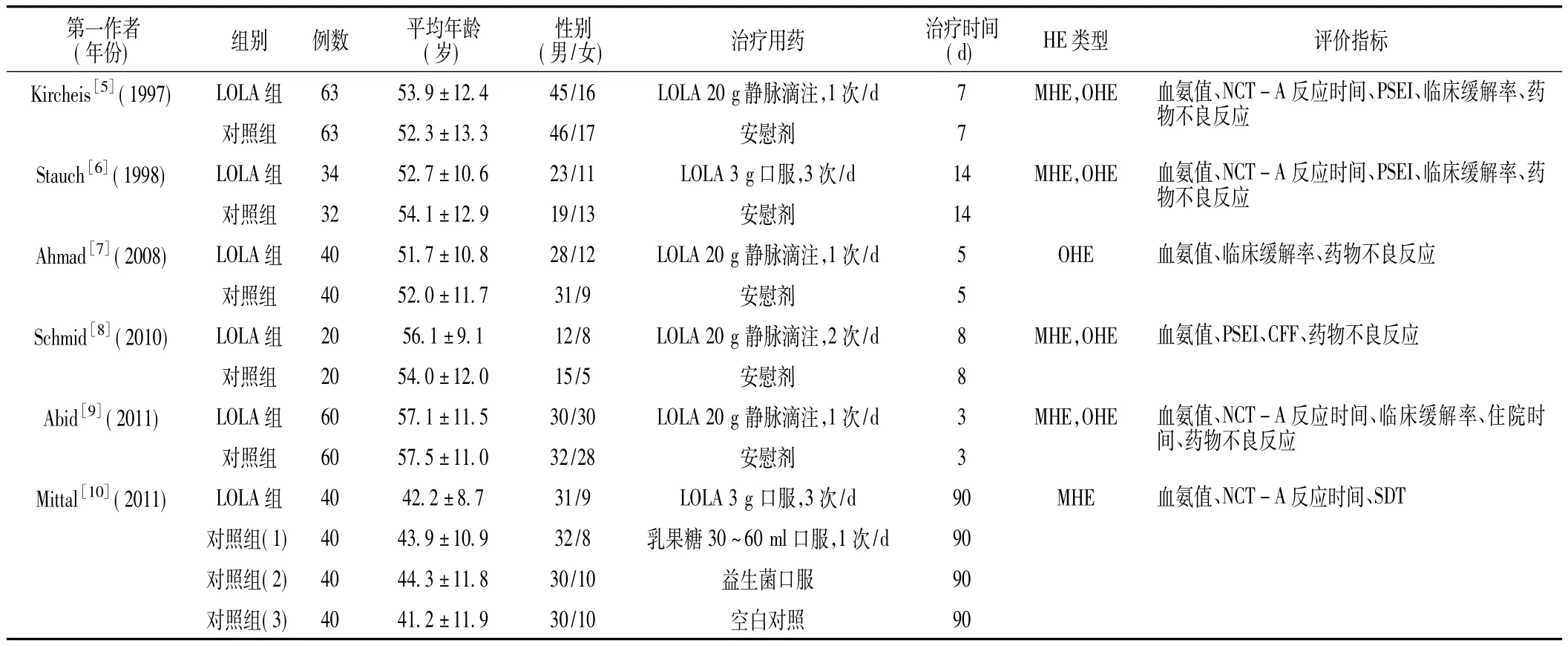
表1 纳入研究的一般特征Table 1 General characteristics of the included RCTs for Meta-analysis
2.2.2 亚组分析
2.2.2.1 两组轻微肝性脑病 (MHE)临床缓解率比较 MHE临床缓解是指MHE患者经治疗后其智力试验和 (或)电生理检测恢复正常。共4项研究进行了MHE临床缓解率的比较,各研究间无统计学异质性 (I2=0,P=0.64),采用固定效应模型进行分析,Meta分析结果显示,LOLA组MHE临床缓解率高于对 照组 〔RR=2.25,95%CI(1.33,3.82),P=0.003,见图2〕。

图2 LOLA组与对照组MHE临床缓解率比较Figure 2 Comparison of clinical improvement of MHE between LOLA group and control group
2.2.2.2 两组显性肝性脑病 (OHE) 临床缓解率比较 OHE临床缓解是指OHE患者经治疗后临床症状West-Haven分级至少降低1个等级。共4项研究进行了OHE临床缓解率的比较,各研究间有统计学异质性 (I2=67.7%,P=0.03),采用随机效应模型进行分析,Meta分析结果显示,LOLA组OHE临床缓解率高于对照组 〔RR=1.31,95%CI(1.15,1.50),P <0.0001,见图3〕。
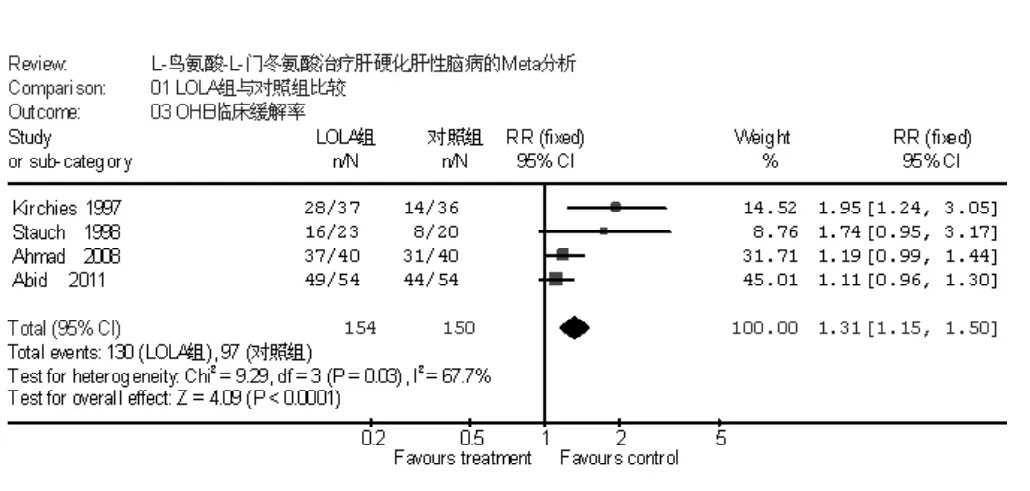
图3 LOLA组与对照组OHE临床缓解率比较Figure 3 Comparison of clinical improvement of OHE between LOLA group and control group
2.2.3 两组血氨值比较 共4项研究进行了血氨值的比较,各研究间无统计学异质性 (I2=32.0%,P=0.22),采用固定效应模型进行分析,Meta分析结果显示,LOLA组血氨值下降程度大于对照组〔WMD=-10.22,95%CI(-13.70,-6.75),P <0.00001,见图4〕。
2.2.4 两组 NCT-A反应时间比较 共2项研究进行了NCT-A反应时间的比较,各研究间无统计学异质性 (I2=3.6%,P=0.31),采用固定效应模型进行分析,Meta分析结果显示,LOLA组NCT-A反应时间短于对照组〔WMD=-10.34,95%CI(-14.87, -5.80),P < 0.00001,见图5〕。
2.2.5 两组药物不良反应发生率比较 共5项研究提及LOLA药物不良反应,主要表现为恶心、呕吐、腹胀、腹泻等。其中2项研究两组均未发生药物不良反应,其他3项研究间无统计学异质性 (I2=60.5%,P=0.08),采用固定效应模型进行分析,Meta分析结果显示,LOLA组药物不良反应发生率(13.0%) 低于对照组 (10.6%) 〔RR=1.22,95%CI(0.69,2.17),P=0.49,见图6〕。
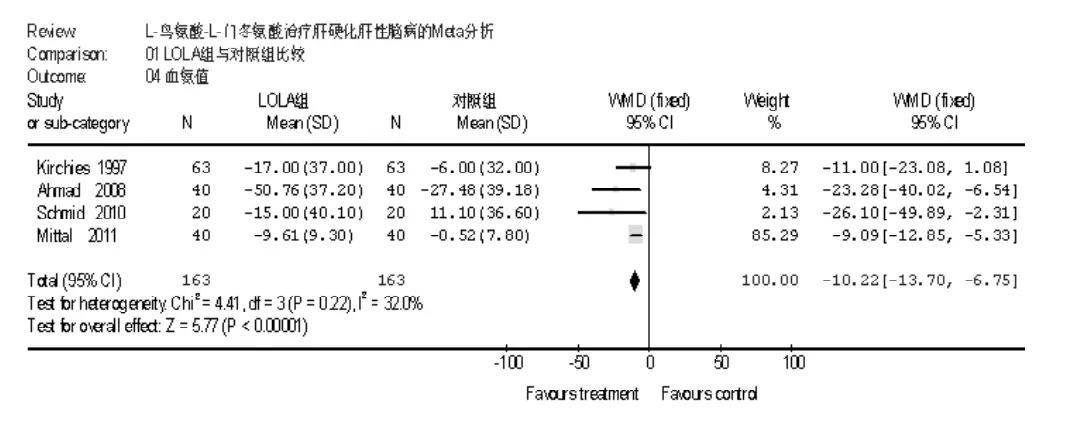
图4 LOLA组与对照组血氨值比较Figure 4 Comparison of serum ammonia between LOLA group and control group
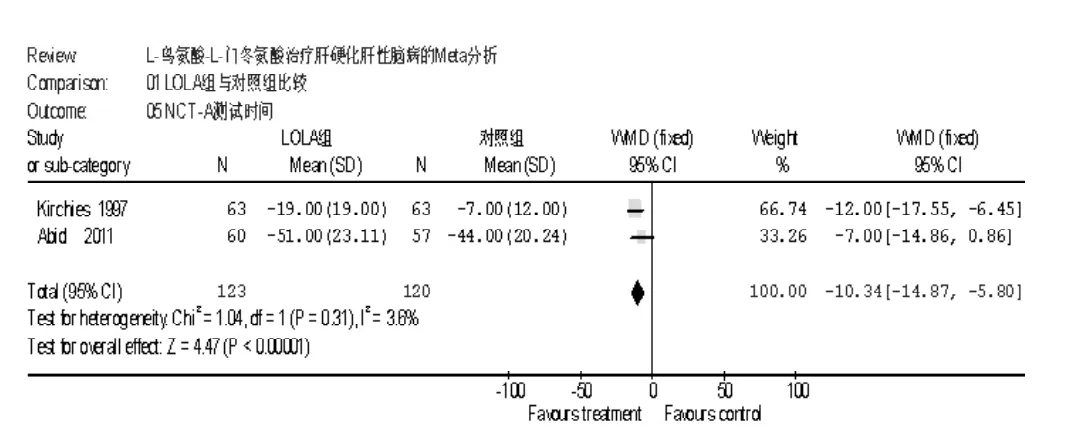
图5 LOLA组与对照组NCT-A反应时间比较Figure 5 Comparison of NCT-A between LOLA group and control group
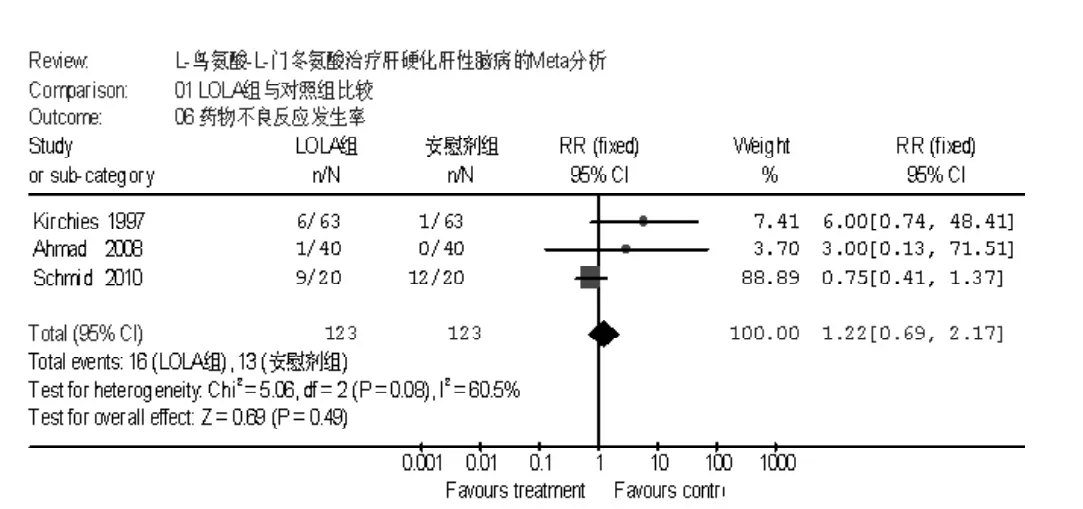
图6 LOLA组与对照组药物不良反应发生率比较Figure 6 Comparison of nonspecific adverse events between LOLA group and control group
3 讨论
1998年世界消化病大会 (WCOG)制定了《HE的定义、命名、诊断及定量》,根据HE病因不同分为急性肝功能衰竭、严重的门体分流、慢性肝病/肝硬化相关的HE,分别对应:A型、B型、C型3种不同类型HE[11]。我国慢性病毒性肝病发病率高,肝硬化患者数量与日俱增,因此肝硬化HE较为常见[1]。肝硬化HE突出的临床特点为慢性、反复发作性,多数患者有明显诱因,同时伴随原发疾病的恶化,患者常经历行为失常、昏迷直至死亡的渐进过程。HE是一组连续病征,根据临床症状的有无分为MHE和OHE。MHE既往被称为亚临床型HE,指无明显临床表现,只能通过特异性神经精神测试或电生理检测才可作出诊断;OHE指有临床症状的HE[12]。HE根据临床症状的轻重程度分为0~4期,各期可重叠或相互转化[1];按照国外的West-Haven分级可分为Ⅰ、Ⅱ、Ⅲ、Ⅳ级[11]。大多数学者认为MHE可以归为HE 0期,肝硬化MHE发展为OHE的风险较大,且早期MHE的治疗效果优于进入昏迷期的OHE[13]。HE临床表现多样,可隐匿起病、预后差、病死率高,严重影响患者生活质量,社会负担及危害极大。
由于HE发病机制仍不明确,目前HE的治疗尚未获得根本性突破,及早识别并纠正其诱因是防治HE最基本的治疗策略[14]。目前临床治疗HE的理论基础大多建立在“氨中毒学说”上:促进氨代谢、改善氨基酸平衡、拮抗假性神经递质、减少肠道内氨及其他有害物质的生成和吸收;主要药物有LOLA、乳果糖、谷氨酸盐、精氨酸、支链氨基酸、氟马西尼、利福昔明、益生菌制剂等[1,15]。由于HE发病机制及临床表现的复杂性、异质性及特殊性,使得各类药物的临床疗效不确切,且相对应的高质量临床随机对照试验研究也面临一定的困难。
LOLA在体内裂解为L-鸟氨酸和L-门冬氨酸。鸟氨酸作为必需底物直接参加尿素循环,同时鸟氨酸是尿素合成过程的关键酶,可增加氨基甲酰转移酶和氨基甲酰磷酸合成酶的活性,使鸟氨酸与氨结合,加速尿素合成,促进体内血氨代谢。门冬氨酸作为底物生成谷氨酸和草酰乙酸,谷氨酸进一步转化成谷氨酰胺和谷胱甘肽,后者具有抗氧化和解毒功能;草酰乙酸参与体内三羧酸循环,增加肝细胞能量的生成,加速其自我修复和再生过程,达到保护肝细胞目的。
本研究全面检索LOLA治疗肝硬化HE的临床随机对照试验,共纳入6个高质量临床随机对照试验进行Meta分析,结果显示:与对照组相比,LOLA可以明显降低肝硬化HE患者的血氨水平,缩短NCT-A反应时间,进而提高HE临床缓解率,且药物不良反应发生率低。亚组分析发现,LOLA不仅能提高OHE临床缓解率,且对MHE也有显著的疗效。可作为临床早期防治MHE的一种新选择,具有一定实际指导意义。但这一点与Jiang等[16]报道结果不一致,其Meta分析结果示:LOLA不能有效改善MHE临床缓解率。分析原因可能为本研究共纳入6个高质量的临床随机对照试验且样本量明显增加(Jiang等只纳入2个RCT),获得的循证医学证据更为客观、科学。
Meta分析是对多个同类研究结果进行量化、合并、分析的统计学研究过程,以扩大样本量,增加统计功效,对有争议、相互矛盾的研究结果得出一个更为客观、全面、可靠的循证医学结论[17]。本研究所纳入的临床随机对照研究质量较高,结果可信度较强,但仍有一些局限性,如纳入研究量及样本量较少、文献原始数据资料收集不完整、各研究药物治疗方案不尽相同、药物疗效评价指标、临床缓解定义及标准不统一、存在发表性偏倚等,且仅限于中文和英文文献,其他语言未能纳入,不能较为全面地反映地区和 (或)种族差异。期待更多的多中心、大样本、随机双盲安慰剂对照的临床研究进一步探讨LOLA治疗肝硬化HE的疗效与安全性。
1 邢卉春.肝性脑病诊断治疗专家共识[J].中国肝脏病杂志 (电子版),2009,1(2):46-55.
2 Patel D,McPhail MJ,Cobbold JF.Hepatic encephalopathy [J].Br J Hosp Med(Lond),2012,73(2):79-85.
3 段志军,张呜.肝性脑病发病机制研究新进展[J].中华内科杂志,2011,5(50):441-443.
4 Jadad AR,Moore RA,Carroll D,et al.Assessing the quality of reports of randomized clinical trials:is blinding necessary? [J].Control Clin Trials,1996,17(1):1-12.
5 Kircheis G,Nilius R,Held C,et al.Therapeutic efficacy of L-ornithine-L-aspartate infusions in patients with cirrhosis and hepatic encephalopathy:results of a placebo-controlled,double-blind study[J].Hepatology,1997,25(6):1351-1360.
6 Stauch S,Kircheis G,Adler G,et al.Oral L-ornithine-L-aspartate therapy of chronic hepatic encephalopathy:results of a placebocontrolled double-blind study [J].J Hepatol,1998,28(5):856-864.
7 Ahmad I,Khan AA,Alam A,et al.L-ornithine-L-aspartate infusion efficacy in hepatic encephalopathy[J].J Coll Physicians Surg Pak,2008,18(11):684-687.
8 Schmid M,Peck-Radosavljevic M,Konig F,et al.A doubleblind,randomized,placebo-controlled trial of intravenous L-ornithine-L-aspartate on postural control in patients with cirrhosis [J].Liver Int,2010,30(4):574-582.
9 Abid S,Jafri W,Mumtaz K,et al.Efficacy of L-ornithine-L-aspartate as an adjuvant therapy in cirrhotic patients with hepatic encephalopathy[J].J Coll Physicians Surg Pak,2011,21(11):666-671.
10 Mittal VV,Sharma BC,Sharma P,et al.A randomized controlled trial comparing lactulose,probiotics,and L-ornithine-L-aspartate in treatment of minimal hepatic encephalopathy[J].Eur J Gastroenterol Hepatol,2011,23(8):725-732.
11 Ferenci P,Lockwood A,Mullen K,et al.Hepatic encephalopathydefinition,nomenclature,diagnosis,and quantification:final report of the working party at the 11th World Congresses of Gastroenterology,Vienna,1998 [J].Hepatology,2002,35(3):716-721.
12 姜浩,谢青.肝性脑病临床诊治的进展[J].临床肝胆病杂志,2011,27(10):1027-1031.
13 Bajaj JS,Wade JB,Sanyal AJ.Spectrum of neurocognitive impairment in cirrhosis:implications for the assessment of hepatic encephalopathy[J].Hepatology,2009,50(6):2014-2021.
14 Wright G,Chattree A,Jalan R.Management of hepatic encephalopathy[J].Int J Hepatol[Epub 2011 Sep 21].
15 Phongsamran PV,Kim JW,Cupo Abbott J,et al.Pharmacotherapy for hepatic encephalopathy [J].Drugs,2010,70(9):1131-1148.
16 Jiang Q,Jiang XH,Zheng MH,et al.L-Ornithine-L-aspartate in the management of hepatic encephalopathy:a meta-analysis [J].J Gastroenterol Hepatol,2009,24(1):9-14.
17 刘家红,郑显兰,郭蓉,等.健康教育路径对住院糖尿病患者疗效影响的Meta分析[J].中国全科医学,2011,14(2):431.

