持续表达的丙型肝炎病毒NS4B激活HepG2细胞内质网应激反应的研究*
熊江红,张庆华,张艳妮,朱向东,孔令保
(江西农业大学生物科学与工程学院,南昌 330045)
病原体感染、内质网Ca2+的消耗和膜蛋白过量表达等能引起从内质网到细胞质和细胞核的信号传导途径即内质网应激反应(ER stress response)。内质网应激可以激活3条信号通路:(1)非折叠蛋白质反应 (unfolded protein response,UPR);(2)内质网超负荷反应(ER-overload response,EOR);(3)固醇调节级联反应(sterol response pathway)[1-2]。
丙型肝炎病毒(HCV)感染容易引起慢性肝炎、肝硬化和肝细胞癌,其致病机制目前并不很清楚。HCV非结构蛋白NS4B是一个内质网膜结合蛋白。作者前期的研究发现非结构蛋白4B(NS4B)在宫颈癌细胞HeLa的持续表达和肝癌细胞Huh7的过表达均能诱导内质网应激反应的 UPR途径[3-4]。在人体内HCV感染的主要宿主细胞是肝细胞。而且,HCV感染者大部分会发展成为持续性感染,持续性感染又可进一步发展为肝癌[6]。为调查NS4B在肝细胞的持续表达是否也会诱导内质网应激反应以促进HCV感染和其致病性,本研究通过稳定转染构建了持续表达NS4B的人肝癌细胞HepG2,NS4B在HepG2细胞的持续表达诱导了人X盒结合蛋白1(XBP1)mRNA剪接、XBP1和 Grp78启动子激活、Ca2+稳态变化及核因子κB(NF-κB)激活,表明NS4B可能通过诱导肝细胞内质网应激反应在HCV感染和其致病性中发挥作用。
1 材料与方法
1.1 材料 各种工具酶、生化试剂和细胞培养试剂主要购自Promega、Invitrogen、晶美和大连宝生物等公司。NF-κB报告质粒 pNF-κB-Luc购自Stratagene公司。人肝癌细胞系HepG2、大肠杆菌BL21(DE3)、DH5α和 NS4B表达载体pcDNA3.1(-)NS4B、XBP1启动子报告质粒pGL3XBP1pro和GRP78启动子报告质粒pGL3GRP78pro等均由本实验室保存或以前构建[3-4,6]。
1.2 方法
1.2.1 HepG2细胞的稳定转染和G-418筛选 NS4B表达载体pcDNA3.1(-)NS4B和空载体pcDNA3.1(-)稳定转染HepG2细胞。稳定转染和G-418筛选参照文献[6]进行。
1.2.2 基因组PCR 收获稳定转染细胞,参照文献[7]提取细胞基因组。以提取的基因组DNA为模板,利用Ex-TaqDNA聚合酶进行PCR。使用的引物为NS4B引物对(正向:5′-GGA TCC TCT AGA ACC ATG GCT CAG CAC TTA CCG TAC-3′;反向:5′-GAA TTC AAG CTT TTA GCA TGG AGT GGT ACA C-3′)或内参 GAPDH 引物对(正向:5′-ATC ACT GCC ACC CAG AAG AC-3′,反向:5′-ATG AGG TCC ACC ACC CTG TT-3′)。0.7%Agarose电泳鉴定PCR产物。
1.2.3 Western blot检测NS4B蛋白表达 收获稳定转染细胞,加入裂解液(0.3%NP40,1mmol/L EDTA,50mmol/L Tris-Cl,1%TritonX-100,50mmol/L NaCl,25mmol/L NaF,1 mmol/L Na3VO3,10μg/mL PMSF),冰浴30min,12000g 4℃离心15min,15%聚丙酰胺凝胶电泳,转膜,然后使用HCV人阳性血清(1∶100)作为为一抗,辣根过氧化物酶标记的羊抗兔IgG(1∶5000稀释)为二抗进行 Western blot分析。蛋白带的检测用化学发光光学发光检测试剂盒。
1.2.4 RT-PCR检测XBP1mRNA的剪切 RT-PCR参照文献[3]进行,2.0%琼脂糖电泳鉴定RT-PCR产物。
1.2.5 荧光素酶试验检测GRP78和XBP1启动子活性 使用LipofectaminTM2000将质粒pRL-CMV(内参)和pGL3 XBP1pro,或者pRL-CMV和pGL3GRP78pro瞬时转染到HepG2稳定转染细胞中。2.5μg/mL Tunicamycin(Tu)处理6h的HepG2细胞作阳性对照。转染24h后,按照双荧光素酶报告基因系统(Promega)的操作说明书检测荧光素酶活性。
1.2.6 荧光素酶试验检测NF-κB激活 使用LipofectaminTM2000将NF-κB报告质粒pNF-κB-Luc和内参报告质粒pRLCMV(共转染 HepG2稳定转染细胞中,然后 Ca2+拮抗剂TMB-8(100μmol/L)处理4h或不处理(阴性对照)。转染48 h后,按照双荧光素酶报告基因系统(Promega)的操作说明书检测荧光素酶活性。
2 结 果
2.1 NS4B基因的整合与表达 pcDNA3.1(-)NS4B和空载体pcDNA3.1(-)稳定转染的G418抗性HepG2细胞分别命名为HepG2-4B和HepG2-C细胞。基因组PCR结果显示,HepG2-4B细胞出现780bp的特异性NS4B目的带,而阴性对照HepG2-C细胞未见特异性的NS4B目的带出现,同时所有细胞均检测到446bp的GAPDH内参带(图1a),说明在HepG2-4B细胞中NS4B基因已整合到细胞基因组。Western blot结果显示,HepG2-4B中可以检测出27×103的NS4B目标带,而在阴性对照HepG2-C细胞中没有相应的带,见图1b。

图1 稳定转染HepG2细胞的鉴定
2.2 RT-PCR检测XBP1mRNA的剪切 HepG2-4B细胞和Tu处理的HepG2细胞,能够检测到剪切后的PCR产物XBP1(s)和未剪切的PCR 产物 XBP1(u)s mRNA,而在阴性对照HepG2-C细胞,只检测到XBP1-u(图2)。同时所有细胞均检测到GAPDH内参带,说明NS4B在HepG2细胞的持续表达能够促进XBP1mRNA的剪切。
2.3 荧光素酶实验检测GRP78和XBP1启动子活性 在Tu处理过的HepG2细胞中,GRP78和XBP1启动子活性增高9~12倍。在持续表达NS4B的HepG2-4B细胞中,报告基因的荧光素酶活性要比对照HepG2-C细胞升高6~8倍,见表1。
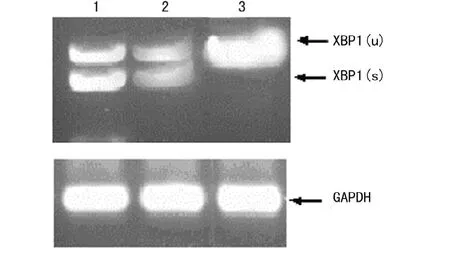
图2 RT-RCR检测XBP1mRNA的剪切
表1 GRP78和XBP1启动子活性的报告基因检测(n=3,)
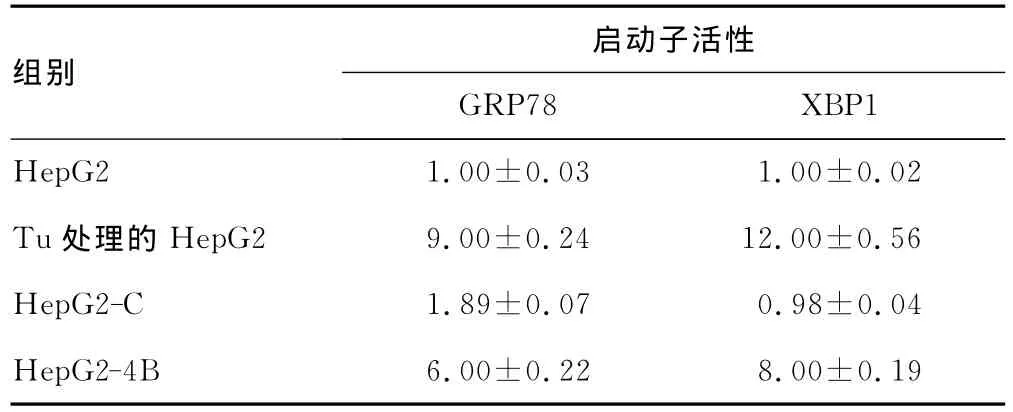
表1 GRP78和XBP1启动子活性的报告基因检测(n=3,)
组别启动子活性GRP78 XBP1 HepG2 1.00±0.03 1.00±0.02 Tu处理的HepG2 9.00±0.24 12.00±0.56 HepG2-C 1.89±0.07 0.98±0.04 HepG2-4B 6.00±0.22 8.00±0.19
2.4 荧光素酶试验检测NF-κB激活 在持续表达NS4B的HepG2-4B细胞中,报告基因的荧光素酶活性比对照HepG2-C细胞升高4.8倍,而Ca2+拮抗剂 TMB-8(100μmol/L)的处理几乎完全抑制了HepG2-4B细胞中的荧光素酶活性升高,见表2。
表2 荧光素酶试验检测NF-κB激活(n=3,)

表2 荧光素酶试验检测NF-κB激活(n=3,)
组别 NF-κB 活性HepG2-C 1.0±0.04 HepG2-4B 4.8±0.15 TMB-8处理的HepG2-4B 1.3±0.11
3 讨 论
位于内质网的3种跨膜蛋白IRE1、PERK和ATF6已被确认为UPR反应的信号转导蛋白质。当内质网内的非折叠或错误折叠蛋白积累时,GRP78/BIP便与IRE1、PERK、ATF6解离引起这些信号转导蛋白质的激活。激活的IRE1催化XBP1mRNA的剪接,剪接的XBP1mRNA经翻译产生有活性的转录因子,调节其下游基因如GRP78等的表达,促进蛋白质的折叠和降解[1-2]。HCV蛋白质的合成和加工,基因组的复制均在内质网进行[8]。HCV复制子在体外培养的肝细胞内诱导UPR,引起ATF6和GRP78激活,促进病毒的复制[9]。HCV感染体外培养的肝细胞激活非折叠蛋白质反应,引起GRP78、磷酸化eIF2α、CHOP表达增加和细胞凋亡[10]。HCV感染的SCID/Alb-uPA鼠肝内,GRP78和Bax表达增加,肝细胞出现凋亡症状[11]。GRP78激活与肝细胞癌发生密切相关[12]。在持续性感染HCV患者肝内,ATF-6、IRE1和PERK激活,活性氧和 NF-κB水平升高[13-14],显示在患者体内非折叠蛋白质反应和内质网超负荷反应被诱导。与NS4B在宫颈癌细胞HeLa的持续表达和肝细胞 Huh7的过表达类似[3-4]。本研究发现NS4B在肝细胞HepG2的持续表达也能诱导XBP1mRNA剪接、GRP78和XBP1启动子激活。这些结果揭示NS4B在HCV诱导的UPR、HCV复制及致癌作用中可能发挥重要作用。
蛋白质如一些病毒蛋白在内质网的过度积累会导致Ca2+从内质网释放,释放出来的Ca2+进一步引起 NF-κB激活[1]。表2显示NS4B在肝细胞HepG2的持续表达引起NF-κB激活,并且这种激活依赖Ca2+信号,说明NS4B肝细胞HepG2的持续表达也能激活内质网应激反应的EOR信号通路。NF-κB可启动众多基因转录,直接参与多种人类疾病如炎症和癌症的形成发展[15]。本研究发现NS4B激活肝细胞NF-κB揭示NS4B可能在HCV感染引起的炎症与癌症中发挥一定作用。
[1]Pahl HL.Signal transduction from the endoplasmic reticulum to the cell nucleus[J].Physiol Rev,1999,79(3):683-701.
[2]Malhi H,Kaufman RJ.Endoplasmic reticulum stress in liver disease[J].J Hepatol,2011,54(4):795-809.
[3]郑义,高博,景维,等.丙型肝炎病毒非结构蛋白NS4B诱导细胞非折叠蛋白反应[J].中国病毒学,2005,20(4):374-378.
[4]Zheng Y,Gao B,Ye L,et al.Hepatitis C virus non-structural protein NS4Bcan modulate an unfolded protein response[J].J Microbiol,2005,43(6):529-536.
[5]Lemon SM,McKeating JA,Pietschmann T,et al.Development of novel therapies for hepatitis C [J].Antiviral Res,2010,86(1):79-92.
[6]熊舒珺,吴晓玉,孔令保.丙型肝炎病毒RNA聚合酶在HepG2细胞的稳定表达及活性分析[J].实用医学杂志,2010,26(3):355-388.
[7]孔令保,吴晓玉,李昆太,等.持续表达HCV NS5B的Bel-7402细胞系的构建与鉴定[J].江西农业大学学报,2009,31(4):717-723.
[8]Egger D,Wolk B,Gosert R,et al.Expression of hepatitis C virus proteins induces distinct membrane alterations including a candidate viral replication complex[J].J Virol,2002,76(12):5974-5984.
[9]Tardif KD,Mori K,Siddiqui A.Hepatitis C virus subgenomic replicons induce endoplasmic reticulum stress activating an intracellular signaling pathway[J].J Virol,2002,76(15):7453-7459.
[10]Sekine-Osajima Y,Sakamoto N,Mishima K,et al.Development of plaque assays for hepatitis C virus-JFH1strain and isolation of mutants with enhanced cytopathogenicity and replication capacity [J].Virology,2008,371(1):71-85.
[11]Joyce MA,Walters KA,Lamb SE,et al.HCV induces oxidative and ER stress,and sensitizes infected cells to apoptosis in SCID/Alb-uPA mice[J].PLoS Pathog,2009,5(2):e1000291.
[12]Maio M,Coral S,Fratta E,et al.Epigenetic targets for immune intervention in human malignancies[J].Oncogene,2003(22):6484-6488.
[13]Asselah T,Bièche I,Mansouri A,et al.In vivo hepatic endoplasmic reticulum stress in patients with chronic hepatitis C [J].J Pathol,2010,221(3):264-274.
[14]Tai DI,Tsai SL,Chen YM,et al.Activation of nuclear factor kappaB in hepatitis C virus infection:implications for pathogenesis and hepatocarcinogenesis[J].Hepatology,2000,31(3):656-664.
[15]Zhang Z,Rigas B.NF-kappaB,inflammation and pancreatic carcinogenesis:NF-kappaB as a chemoprevention target(review)[J].Int J Oncol,2006,29(1):185-192.

