骨折预处理对兔骨髓来源间充质干细胞的影响
席冬梅,曾 勇
(三峡大学仁和医院骨科,湖北 宜昌443001)
骨髓来源间充质干细胞(bone marrow derived mesenchymal stem cells,MSC)在特定的生理和病理情况下,能迁移到特定的组织器官参与组织的修复重建[1-2],且其作为骨组织工程的种子细胞已得到广泛应用[3]。目前的研究多集中于后期处理对MSC功能及分化的影响,而前期对所取得骨髓标本进行预处理的研究比较少见。因此,本研究对比了骨折预处理对兔MSC的影响,旨在为其更好地应用于骨组织工程及其功能研究奠定基础。
1 材料与方法
1.1 主要试剂与仪器
胎牛血清、DMEM高糖培养基购于美国Gibco公司,磷酸盐缓冲液(PBS)购于武汉博士德生物工程有限公司。流式细胞仪购自美国BD公司(型号:FACSCalibur)。
1.2 动物分组及骨折模型制作
12 周龄兔 10 只,雌雄不限,体质量(2 512±48)g,购于三峡大学医学院动物实验中心。按随机数字表法分为骨折预处理组和对照组,每组5只。将骨折预处理组兔麻醉后沿股外侧肌间隙钝性分离进入到达股骨干,在胫骨干中1/3段用线锯锯断成横形骨折,以直径3mm克氏针作逆行髓内固定,骨折固定牢固后,用生理盐水冲洗伤口,碘伏消毒,关闭伤口。对照组未进行任何处理。
1.3 MSC的培养
骨折预处理组骨折模型制作好7 d后,从另一侧股骨处无菌抽取骨髓1~2 mL,用 5 mL PBS混匀后,离心机(1 000 r·min-1)离心 10 min。 将沉淀的MSC细胞重悬于5 mL 10%胎牛血清的DMEM高糖培养基培养液中,2×106个接种于塑料培养瓶中。对照组从股骨抽取骨髓培养,方法同骨折预处理组。
1.4 MSC的周期测定
待细胞已铺瓶底>80%后,采用酶消化法常规消化细胞,离心,弃上清,PBS冲洗2次,加入4℃预冷的70%乙醇3 mL固定过夜。DPBS(杜氏磷酸缓冲液)洗涤、离心2次后,弃上清。细胞重悬于50μg·mL-1的 PI染液(含 50 μg·mL-1的 RNase)中,37 ℃避光水浴30min。300目滤布过滤,上流式细胞仪检测细胞周期。实验重复3次。传代(P2-4)细胞用于实验。
1.5 MTT(噻唑兰)比色实验
分别检测骨折预处理组与对照组传代细胞(分别用P2、P3、P4表示)的增殖能力。常规消化对数生长期的细胞,接种于培养基96孔板中,培养24 h后弃去孔内培养液,PBS冲洗。加无血清DMEM后继续培养至所设定的时间,弃去孔内培养液,加入180μL无血清DMEM (达氏必须基本培养基)+MTT溶液20μL 37℃孵育4 h,吸出培养液,加150μL DMSO(二甲基亚砜),然后将孔板放置于摇床震荡10min。上酶标仪,选择490 nm波长,测各孔吸光度值,每组设5个复孔,实验重复3次。
1.6 统计学方法
2 结果
2.1 MSC的形态学表现
2组接种24 h后首次换液,对照组仅出现少量细胞贴壁现象(封四图1A);骨折预处理组贴壁细胞较多,并出现细胞集落(封四图1B)。之后2~3 d骨折预处理组贴壁细胞明显增大并迅速开始分裂增殖,细胞伸出突起,呈梭形、纺锤形和多角形,细胞集落迅速增多,互相融合,5 d可铺满瓶底至80%左右(封四图1C),已可进行传代。而对照组此时仅铺瓶底约40%左右(封四图1D),在8~9 d后可进行传代。
2.2 骨折预处理对MSC增殖的影响
骨折预处理组MSC的增殖能力明显强于对照组,在 P2、P3 代时 MSC 高于对照组(均P<0.05);随着时间的延长,P4代时2组MSC增殖能力比较差异无统计学意义(P>0.05)。 见表 1。
表1 2组P2、P3、P4代时MSC增殖能力的比较 ±s
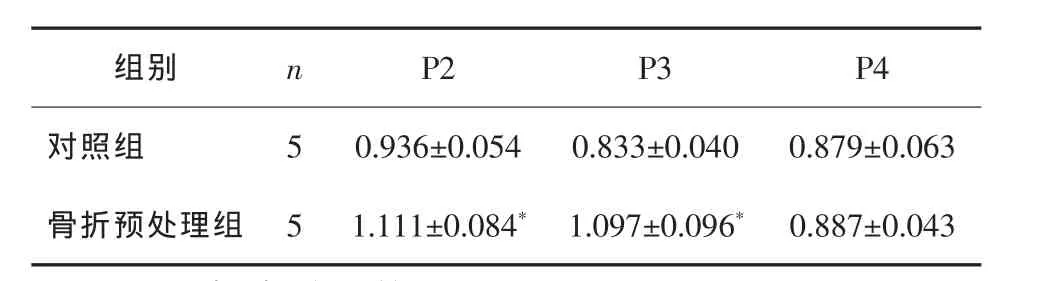
表1 2组P2、P3、P4代时MSC增殖能力的比较 ±s
*P<0.05与对照组比较。
组别 n P2 P3 P4对照组 5 0.936±0.054 0.833±0.040 0.879±0.063骨折预处理组 5 1.111±0.084* 1.097±0.096* 0.887±0.043
2.3 细胞周期的测定
P4代MSC采用流式细胞仪检测结果显示:骨折预处理组MSC中G0/G1期细胞为70.65%,G2/M期细胞为10.40%,S期细胞为18.95%;对照组MSC中G0/G1期细胞为72.40%,G2/M期细胞为11.35%,S期细胞为16.25%。2组比较差异均无统计学意义(均 P>0.05)。
3 讨论
MSC具有向骨、软骨、脂肪、肌肉、肌腱及骨髓间质等多种间充质组织分化的潜能,并且当机体某个部位受到损伤或发生慢性炎症时,具有多向分化潜能的MSC及其衍生因子会向受损部位募集,参与组织的重建[4]。 有研究[5-6]表明,骨折后机体在创伤及缺氧等刺激下也会产生一系列炎症因子和趋化因子,如白细胞介素、集落刺激因子、SDF-1等,通过因子和受体的结合产生一系列的作用从而构成了骨折修复的复杂级联反应过程,包括MSC动员、募集到骨折部位及其增殖和分化为骨组织。此级联炎症反应阶段发生在创伤后 48~72 h[7],在此期间抽取外周血培养出的 MSC形成的集落数比其他时间点多[8]。
因此,笔者推测在骨折修复过程中,因为炎症因子和趋化因子的作用,MSC会表现的更加活跃。本研究发现,骨折预处理组7 d后采用全骨髓贴壁法培养的MSC更容易出现贴壁现象,且细胞集落出现较早,在24 h首次换液后即可出现;首次传代时间也出现的较早,约5 d左右。而对照组则需8~9 d才可以铺满瓶底至80%左右,进行传代,初步证实了笔者的推测。
通过进一步的研究,笔者发现,骨折预处理组P2-3代的MSC具有比对照组更强的增殖能力,但该增殖能力经过多次传代后,至P4代时消失。推测随着传代的增加及时间的推移,机体内环境对其的影响逐渐去除,至P4代时MSC已完全恢复正常。有研究表明:脑外伤患者血清表现出明显的促进成MSC 增殖的作用[9]。还有研究[10]表明:虽然白血病细胞对MSC的增殖有明显的抑制作用,但经过多次传代后去除了白血病细胞的影响,即可恢复MSC的正常增殖特性。因此表明白血病骨髓 CFU-F数目减少,但其MSC的功能是正常的。这些均与本研究的结果较为一致。
因此,笔者认为,骨折预处理全骨髓贴壁法可在更短的时间内成功的培养出稳定的MSC,并且该细胞在P2-3代具有更强的增殖能力,直至P4代恢复常态,但导致其增殖能力提高与恢复的具体机制还需要研究者进一步的研究。
[1]Ramirez M,Lucia A,Gomez Gallego F,et al.Mobilisation of mesenchymal cells into blood in response to skeletalmuscle injury[J].Br JSports Med,2006,40(8):719-722.
[2]Bian Z Y,Li G,Gan Y K,et al.Increased number ofmesenchymal stem cell-like cells in peripheral blood of patientswith bone sarcomas[J].Arch Med Res,2009,40(3):163-168.
[3]Giannoudis P V,Einhorn T A,Schmidmaier G,et al.The diamond concept-open questions[J].Injury,2008,39(S2):S5-S8.
[4]Pittenger M F,Mackay A M,Beck S C,et al.Multilineage potential of adulthumanmesenchymal stem cells[J].Science,1999,284(5411):143-147.
[5]Kitaori T,Ito H,Schwarz E M,et al.Stromal cell-derived factor 1/CXCR4 signaling is critical for the recruitmentof mesenchymal stem cells to the fracture site during skeletal repair in amousemodel[J].Arthritis Rheum,2009,60(3):813-823.
[6]Forte G,Minieri M,Cossa P,et al.Hepatocyte growth factor effects on mesenchymal stem cells:proliferation,migration,and differentiation [J].Stem Cells,2006,24 (1):23-33.
[7]Einhorn T A.The science of fracture healing[J].JOrthop Trauma,2005,19(10):S4-S6.
[8]侯长举,朱振安,赵鑫,等.骨折后外周血间充质干细胞浓度变化的实验研究[J].中国矫形外科杂志,2012,20(2):160-164.
[9]Garland D E.Evidence for a humoralmechanism for enhanced osteogenesisafterhead injury[J].JBone JointSurg Am,1992,74(1):152-153.
[10]Nagao T,Yamauchi K,Komatsuda M.Inhibition of human bone marrow fibroblast colony formation by leukemic cells[J].Blood,1983,62(6):1261-1265.

