32P-胶体磷酸铬联合p53基因治疗恶性胸腔积液的临床研究
张长明 左书耀 闫瑞红
(1.青岛大学医学院附属医院核医学科,山东青岛 266021;2.聊城市人民医院核医学科,山东聊城 252000)
恶性胸腔积液是晚期恶性肿瘤常见的并发症之一,严重影响患者的生存质量。因此,有效控制恶性胸腔积液成为姑息性治疗晚期恶性肿瘤的措施之一。32P作为一种新型的放射性核素,近年来已被成功用于各种恶性胸腔积液的治疗[1]。p53肿瘤抑制基因与多数恶性肿瘤的发生、发展有关,在恶性肿瘤中,p53基因的异常表达率达40% ~70%[2],野生型p53基因导入可以增加放疗对肿瘤细胞的杀伤力[3-4]。我们应用32P-胶体磷酸铬联合重组人 p53腺病毒注射液治疗恶性胸腔积液,取得满意疗效,现报道如下。
1 资料与方法
1.1 一般资料
收集2006年9月至2011年6月收治的42例患者均经病理及胸水细胞学检查证实为恶性肿瘤所致单侧癌性胸腔积液。其中肺癌28例,乳腺癌9例,淋巴瘤2例,恶性胸膜间皮瘤2例,食管癌1例,男24例,女18例,年龄38~75岁,平均年龄56.4岁,预计生存期大于3月。所有患者随机分为2组,实验组21例、对照组21例。所有病例均有X线胸片、胸部CT和B超等检查证实存在中至大量胸腔积液(引流积液量均大于500ml),且血白细胞计数大于4.0×109/L,无明显肝肾功能障碍,近1个月内局部或全身未应用抗癌药物及生物制剂,治疗前后均拍摄X线胸片并行B超检查,化验血、尿常规,肝、肾功能并详细记录与治疗有关的症状:如胸痛、恶心、呕吐及其它不良反应。然后每隔1月复查以上检查项目进行比较。
1.2 试验药物
32P-胶体磷酸铬(Cr32PO4)由中国原子能科学研究院同位素研究所提供。重组人p53腺病毒注射液(recombinant adenovirus p53 injection,rAD -p53)由深圳市赛百诺基因技术有限公司提供,每支为1×1012VP(Virus particle,病毒颗粒)。
1.3 治疗方法
全部病例根据B超定位穿刺、置入中心静脉导管,分次彻底引流后,实验组用100 ml生理盐水溶解重组人p53腺病毒注射液1支(1×1012VP)经引流管注入胸腔,注药后患者2 h内每10 min变换一次体位。72 h后将32P-胶体磷酸铬185 MBq加入50 ml生理盐水混匀后经引流管注入胸腔,撤掉引流管,患者2h内每10 min变换一次体位。对照组在引流彻底后仅注射32P-胶体磷酸铬185 MBq。所有治疗每月一次,治疗两次后评价疗效。
1.4 疗效评价标准
按WHO对癌性渗液的疗效评定标准[5],完全缓解(CR):胸水完全消失达4周以上,B超示胸膜腔闭合或大部分粘连、无胸腔积液,症状明显缓解或消失;部分缓解(PR):胸水较治疗前减少50%以上,B超示胸膜腔为纤维素分隔、包裹,残留胸腔积液无增长,症状明显改善持续 4周以上;无效(NC):用药后无缓解或暂时缓解后很快加重。
1.5 统计学处理
组间有效率的比较采用χ2检验,完全缓解和部分缓解均视为有效,以完全缓解和部分缓解患者之和计算总有效率。
2 结果
2.1 结果
实验组患者CR9例,PR8例,NC4例,总有效率(CR+PR)为81.0%,对照组 CR5 例,PR5 例,NC11例,总有效率(CR+PR)为47.6%。实验组与对照组比较:χ2=5.081,P <0.05,差异有统计学意义,见表1。
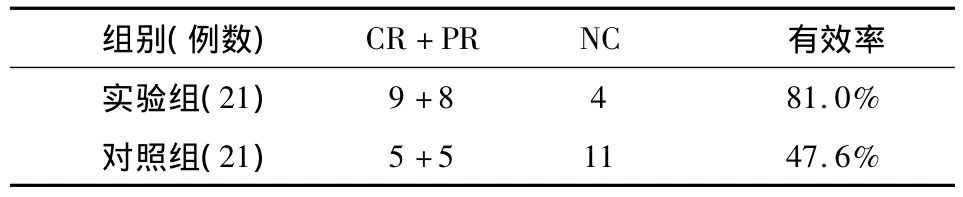
表1 有效率比较
2.2 不良反应
实验组有4例在注射rAd-p53当天出现低热,3例在注射rAd-p53后第2d出现低热,均为自限性,12h内自行恢复正常,不伴有上呼吸道感染症状和局部体征。各组均无过敏反应,无明显的骨髓抑制发生;患者的血、尿常规及肝、肾功能均无明显改变。
3 讨论
恶性胸腔积液是晚期恶性肿瘤的常见并发症之一。晚期肿瘤转移形成胸腔积液的主要机制为(1)肿瘤直接侵犯脏层、壁层胸膜引起炎症渗出;(2)侵犯淋巴系统导致淋巴回流受阻;(3)恶性肿瘤侵袭或转移至胸膜后,胸膜血管内皮生长因子(VEGF)升高进而导致毛细血管通透性增加;(4))肿瘤细胞分泌或释放蛋白因子等[6]。
32P的物理半衰期为14.3天,为纯β发射体,最大能量1.71MeV,平均能量 0.69MeV,平均组织射程4 mm,最大8.6 mm,其射程短,对临近器官和骨髓辐射作用小。32P-胶体磷酸铬属惰性物质,有不溶解、不发生生物化学作用的特点,注入胸腔内不溶于体液,因而不被吸收,大部分停留在局部,附着在胸膜腔内壁或被粘着于积液中的游离癌细胞上,或被肿瘤近旁淋巴管及淋巴结中的网状内皮系统吞噬细胞所吞噬,使放射性胶体较多的浓聚在肿瘤病灶及附近[7]。32P发出的β射线,对渗出液内游离癌细胞和散播在浆膜表面的肿瘤结节进行照射,通过射线辐射生物效应可直接杀死癌细胞,也能直接破坏浆膜表面粟粒样转移灶,使其趋向纤维化,还可促使内皮下层纤维化,局部血管和淋巴管闭塞,以及浆膜脏层和壁层粘合而使渗出液减少。
p53基因是一种重要的肿瘤抑制基因,能诱导终末分化,维持基因稳定,触发衰老和诱导细胞凋亡,是负生长调控因子;在p53基因缺失或发生突变的细胞,DNA损伤后不能通过p53介导的途径进入G1停滞和DNA修复,遗传信息受损的细胞可以进入增殖,最终可发生恶性肿瘤[8]。rAD-p53是一种复制缺陷的携带p53基因的腺病毒,进入人体后通过复制缺陷型腺病毒将野生型p53基因片断导入肿瘤细胞,通过①直接引起细胞凋亡,②或通过抑制血管内皮生长因子(VEGF)基因和药物多抗性基因表达,③还可以刺激机体产生抗肿瘤免疫反应,使肿瘤局部聚集大量的免疫细胞,从而实现基因治疗的目的,还可以增加放、化疗对肿瘤细胞的作用[9]。将p53基因导入p53突变和功能缺陷的肿瘤细胞后,对放疗引起的DNA损伤,p53立刻启动活化肿瘤细胞的凋亡途径,因此大大提高放疗的敏感性[3]。马洁韬等[10]研究发现rAd-p53对体外肺腺癌细胞具有放射增敏作用,rAd-p53能影响细胞周期的再分布,使对射线敏感的G2/M期细胞增多,对射线抗拒的S期细胞相应减少,与照射具有协同作用。
本研究结果显示,实验组的总有效率较对照组明显提高。说明rAd-p53可以提高32P内放疗效果或二者有协同作用。rAd-p53进入体内3小时后,p53基因开始表达,生成P53蛋白,第三天达高峰,第五天降至30%[11]。我们在32P注入胸腔72小时后再给予rAd-p53,尽量避免放射线干扰p53的表达,力求两者疗效达最佳协同效果。实验组有少数患者在注射rAd-p53后出现低热,均为自限性,12h内自行恢复正常,对照组无此反应,可能与rAdp53引起的免疫反应有关,而患者未诉其它不适,化验检查亦无明显异常,说明rAd-p53与32P-胶体磷酸铬联合胸腔内注射是安全的。
综上所述,32P-胶体磷酸铬与p53基因联合腔内注射治疗恶性胸腔积液可以有效地控制癌性胸水的生长及复发,改善患者的生存质量,是治疗恶性胸腔积液的有效方法。
[1] 张英,张长明,郑建国,等.32P—胶体磷酸铬与顺铂腔内治疗恶性胸腔积液的对比研究[J].中华核医学杂志,2008,28(1):61.
[2] Hunt KK ,Vorburger SA.Hurdles and hopes for cancer treatment[J].Science,2002,19:415 -416.
[3] Frank DK,Frederick MJ,Liu TJ,et al.Bystander effect in the adenovirus-mediated wild-type p53 gene therapy model of human squamous cell carcinoma of the head and neck[J].Clin Cancer Res,1998,4(10):2521 -2527
[4] Lacroix M,Toillon RA,Leclercq G.p53 and breast cancer,an update.Endocr Relat Cancer,2006,13(2):293 -325.
[5] 中国抗癌协会.中国常见恶性肿瘤诊治规范(第9分册).第2版.北京:北京医科大学中国协和医科大学联合出版社,1991:13-15.
[6] 陈群,石琴,谢强,等.重组人血管内皮抑制素联合化疗治疗恶性胸膜腔积液的临床观察[J].临床肿瘤学杂志,2008,13(10):938-941.
[7] 谭天秩.临床核医学.第2版.北京.人民卫生出版社,2003:1315-1316
[8] 史爱学,杨举伦.p53基因治疗恶性肿瘤的现状与趋势[J].西南国防医药,2004,14(1):
[9] 赵伟珠,王季堃,李巍,等.重组人p53腺病毒注射液联合顺铂治疗肺癌所致胸腔积液的临床研究[J].癌症,2009,28(12):1324-1327.
[10] 马洁韬,郑伟,邹华伟.重组人腺病毒p53提高肺腺癌放射敏感性的实验观察[J].中国医科大学学报,2007,36(4):424-426.
[11] 官泳松,刘源,贺庆,等.p53基因联合支气管动脉化疗治疗中晚期肺癌[J].美中医学,2004,1(1):11.

