钩藤碱对阿霉素诱导的大鼠肾损伤的作用及其机制*
龙吉美,黄德彬,李魁武,罗 琼
(1湖北省建始县人民医院,湖北 建始 445300;2湖北民族学院医学院,湖北 恩施 445000)
钩藤碱(rhynchophylline,RHL)系茜草科植物钩藤[Uncaria rhynchophylla(Miq.)Jackson]的主要成分。钩藤水提取物具有息风定惊、清热平肝等功效[1]。现代药理学研究证实,RHL具有保护脑缺血再灌注所致的脑损伤作用,还具有显著的钙拮抗、抑制心肌重构、降低血压、抗心律失常等作用[2]。临床用于治疗高血压、支气管哮喘、癫痫等疾病[3]。有研究报道,钩藤碱和异钩藤碱能显著抑制血管紧张素Ⅱ(angiotensin Ⅱ,AngⅡ)所导致的血管重塑[3],其机制与下调NF-κB蛋白表达及抑制c-myc、c-fos基因mRNA转录有关[2]。我们研究发现钩藤碱具有改善阿霉素肾病大鼠肾功能的作用,其机制与增强超氧化物歧化酶(superoxide dismutase,SOD)活性,減少丙二醛(malondialdehyde,MDA)生成,调控肾组织血管紧张素受体1、2(angiotensin receptors 1,2,AT1,2- R)、血管紧张素转换酶(angiotensin - converting enzyme,ACE)和 血管紧张素原(angiotensinogen,AGT)mRNA表达等相关。但RHL对阿霉素肾病大鼠肾损伤的作用尚不清楚,本研究观察RHL对阿霉素致大鼠肾功能损伤的作用并探讨其机制。
材料和方法
1 材料
1.1 动物 SPF级成年雌性SD大鼠52只,体重 (180±20)g(重庆医科大学实验动物中心,4110817)。分笼饲养(每笼3~4只),温度维持在(25±3)℃,相对湿度(55±15)%,按光照与黑暗每天12 h轮替。饲料与饮水均经灭菌处理。
1.2 器材 大鼠代谢笼(M-5,1410 mm×400 mm×1550 mm,上海中胜科教设备有限公司);全自动生化分析仪(美国思博名科学器材公司);石蜡包埋机(EG1150-H);切片机(RM2245);全自动组织脱水机和显微镜(DM2000);全自动显微镜数码摄像系统(Olympus);电子分析天平(Sartorius);3K30型低温高速离心机(Sigma);超纯水装置(Millipore);Du-7500紫外分光光度计(Beckman);TP600型PCR基因扩增仪(TaKaRa);电泳仪及电泳槽(江苏仪器厂);LG2020D型凝胶成像分析系统(北京君意东方电泳设备有限公司);F200酶标仪(帝肯);微量加样器(Gilson)。
1.3 主要试剂 水合氯醛(上海金贸泰化工有限公司);钩藤碱(RHL,Sigma);阿霉素(adriamycin,ADR,Sigma);SOD 和MDA检测试剂盒(碧云天生物技术研究所,NBT法和TBA法);伊红、苏木素、多聚赖氨酸、S-P试剂盒及DAB显色试剂盒(福州迈新生物技术有限公司);PCR引物和DL2000 DNA marker(大连宝生物工程公司);PV6001二步法检测试剂盒和DAB显色试剂盒(北京中杉金桥);Trizol Reagent和引物核苷酸片段(Invitrogen);M-MuLV反转录酶(Promega);琼脂糖(Promega);PCR Mix试剂盒(北京天根生化科技有限公司)。
2 方法
2.1 动物分组与处理 随机将大鼠分成4组,即生理盐水组(NSG,n=10)、模型组(MG,n=14)、钩藤碱低剂量治疗组(RHL-LG,n=14)和高剂量治疗组(RHL-HG,n=14)。MG、RHL-LG和RHL-HG经尾静脉注射阿霉素(5 mg·kg-1)制造肾病模型,NSG注射等容量生理盐水(NS)。2周后检测尿蛋白含量为(+++)者纳入肾病模型实验(比例为65%),MG、RHL-LG和 RHL-HG分别为8只、10只和9只。各组大鼠适应性喂养1周后,RHL-LG和RHL-HG分别给予腹腔注射 RHL 5mg·kg-1和 15 mg·kg-1[4],NSG、MG分别给予腹腔注射等容量NS,共治疗8周。
2.2 标本收集
2.2.1 血液标本采集 自眼眶静脉丛采血。先按压大鼠颈部两侧,让眼眶静脉丛充分充血,以毛细玻璃管自眼内角呈45°角刺入,采集血液约 1~2 mL,室温静置 15 min,4 ℃、3000 r/min离心15 min,吸取血清,以生化指标检测备用。
2.2.2 尿液的收集 用代谢笼采集尿液标本。分别于0周、2周、4周、6周、8周的最后1 d收集24 h尿液标本,测量24 h尿量,吸取尿液,25℃、1000 r/min离心10 min后,取上清液放入-20℃冰箱保存备用。
2.2.3 肾组织标本采集 动物处死前,以水合氯醛(10%,3mg/kg)腹腔麻醉,迅速摘下右肾置入液氮保存备用。左肾以4%多聚甲醛固定,HE染色、免疫组化染色备用。
2.3 标本检测
2.3.1 生化指标检测 以全自动生化分析仪检测血清和尿液中总蛋白、白蛋白、血清肌酐(serum creatinine,SCr)及血尿素氮(blood urea nitrogen,BUN)等指标。24 h尿蛋白定量计算方法[5]:24 h尿蛋白定量(mg/d)=尿蛋白浓度(mg/L)×24 h尿量(L)。
2.3.2 MDA含量与SOD活性分析 严格按照厂家说明书用试剂盒检测MDA含量和SOD活性,简要地说,就是用匀浆机将实验动物的肝组织匀浆,取上清液样品用于MDA含量和SOD活性分析,在586 nm波长范围内检测MDA含量 和SOD活性。
2.3.3 病理学检测(HE染色) 以10%甲醛固定24 h,经梯度乙醇(70%、80%、95%、100%)脱水,二甲苯Ⅰ、Ⅱ透明处理,常规浸蜡包埋,脱蜡,苏木素染核,分化,反蓝,脱水,中性树胶封固。
2.3.4 RT - PCR 检测 AT1,2- R、ACE 及 AGT mRNA 表达按文献[6]用RT-PCR法半定量分析各自mRNA水平(用Trizol试剂提取肾组织总RNA)。取100 mg液氮冻存肾组织研磨,加入Trizol 1 mL,用匀浆器匀浆,25℃孵育10 min。4℃、12000×g离心5 min,弃沉淀。吸取上清液加入新离心管,加入氯仿200 μL,混匀,于 25℃静置 5 min,再离心 15 min(12000×g、4℃)。吸取上清液,加入另一离心管,加入0.5 mL异丙醇,25℃静置10 min。继续离心10 min(4℃、12000×g),去除上清液,以乙醇洗涤RNA沉淀(75%,1 mL),混均匀。离心5 min(4℃、80000×g),弃上清。再漂洗沉淀,25℃晾干,沉淀 RNA 10 min。用 30~50 μL RNase-free ddH2O溶解沉淀,55℃水浴助溶10 min,漩涡混匀30 s,离心(4℃、120000×g),得到上清RNA样品。
RT反应:取5 μL加入DEPC处理的45 μL无菌水,用紫外分光光度计测量A值检测RNA(A260/A280在1.8~2.0为纯度合格)。另取5 μL,以琼脂糖甲醛变性胶电泳对RNA进行鉴定,余下部分于-85℃冰箱保存备用。按AMV逆转录酶说明书进行第一链cDNA合成。取AMV逆转录酶1 μL,5×RT 反应缓冲液4 μL,dNTP 混合物4 μL(每种2.5 mmol/L),Oligo dT15Primers 2 μL(50 μmol/L),总 RNA 2 μg,最后加入适量RNase-free ddH2O至总体积达20 μL。将混合物置10 min(25℃),置入水浴孵育1 h(42℃)得cDNA,吸取cDNA 2 μL进行PCR扩增。
PCR 反应:2 μL cDNA,12.5 μL 2 × Taq Master,10 pmol相应引物,加入适量ddH2O至25 μL。吸取10 μL扩增物,用琼脂糖凝胶(2%)行DNA电泳,Tanon-1600 Figure Gel凝胶成像系统拍照,以软件GIS1D Gel Image System分析条带吸光度(A值),结果以目的基因和β-actin A值比值表示。其引物序列如下:AT1-R上游引物5'-GCACAATCGCCATAATTATCC -3',下游引物 5'- CACCTATGTAAGATCGCTTC -3',扩增片段445 bp,退火温度53℃;AT2-R上游引物5'-GTGTCCAGCATTTACATCTTCA -3',下游引物 5'-CACCAAACAAGGGGAACTAC-3',扩增片段275 bp,退火温度,55℃;ACE 上游引物5'-GCAGAACTTCACTGACCAAAAG -3',下游引物5'-TCAAAGGAGGGGGACTCATA-3',扩增片段 383 bp,退火温度55℃;AGT上游引物5'-TTGTTGAGAGCTTGGGTCCCTTCA-3',下游引物 5'-CAGACACTGAGGTGCTGTTGTCCA-3',扩增片段265 bp,退火温度60℃;β-actin上游引物5'-GGGTGATGCTGGTGCTGAGTATGT-3',下游引物5'-AAGAATGGGTGTTGCTGTTGAAGTC -3',扩增片段617 bp,退火温度55℃。
3 统计学处理
结 果
1 RHL对大鼠24 h尿蛋白的影响
MG、RHL-LG和RHL-HG经尾静脉注射阿霉素2周后出现蛋白尿,显著高于NSG(P<0.05),表明急性肾功能衰竭模型制造成功。24 h尿蛋白含量从2~8周呈现持续上升趋势。RHL-LG显著低于MG,而高于RHL-HG(P<0.05),呈现明显的剂量依赖趋势,见图1。

Figure1.Effect of RHL on 24 h urine protein in rats.*P <0.05vs NSG;△P<0.05 vs MG;▲P<0.05 vs RHL-LG.图1 RHL对大鼠24 h尿蛋白的影响
2 RHL对大鼠血清中BUN和SCr含量的影响
MG、RHL-LG和RHL-HG血清中BUN和SCr显著高于NSG(P<0.05),表明急性肾功能衰竭模型制造成功。其中,RHL-LG血清中的BUN和SCr显著低于MG,而高于RHL-HG(P<0.05),呈现明显的剂量依赖趋势,见表1。
表1 RHL对大鼠血清中BUN和SCr含量的影响Table1.Effects of RHL on BUN and SCr in rats()

表1 RHL对大鼠血清中BUN和SCr含量的影响Table1.Effects of RHL on BUN and SCr in rats()
*P<0.05 vs NSG;△P<0.05 vs MG;▲P<0.05 vs RHLLG.
Group n BUN(mmol/L) SCr(μmol/L)NSG 10 7.93 ±1.67 31.58 ±2.06 MG 8 23.43 ±2.54* 56.84 ±3.25*RHL - LG 10 16.95 ±1.83*△ 44.15 ±2.76*△RHL - HG 9 10.17 ±1.37*△▲ 37.92 ±3.71*△▲
3 RHL对大鼠肾组织形态学的影响
与NSG相比,MG、RHL-LG和RHL-HG大鼠肾小球毛细血管显著充血,系膜区明显增厚,系膜基质显著增多,足突细胞明显肥大。RHL-LG的炎症、系膜区增厚和系膜基质增多明显轻于MG,肾小球充血及肾小球管型明显少于MG。而RHL-HG的病理改变又显著轻于RHL-LG,见图2。
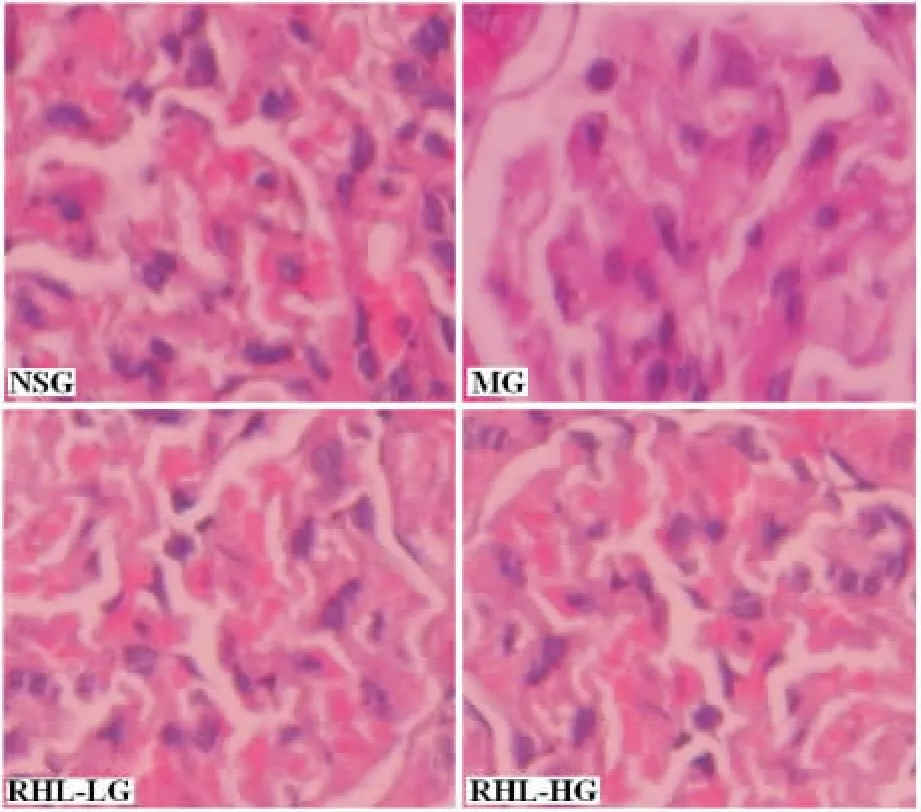
Figure2.Effects of RHL on the morphology of rat renal tissues(HE staining,×400).图2 RHL对大鼠肾组织形态学的影响
4 RHL对大鼠肾组织中SOD活性及MDA含量的影响
MG、RHL-LG和RHL-HG大鼠肾组织中SOD活性显著低于NSG(P<0.05);MG显著低于RHL-LG,而RHLLG又明显低于 RHL-HG(P<0.05)。MG、RHL-LG和RHL-HG大鼠肾组织中 MDA含量显著高于 NSG(P<0.05);MG显著高于 RHL-LG,而RHL-LG又明显高于RHL-HG(P<0.05),见表2。
表2 RHL对大鼠肾组织中SOD活性与MDA含量的影响Table2.Effects of RHL on SOD activity and MDA content in rat renal tissues()

表2 RHL对大鼠肾组织中SOD活性与MDA含量的影响Table2.Effects of RHL on SOD activity and MDA content in rat renal tissues()
*P<0.05 vs NSG;△P<0.05 vs MG;▲P <0.05 vs RHL-LG.
Group n SOD[μmol/(g protein)]MDA[μmol/(g protein )]NSG 10 533.62±27.71 1.37±0.25 MG 8 297.54±21.57* 4.08±0.41*RHL-LG 10 379.46±29.61*△ 3.42±0.28* △RHL-HG 9 457.18±30.06*△▲ 2.28±0.21*△▲
5 RHL对大鼠肾组织中AT1,2-R、ACE和AGT mRNA表达的影响
MG大鼠肾组织中AT1-R、ACE和 AGT mRNA表达显著高于NSG和RHL-LG,而RHL-LG又显著高于RHLHG(P<0.05),MG和RHL-LG大鼠肾组织中AT2-R mRNA表达显著低于NSG和RHL-HG(P<0.05),MG显著低于RHL-HG,RHL-LG与NSG间无显著差异(P>0.05),见图 3、表 3。
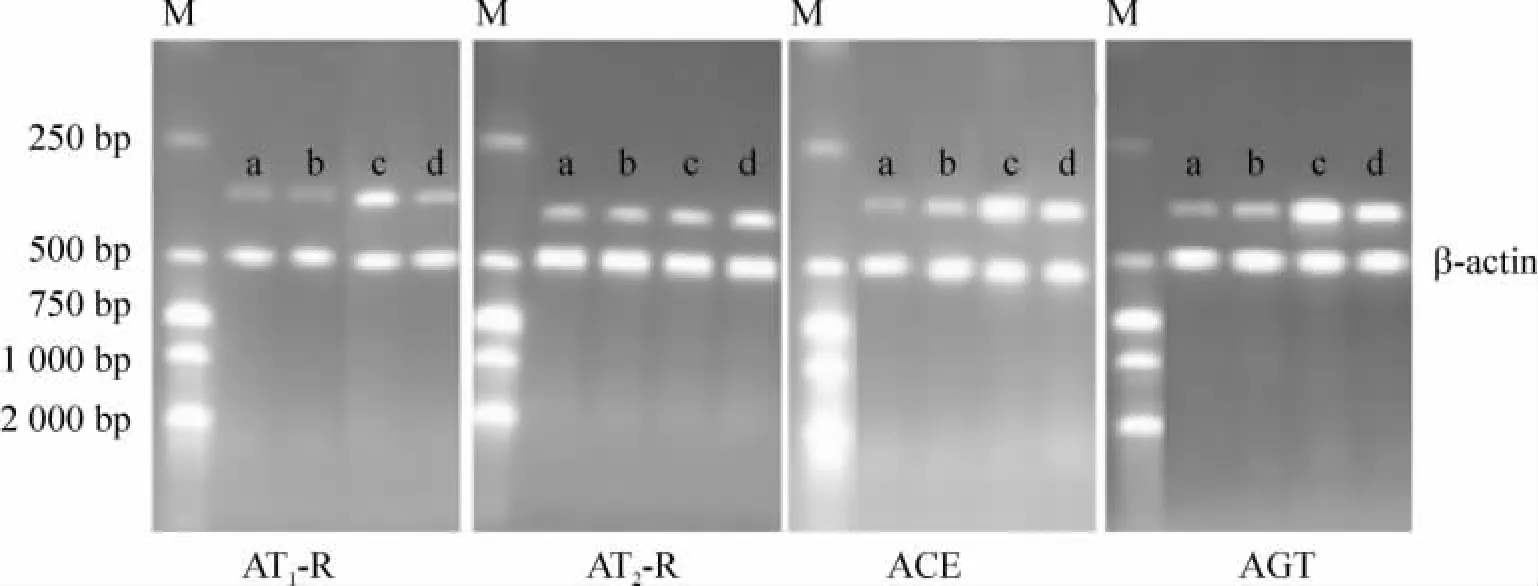
Figure3.Effects of RHL on the mRNA expression of AT1,2 - R,ACE and AGT in rat renal tissue.M:DNA marker;a:RHL - HG;b:RHL-LG;c:MG;d:NSG.图3 RHL对大鼠肾组织中AT1,2-R、ACE和AGT mRNA表达的影响
表3 RHL对大鼠肾组织中AT1,2-R、ACE和 AGT mRNA表达的影响Table3.Effects of RHL on the mRNA expression of AT1,2-R,ACE and AGT in rat renal tissues()

表3 RHL对大鼠肾组织中AT1,2-R、ACE和 AGT mRNA表达的影响Table3.Effects of RHL on the mRNA expression of AT1,2-R,ACE and AGT in rat renal tissues()
*P<0.05 vs NSG;△P<0.05 vs MG;▲P<0.05 vs RHL-LG.
-actin NSG 10 1.00 ±0.14 1.00 ±0.17 1.00 ±0.13 1.00 ±0.Group n AT1-R/β -actin AT2-R/β -actin ACE/β -actin AGT/β 11 MG 8 1.64 ±0.18* 0.43 ±0.15* 1.94 ±0.16* 1.52 ±0.12*RHL -LG 10 1.13 ±0.09△ 0.68 ±0.07*△ 1.61 ±0.15*△ 1.17 ±0.08△RHL -HG 9 0.71 ±0.13*△▲ 0.98 ±0.18△▲ 1.33 ±0.08*△▲ 0.67 ±0.14*△▲
讨 论
肾脏疾病发病率呈逐年上升趋势,现已超过7%。据最新资料报道[4],全球已超过5亿肾脏疾病患者,特别是慢性肾脏疾病已成为继肿瘤、心脑血管疾病、糖尿病之后威胁人类健康的重大疾病,目前还没有充分有效的手段阻止其肾功能进行性下降[5]。肾功能衰竭主要病理变化表现为肾小管间质损伤,出现肾小管间质炎细胞浸润、细胞表型转化、上皮细胞变性、坏死、萎缩和间质纤维化等。研究表明,肾小管间质病变是反映肾功能下降程度以及判断其转归的关键指标[6]。以前人们一直认为,蛋白尿、血尿素氮和肌酐升高是肾小球疾病的主要临床表现,直接反映肾小球的损伤程度。但随着肾脏疾病研究的发展,人们逐渐认识到这些症状不仅是肾小球损伤的生物学标志,而且还是参与肾脏疾病发展的一个独立致病因素[5],可直接加速肾小球硬化和肾小管间质损伤。
RHL具有扩张血管和抗高血压的作用,有很好的临床应用价值。本研究显示,经尾静脉注射阿霉素的各组大鼠2周后开始出现蛋白尿,并有BUN和SCr显著升高,其浓度从2~8周呈现持续上升趋势。RHL-LG显著低于MG组,而高于RHL-HG,呈现明显的剂量依赖趋势。肾组织形态学观察结果显示,与NSG相比,MG组、RHL-LG和RHL-HG大鼠肾小球毛细血管显著充血,系膜区明显增厚,系膜基质显著增多,足突细胞明显肥大。其中RHL-LG的炎症、系膜区增厚、系膜基质增多以及肾小球充血显著轻于MG组,肾小球管型明显少于MG组。而RHL-HG又显著轻于RHL-LG。这些证据提示,RHL能减轻阿霉素所致的大鼠肾功能损伤,其作用机制可能与以下因素有关:(1)RHL增强肾组织中SOD活性与降低MDA含量,维持肾脏组织代谢与功能,阻止肾小管细胞凋亡:阿霉素损伤肾小管后,肾脏组织产生氧自由基,直接破坏肾小管膜的多不饱和脂肪酸而诱发脂质过氧化反应[7],其反应结果是将活性氧转为非自由基性脂质产物,由链式反应放大活性氧效应,产生MDA、酮基等多种脂质过氧化物[8]。MDA能引起核酸、蛋白质等大分子物质交联聚合,产生细胞毒性效应,并伴随细胞代谢紊乱和功能障碍,最终导致肾小球和肾小管细胞凋亡[2,9]。因此,MDA含量能直接反映肾组织脂质过氧化的程度和肾小管细胞损伤程度。SOD是机体内清除氧自由基的重要抗氧化酶之一,SOD可清除肾脏组织中氧自由基,阻止氧自由基诱发的脂质过氧化反应,防止肾小管细胞损伤。因此,SOD活性可直接反映肾组织清除氧自由基的能力。本研究表明,MG组MDA含量显著高于RHL-LG,而RHL-LG又显著高于 RHL-HG;MG组SOD活性显著低于RHL-LG,而RHL-LG又显著低于RHLHG。因此,RHL减轻阿霉素致肾功能损伤的作用与增强SOD活性和抑制MDA的生成,从而改善肾组织的代谢功能,减少肾小管细胞凋亡有关。(2)RHL调控肾组织中AT1,2-R、ACE和 AGT mRNA表达,增加肾组织血流量,减轻肾小管纤维化:肾素-血管紧张素系统是重要的血压调节系统,其主要家族成员为:肾素、AGT、ACE、AngⅠ、AngⅡ、AT1,2- R及醛固酮(aldosterone,ALD)等。肾素使AGT转化为AngⅠ,AngⅠ在ACE作用下转变为AngⅡ,AngⅡ与AT1-R结合促使血管收缩,促进ALD分泌,增强钠、水潴留,持续升高血压。另一方面,AngⅡ作用于AT2-R,激活NO合酶活性、促进NO的合成[10-11]。而NO是一种不稳定的自由基,是一种新型生物信使分子,具有松弛平滑肌、抑制血小板黏附和炎症细胞浸润,调节局部组织血流量,降低血压,抑制血管内皮细胞增殖与迁移的作用[12-13]。
本实验结果显示,MG组AT1-R、ACE和AGT mRNA表达显著高于RHL-LG,而RHL-LG又显著高于RHL-HG;MG组和RHL-LG肾组织中AT2-R mRNA表达显著低于RHL-HG治疗组;其中,MG组显著低于RHL-LG治疗组,表明RHL抑制AT1-R、ACE和AGT mRNA表达而上调AT2-R mRNA表达。这与有关报道的RHL能抑制ACE活性、减少AngⅡ的生成[14]、增强肾性高血压大鼠NO/eNOS系统的报道一致[15]。因此,RHL改善阿霉素大鼠肾功能的机制可能与其抑制肾组织中AT1-R、ACE和AGT mRNA表达,上调AT2-R mRNA表达,增加肾组织血流量有关。
[1]李艳菊,孙安盛,余丽梅,等.钩藤碱对AngⅡ诱导大鼠血管平滑肌细胞增殖的抑制作用[J].中国药学杂志,2008,4(21):1621 -1624.
[2]李运伦.钩藤碱和异钩藤碱抑制血管紧张素Ⅱ诱导血管平滑肌细胞增殖及相关机制[J].中国药理学通报,2008,24(1):53 -58.
[3]刘 卫,张兆芹,赵晓民,等.钩藤总碱预处理对海马神经元急性缺氧的保护作用[J].中国中药杂志,2006,31(9):763-765.
[4]Dhingra R,Pencina MJ,Schrader P,et al.Relations of matrix remodeling biomarkers to blood pressure progression and incidence of hypertension in the community[J].Circulation,2009,119(8):1101 -1107.
[5]Misra S,Fu AA,Puggioni A,et al.Increased shear stress with upregulation of VEGF-A and its receptors and MMP-2,MMP-9,and TIMP-1 in venous stenosis of hemodialysis grafts[J].Am J Physiol Heart Circ Physiol,2008,294(5):H2219-H2230.
[6]Shenoy V,Ferreira AJ,Qi Y,et al.The angiotensin - converting enzyme 2/angiogenesis-(1-7)/Mas axis confers cardiopulmonary protection against lung fibrosis and pulmonary hypertension[J].Am J Respir Crit Care Med,2010,182(8):1065 -1072.
[7]何 娜,孙安盛,吴 芹,等.钩藤碱对血管紧张素Ⅱ诱导的心肌细胞肥大的抑制作用[J].中国药理学与毒理学杂志,2010,24(4):255 -258.
[8]Ainscough JF,Drinkhill MJ,Sedo A,et al.Angiotensin II type-1 receptor activation in the adult heartcauses blood pressure-independent hypertrophy and cardiac dysfunction[J].Cardiovasc Res,2009,81(3):592 -600.
[9]Kunz R,Friedrich C,Wolbers M,et al.Meta - analysis:effect of monotherapy and combination therapy with inhibitors of therenin angiotensin system on proteinuria in renal disease[J].Ann Intern Med,2008,148(1):30 -48.
[10]Mizuiri S,Hemmi H,Arita M,et al.Expression of ACE and ACE2 in individuals with diabetic kidney disease and healthy controls[J].Am J Kidney Dis,2008,51(4):613-623.
[11]Ferreira AJ,Shenoy V,Yamazato Y,et al.Evidence for angiotensin-converting enzyme 2 as a therapeutic target for the prevention of pulmonary hypertension[J].Am J Respir Crit Care Med,2009,179(11):1048 -1054.
[12]刘英超,王银环,耿 菲.ACE/ACE2在 AGT-REN双转基因高血压小鼠肾组织的表达变化及意义[J].中国病理生理杂志,2012,28(1):35 -40.
[13]黄燮南,石京山,谢笑龙,等.钩藤碱和异钩藤碱对45Ca转运的影响[J].中国药理学通报,1993,9(6):428-430.
[14]曹雯娟,王华东,陆大祥,等.钩藤碱降低内毒素血症小鼠死亡率的机制研究[J].中国病理生理杂志,2008,24(6):1148-1154.
[15]张丽心,孙 涛,曹永孝.钩藤碱的降压及舒张血管作用[J].中药药理与临床,2010,26(5):39 -42.

