IGFBP7对人乳腺癌MCF-7细胞增殖的影响及其机制*
袁 磊,左曙光,范文娟,宋国华
(漯河医学高等专科学校,河南 漯河 462002)
胰岛素样生长因子结合蛋白(insulin-like growth factor binding proteins,IGFBPs)是一个能够与胰岛素样生长因子(insulin-like growth factor,IGF)结合的蛋白质家族。根据与IGF亲和力的高低可将IGFBP超家族分成两类:高亲和力IGFBPs(IGFBP1~6)和低亲和力 IGFBPs(IGFBP7 ~ 10)[1]。与高亲和力IGFBPs相比,低亲和力IGFBPs与IGFs的亲和力低5~25倍,这提示低亲和力IGFBPs可能发挥一些与IGFBP家族其它成员不同的生物学作用。IGFBP7 是第一个被证实的低亲和力 IGFBPs[2-3]。IGFBP7在正常人体多种组织、器官中广泛表达,如心脏、脾脏、小肠、大肠、卵巢、乳腺等,然而在多种肿瘤组织中却表达下调甚至缺失,如黑色素瘤、肝癌、肺癌、前列腺癌和乳腺癌等。IGFBP7在正常乳腺导管和小叶上皮细胞均有表达[4],在衰老的乳腺上皮细胞中过表达(可达正常水平的10倍)[5],但在乳腺癌组织中表达下降[6],并且癌组织的侵袭力和恶性程度越高其表达越低[7]。因此IGFBP7可作为特异性标志物用于乳腺肿瘤的病理学和血清学诊断。大量研究表明,IGFBP7可抑制多种肿瘤组织的生长,促进肿瘤细胞的衰老和凋亡。本研究通过构建稳定表达IGFBP7的人乳腺癌MCF-7细胞,探究IGFBP7对人乳腺癌MCF-7细胞增殖的影响及其分子生物学机制。
材料和方法
1 动物
MCF-7细胞购自中国科学院细胞库,大肠杆菌菌株DH5α由学校分子医学实验中心提供。
2 主要试剂
胎牛血清和RPMI-1640培养基购自Gibco;质粒pCMV6-IGFBP7购自OriGene;质粒提取试剂盒、DNA纯化试剂盒购自北京天根公司;限制性核酸内切酶Sgf I和Not I购自大连宝生物公司;Effectene转染试剂盒购自Qiagen;兔抗人IGFBP7、细胞外信号调节激酶1/2(extracellular signal-regulated protein kinases 1/2,ERK1/2)、p - ERK1/2、细胞周期素(cyclin)D1、cyclin E、细胞周期素依赖性激酶(cyclindependent kinase,CDK)2、CDK4、p21CIP1/WAF1、p27KIP1、p53、Rb、p-Rb抗体和辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗兔 IgG购自 Sigma;ECL显色试剂盒购自上海汉恒公司。
3 主要方法
3.1 质粒pCMV6-IGFBP7的酶切鉴定及空质粒制备 以DH5α大肠杆菌制备感受态细胞,转化质粒pCMV6-IGFBP7,37℃过夜,挑取单菌落,置于含有氨苄青霉素(ampicillin,AMP)的 LB培养基中,37℃、200 r/min过夜。采用质粒提取试剂盒提取质粒pCMV6-IGFBP7。将质粒pCMV6-IGFBP7于37℃由限制性核酸内切酶Sgf I和Not I酶切过夜,经1%琼脂糖凝胶电泳后,采用DNA纯化试剂盒回收琼脂糖凝胶中pCMV6质粒片段,先用T4 DNA聚合酶将质粒片段末端平滑化,再经T4连接酶连接后即为空质粒pCMV6。
3.2 MCF-7细胞培养 用含10%胎牛血清的RPMI-1640培养基,于37℃、5%CO2培养箱中培养MCF-7细胞,每隔48 h更换1次细胞培养液。待MCF-7细胞覆盖瓶底达80%以上时,用0.125%胰蛋白酶消化传代。实验前更换为不含胎牛血清的RPMI-1640培养基继续培养24 h。
3.3 构建稳定表达IGFBP7的MCF-7细胞系 采用Effectene转染试剂盒将质粒pCMV6-IGFBP7和空质粒pCMV6分别转染入MCF-7细胞,置于37℃、5%CO2培养箱中培养6 h后用PBS洗去转染试剂,加入新鲜的培养基和G418(终浓度为0.5 g/L),继续培养2周,即可获得稳定转染子。
3.4 实验分组 实验分成4组,每组5个孔。Control组:正常培养的MCF-7细胞;empty组:稳定转染空质粒pCMV6的MCF-7细胞;IGFBP7组:稳定转染质粒 pCMV6-IGFBP7的 MCF-7细胞;PD98059组:经 PD98059(终浓度为10 μmol/L)作用72 h的MCF-7细胞。
3.5 软琼脂克隆形成实验 将1.2%低熔点琼脂糖与细胞培养基以1∶1的体积比混合制备0.6%的底层琼脂,注入6孔板中,每个孔1.4 mL,温室凝固备用。将细胞经胰酶消化后吹散成单个细胞悬液,调整细胞浓度至1×107/L。将0.6%低熔点琼脂糖与细胞培养基以1∶1的体积比混合,制备0.3%的上层琼脂,向每孔加1 mL上层琼脂和50 μL单细胞悬液(500 cells/well),混匀,室温凝固。置于37℃、5%CO2的细胞培养箱中培养3周,计数直径大于100 μm的克隆,计算克隆形成率(colony-forming efficiency,CFE),CFE(%)=克隆数/接种数 ×100%。
3.6 细胞周期检测 制备各实验组细胞悬液,用冷PBS洗涤细胞2次,加入1 mL 70%冰乙醇于4℃固定24 h,离心去除乙醇,再用冷PBS洗涤细胞2次,加入1 mL PI溶液(50 mg/L),4℃避光染色30 min,送流式细胞仪检测。
3.7 Western blotting 裂解各组细胞提取总蛋白。用Bradford法测定蛋白浓度。将总蛋白经SDSPAGE分离后转移至PVDF膜。将PVDF膜移入含有封闭液(5%脱脂奶粉)的平皿中,室温下封闭1 h后,分别加入Ⅰ抗(兔抗人 IGFBP7、ERK1/2、p-ERK1/2、 cyclin D1、 CDK4、 cyclin E、 CDK2、p21CIP1/WAF1、p27KIP1、p53、Rb 和 p - Rb 抗体),4 ℃ 过夜。加入Ⅱ抗(HRP标记的山羊抗兔IgG)室温下孵育1 h,TBST洗膜3次,加入ECL显色液显色。运用ImageJ软件测定条带灰度值,以p-Rb、p-ERK1/2条带分别与Rb、ERK1/2条带的灰度值之比衡量其的磷酸化水平,以 IGFBP7、cyclin D1、CDK4、cyclin E、CDK2、p21CIP1/WAF1、p27KIP1、p53 和 Rb 条带分别与内参照蛋白β-actin条带的灰度值之比代表其蛋白表达水平。
4 统计学处理
用SPSS 16.0统计软件进行分析。数据用均数±标准差()表示,多组间比较采用单因素方差分析(ANOVA),组间两两比较采用最小显著性差异法(LSD法)。以P<0.05为差异有统计学意义。
结 果
1 酶切质粒pCMV6-IGFBP7及制备空质粒
质粒pCMV6-IGFBP7经Sgf I和Not I酶切后,进行1%琼脂糖凝胶电泳,全自动凝胶成像系统检测显示,质粒pCMV6-IGFBP7长度为6 kb。酶切产生的pCMV6质粒片段和IGFBP7片段长度分别为4.9 kb和1.1 kb,与预期结果一致。空质粒为4.9 kb,见图1。
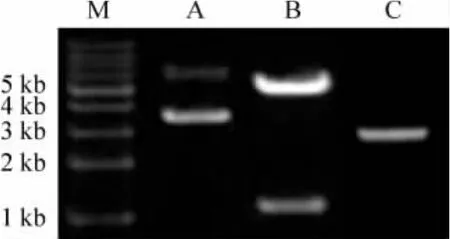
Figure1.Restriction endonuclease digestion of pCMV6-IGFBP7 and empty plasmid pCMV6.M:marker;A:pCMV6-IGFBP7;B:pCMV6-IGFBP7 digested by Sgf I and Not I;C:empty plasmid pCMV6.图1 质粒pCMV6-IGFBP7酶切结果与空质粒pCMV6
2 IGFBP7的表达
Western blotting结果显示,control组、empty组和PD98059组均不表达IGFBP7蛋白,稳定转染pCMV6-IGFBP7质粒的IGFBP7组MCF-7细胞高表达IGFBP7蛋白,表明稳定表达IGFBP7蛋白的细胞系构建成功,见图2。

Figure2.Expression of IGFBP7 protein in different groups.图2 IGFBP7蛋白在各实验组中的表达
3 软琼脂克隆形成实验
IGFBP7组细胞的CFE为2.92% ±0.36%,均显著低于其它各组(P<0.01)。PD98059组细胞的CFE为7.56% ±0.69%,显著低于control组(P<0.01)。Empty组CFE与control组相比无显著差异,见图3。
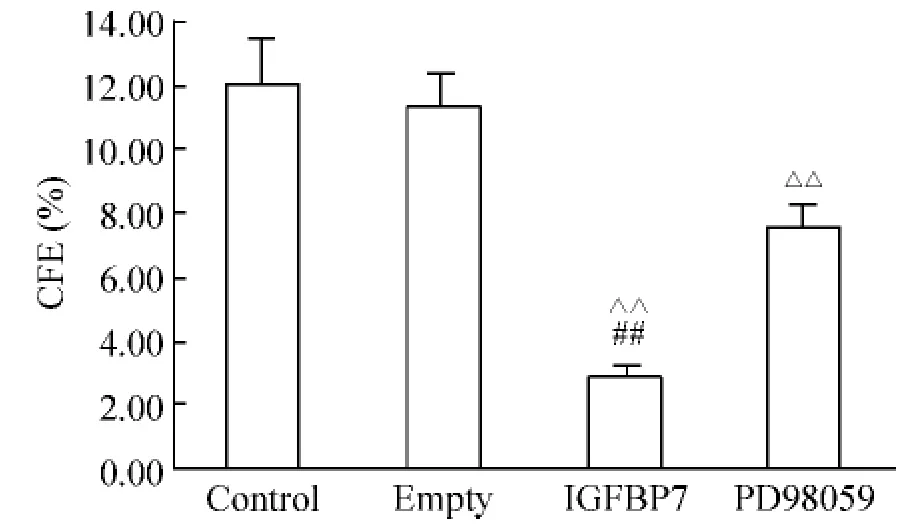
Figure3.Effect of IGFBP7 on colony-forming efficiency(CFE)of MCF-7 cells..n=5.△△P<0.01 vs control and empty groups;##P<0.01 vs PD98059 group.图3 IGFBP7对人乳腺癌MCF-7细胞克隆形成率的影响
4 IGFBP7对细胞周期的影响
IGFBP7组G0/G1期细胞比例为77.69% ±2.17%,显著高于其它各组(P<0.01),S期和G2/M细胞比例分别为13.66%±1.18%和8.65%±0.99%,均显著低于其它各组(P<0.01)。PD98059组G0/G1期细胞比例为66.03% ±2.04%,显著高于control组(P<0.01),但明显低于IGFBP7组(P<0.01),S期和 G2/M细胞比例分别为16.60% ±0.92%和17.37% ±1.12%,均显著低于 control组(P<0.05)。Empty组G0/G1期、S期和G2/M细胞比例与control组相比无显著差异,见图4。
5 IGFBP7对ERK磷酸化的影响
PD98059组p-ERK1/2与ERK1/2灰度比为0.0710±0.0059,均显著低于其它各组(P<0.01)。IGFBP7组p-ERK1/2与ERK1/2灰度比为0.2162±0.0168,明显低于 control组,见图5。
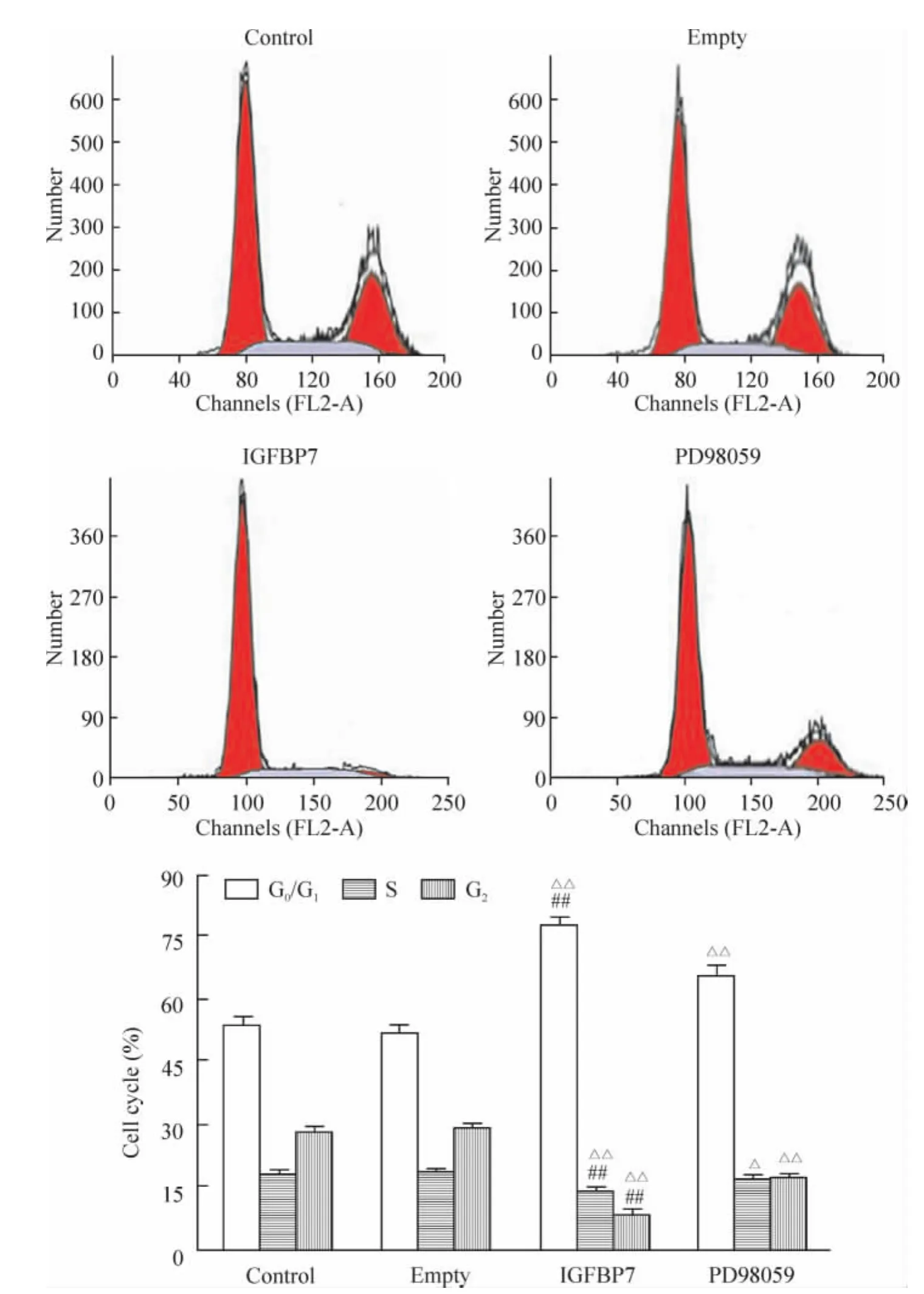
Figure4.Effect of IGFBP7 on cell cycle of MCF-7 cells measured by flow cytometry..n=5.△P<0.05,△△P<0.01 vs control and empty groups;##P<0.01 vs PD98059 group.图4 IGFBP7对人乳腺癌MCF-7细胞周期的影响
6 IGFBP7 对 cyclin D1、CDK4、cyclin E、CDK2、p27KIP1、p21CIP1/WAF1、p53、Rb 和 p -Rb 蛋白表达的影响
IGFBP7组 cyclin D1/β-actin的灰度比为0.4518±0.0267,显著低于 control组(P <0.01),但与PD98059组相比无显著差异,cyclin E/β-actin和p-Rb/Rb的灰度比分别为 0.4006±0.0161和0.1512±0.0095,显著低于其它各组(P<0.01),p27KIP1/β -actin、p21CIP1/WAF1/β -actin 和 p53/β -actin的灰度比分别为 0.8744±0.0317、0.9229±0.0316和0.9481±0.0341,显著高于其它各组(P<0.01)。PD98059组 p27KIP1/β-actin的灰度比为0.7332±0.0301,显著高于control组(P <0.01),p-Rb/Rb的灰度比为0.3315±0.0194,显著低于control组(P <0.01),cyclin E/β -actin的灰度比为0.8924±0.0304,与 control组相比无显著差异。Control组与empty组相比无显著差异。各组CDK4/β -actin、CDK2/β -actin和 Rb/β -actin的灰度比无显著差异,见图6、7。
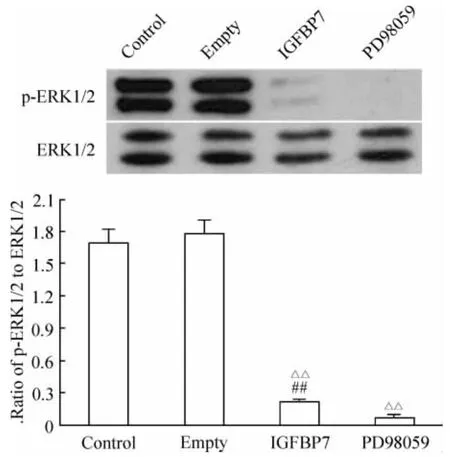
Figure5.IGFBP7 and PD98059 decreased the phosphorylation of ERK1/2..n=5.△△P<0.01 vs control and empty groups;##P <0.01 vs PD98059 group.图5 IGFBP7和PD98059抑制ERK1/2的磷酸化
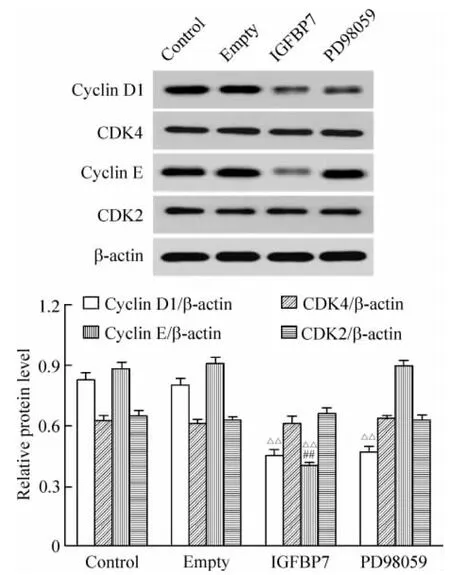
Figure6.Effects of IGFBP7 on expression of cyclin D1,CDK4,cyclin E and CDK2 in MCF-7 cells..n=5.△△P<0.01 vs control and empty groups;##P <0.01 vs PD98059 group.图6 IGFBP7对cyclin D1、CDK4、cyclin E和CDK2蛋白表达的影响
讨 论
RAS/RAF/MEK/ERK信号通路参与细胞增殖与分化、细胞形态维持、细胞骨架的构建、细胞凋亡和细胞恶变等多种生物学反应,是涉及调节细胞生长、分化及分裂信号网络的核心。大量来自生长因子、丝裂原、环境刺激等信号可激活 RAS/RAF/MEK/ERK信号通路,通过信号级联反应作用于核转录因子如AP-1、NF-кB等,调控基因表达。在许多人类的癌症(如口腔癌、黑色素瘤、乳腺癌等)中都可发现ERK1/2信号通路的过度激活[8-9]。本研究结果显示,人乳腺癌MCF-7细胞ERK1/2信号通路处于显著活化状态,而高表达IGFBP7可明显抑制ERK1/2磷酸化,这可能与IGFBP7上调RAF激酶抑制蛋白(Raf kinase inhibitor protein,RKIP)有关[10]。
细胞增殖是通过细胞周期来完成的。细胞周期是多因子参与的高度精确和有组织的时序调控过程。细胞周期素(cyclins)、细胞周期素依赖性激酶(cyclin-dependent kinases,CDKs)和细胞周期素依赖性激酶抑制剂(cyclin-dependent kinase inhibitors,CDKIs)是细胞周期调控中的关键组分。Cyclin D1和cyclin E属细胞周期素家族成员,可分别与CDK4和CDK2结合并激活其活性,调控细胞由G1期至S期的转变。Rb是cyclin D/CDK4和cyclin E/CDK2激酶的一种重要底物。高度磷酸化的Rb与E2F转录因子解离,使E2F得以活化,从而激活一系列下游事件,其中包括DNA的复制,使细胞从G1期进入S期。CDKIs根据结构和功能分为INK4家族和CIP/KIP家族。p21CIP1/WAF1和p27KIP1是CIP/KIP家族中的重要成员,它们可与G1/S期激酶复合物如cyclin D/CDK4和cyclin E/CDK2等紧密结合,抑制其活性,阻止细胞从 G1期进入 S期,过表达 p21CIP1/WAF1和p27KIP1均可使细胞停滞于 G1期[11-12]。
本研究发现,IGFBP7过表达既可显著抑制人乳腺癌MCF-7细胞cyclin D1和cyclin E的表达,又同时促进人乳腺癌 MCF-7细胞 p21CIP1/WAF1和p27KIP1蛋白表达,这样不仅可以减少cyclin D1/CDK4和cyclin E/CDK2激酶复合物的形成,还能有效抑制已形成的cyclin D1/CDK4和cyclin E/CDK2激酶复合物的活性,从而抑制了Rb磷酸化和E2F活化,最终阻止人乳腺癌MCF-7细胞从G1期进入S期。
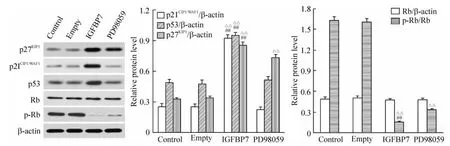
Figure7.Effects of IGFBP7 on expression of p21CIP1/WAF1,p27KIP1,p53,Rb and p-Rb in MCF-7 cells..n=5.△△P<0.01 vs control and empty groups;##P <0.01 vs PD98059 group.图7 IGFBP7对p21CIP1/WAF1、p27KIP1、p53、Rb和p-Rb蛋白表达的影响
本研究还发现,IGFBP7过表达可显著抑制ERK1/2信号通路的活化。为了探究ERK1/2信号通路是否参与了IGFBP7的细胞周期阻滞作用,在本研究中我们使用了MEK1/2抑制剂PD98059以观察ERK1/2信号通路对MCF-7细胞增殖的影响。结果发现,PD98059诱导了一些与IGFBP7相似的作用,如阻滞MCF-7细胞于G1期,下调cyclin D1和上调p27KIP1的表达。这提示IGFBP7可能是通过抑制ERK1/2信号通路的活化影响cyclin D1和p27KIP1的表达,然而IGFBP7对p21CIP1/WAF1和cyclin E的表达调控似乎与ERK1/2信号通路无关。
为了进一步探究IGFBP7对p21CIP1/WAF1的表达调控机制,我们观察了IGFBP7对p21CIP1/WAF1上游基因p53的表达影响。结果发现,IGFBP7可上调p53的表达。这提示IGFBP7可能是通过上调p53的表达进而促进p21CIP1/WAF1的表达。但IGFBP7对于cyclin E的调控机制目前尚不清楚,尚不排除IGFBP7作为转录调节因子直接调控cyclin E表达的可能。
综上所述,IGFBP7抑制人乳腺癌MCF-7细胞增殖的机制可能与其抑制ERK1/2信号通路,上调p53、p21CIP1/WAF1和 p27KIP1,下调 cyclin D1 和 cyclin E表达,抑制Rb磷酸化有关,但其具体机制还有待进一步的探讨。
[1]Kim HS,Nagalla SR,Oh Y.Identification of a family of low-affinity insulin-like growth factor binding proteins(IGFBPs):characterization of connective tissue growth factor as a member of the IGFBP superfamily[J].Proc Natl Acad Sci U S A,1997,94(24):12981 -12986.
[2]Akaogi K,Sato J,Okabe Y.Synergistic growth stimulation of mouse fibroblasts by tumor-derived adhesion factor with insulin - like growth factors and insulin[J].Cell Growth Differ,1996,7(12):1671 -1677.
[3]Oh Y,Nagalla SR,Yamanaka Y.Synthesis and charac-terization of insulin-like growth factor-binding protein(IGFBP)-7.Recombinant human mac25 protein specifically binds IGF - I and - II[J].Biol Chem,1996,271(48):30322-30325.
[4]Burger AM,Zhang X,Li H.Down-regulation of T1A12/mac25,a novel insulin-like growth factor binding protein related gene,is associated with disease progression in breast carcinomas[J].Oncogene,1998,16(19):2459-2467.
[5]Burger AM,Leyland-Jones B,Banerjee K.Essential roles of IGFBP -3 and IGFBP - rP1 in breast cancer[J].Eur J Cancer,2005,41(11):1515 -1527.
[6]Seth A,Kitching R,Landberg G.Gene expression profiling of ductal carcinomas in situ and invasive breast tumors[J].Anticancer Res,2003,23(3A):2043 -2051.
[7]Ivan B,Florence L,Sengul T.Molecular profiling of inflammatory breast cancer:identification of a poor-prognosis gene expression signature[J].Clin Cancer Res,2004,10(20):6789-6795.
[8]Davies H,Bignell GR,Cox C.Mutations of the BRAF gene in human cancer[J].Nature,2002,417(6892):949-954.
[9]von Lintig FC,Dreilinger AD,Varki NM,et al.Ras activation in human breast cancer[J].Breast Cancer Res Treat,2000,62(1):51 -62.
[10]Wajapeyee N,Serra RW,Zhu X.Oncogenic BRAF induces senescence and apoptosis through pathways mediated by the secreted protein IGFBP7[J].Cell,2008,132(3):363-374.
[11]Harper JW,Elledge SJ,Keyomarsi K.Inhibition of cyclin- dependent kinases by p21[J].Mol Biol Cell,1995,6(4):387-400.
[12]Toyoshima H,Hunter T.p27,a novel inhibitor of G1 cyclin - Cdk protein kinase activity,is related to p21[J].Cell,1994,78(1):67 -74.

