性发育异常患者的细胞分子遗传学分析*
滕奔琦,王青青,章 钧,李佩琼,郝秀兰,侯红瑛△
(1中山大学附属第三医院妇产科,广东 广州 510630;2广州医学院基础学院医学遗传学与细胞生物学教研室,广东 广州 510182)
性发育异常是一种先天遗传性异常,通常表现为染色体、性腺和性解剖结构不典型,一般发病率为1‰~3‰,根据其定义性发育异常可分为3个类型:性染色体、46,XX 和46,XY 发育异常[1-2],其发病机制不详。目前越来越多研究表明,性别的决定和分化,是由SRY(sex-determining region Y)基因主导,其它性别相关基因如编码转录因子的SOX9基因、DSS基因、DAX-1基因、NR5A1基因及编码细胞信号分子的WNT4基因、CYP21A2及CYP21A1P基因等多种基因共同参与和调控的复杂过程。本文分析了3例46,XX男性性反转综合征及1例女性假两性畸形患者的临床特点,并采用多重连接依赖的探针扩增(multiplex ligation-dependent probe amplification,MLPA)技术对患者 SRY、DSS、DAX1、WNT4、SOX9、NR5A1、CYP21A2等性别相关基因拷贝数进行筛查,最终采用荧光原位杂交技术(fluorescent in situ hybridization,FISH)进行基因定位,对性发育异常患者进行了细胞及分子遗传学研究,从遗传学角度进一步分析性发育异常机制。
材料和方法
1 临床资料
选取2010年12月份至2011年4月份来我院就诊的3例男性性反转综合征患者,临床均表现为无精子症、不育;染色体核型分析均为46,XX。1例女性假两性畸形患者,由于其已死亡,故选择其父母作为先证者进行性别相关基因分析。
2 方法
2.1 MLPA检测与分析
2.1.1 MLPA检测 采用SALSA P185-B2试剂盒(购自MRC Holland),SALSA试剂盒包括的探针包括:NR0B1、SRY、SOX9、DAX1、WNT4、NR5A1、CYP21A2、CYP21A1P及X、Y染色体特异性基因探针,有6个参考基因探针以检测不同的常染色体基因定位。MLPA操作过程按照说明书进行,50 ng DNA在98℃变性5 min,然后和SALSA探针混合物混匀;60℃杂交过夜后,用连接酶(Ligase-65)54℃连接15 min,再98℃孵育5 min终止反应,最后使用SALSA FAM PCR体系进行PCR扩增。取PCR产物1 μL应用ABI3100测序仪进行片段分析,每次反应均以正常男性标本作为对照,所得数据采用Gene-Marker 1.8软件进行处理,以正常男性的数据为对照,计算片段扩增或缺失的情况。
2.1.2 MLPA结果分析及确证方法 根据MLPA探针混合物中的引物序列捕获片段大小不一的DNA区域,通过毛细管电泳并检测,获得不同片段迁移的相对位置的图像和数据。GeneMarker 1.8软件通过对这些位置上出现的峰面积进行标化和对比,获得单个样本的每一个峰面积数值。患者待测基因拷贝数与正常男性基因拷贝数比较得出结果:当患者待检测基因位点存在时其峰值面积比介于0.75~3.00之间;当患者待检测基因位点不存在时,其峰值面积比小于0.75;当患者待检测基因存在双拷贝时,其峰值面积比大于 1.30[3]。
2.2 FISH探针制备及杂交 X、Y染色体购自Cytocell,分别为青色和绿色荧光。SRY基因FISH探针采用细菌人工染色体(bacterial artificial chromosom,BAC)克隆按照切口平移法标记红色荧光[4]。FISH细胞制片按照常规的方法进行,细胞标本经消化、低渗后进行固定,滴片数张,烤片2 h后经梯度乙醇脱水后在选定区域滴加0.01 mL的探针混合液、封片;将玻片置入杂交仪内,变性及杂交过夜;洗涤液洗涤后梯度乙醇脱水、DAPI复染、阅片。结果观察在荧光显微镜下进行,根据DAPI显带的情况判断染色体来源、上述信号位于染色体的位置。分别观察20组中期分裂相,判断红色、绿色与青色荧光信号的数目及所处的染色体[4]。
结 果
1 性反转综合征检测结果
3例性反转综合征患者社会性别均为男性,染色体核型均为46,XX,经MLPA基因筛查均发现存在单拷贝 SRY 基因,DSS、DAX1、WNT4、SOX9、NR5A1等性别相关基因数目未见异常。FISH技术鉴定存在2条X染色体,SRY基因易位于其中1条X染色体的短臂上。
2 女性假两性畸形检测结果
女性假两性畸形患者母亲及父亲临床表现无特殊,母亲染色体核型为46,XX,MLPA基因筛查发现CYP21A2-ex03杂合性缺失,CYP21A1P-ex02杂合性重复,DSS、DAX1、WNT4、SOX9、NR5A1 等性别相关基因未见异常;父亲染色体核型为46,XY,MLPA基因筛查发现CYP21A2-ex01和CYP21A2-ex03杂合性缺失,CYP21A1P-ex02和CYP21A1-ex10杂合性重复,DSS、DAX1、WNT4、SOX9、NR5A1 等性别相关基因未见异常。
3 MLPA检测结果
图1为46,XX男性性反转综合征患者MLPA的验证结果,图中可见Xq22、Xq13、Xp22和Xp11所对应片段在3100电泳图上的荧光峰面积分别为1.774、1.513、1.532 和 1.593,表示与正常男性对照相比,待测样本存在双拷贝X染色体,即XX;Yp11(SRY)所对应片段的荧光峰面积为0.930,表示与正常男性对照一致,不存在缺失或重复,即SRY(+);Yq11所对应片段的荧光峰面积为0.000,表示与正常男性对照该位点的荧光峰完全缺失;NR0B1基因的2个第一外显子所对应片段的荧光峰面积分别为1.778和1.798;第二外显子所对应片段的荧光峰面积为1.655,表示与正常男性对照相比,待测样本存在双拷贝片段。DSS、DAX1、WNT4、SOX9、NR5A1 等性别相关基因未见异常。

Figure1.MLPA results of one of 46,XX male sex-reversal syndrome.Blue signal stands for sample and red signal stands for normal control.Peaks at 145/235 nt stand for the first exons of NROB1,as well as peak at 310 nt stands for the second exon of NROB1.Peak at 228 nt stands for Xq22.Peak at 370 nt stands for Xp22.Peak at 424 nt stands for Xq13.Peak at 434 nt stands for Xp11.Peak at 163 nt stands for Yp11.Peak at 241 nt stands for Yq11.Arrows indicate differentiated peaks of the sample.图1 46,XX男性性反转综合征患者的MLPA检测结果
图2为女性假两性畸形患者母亲的MLPA验证结果,图中可见 CYP21A1P-ex02所对应片段在3100电泳图上的荧光峰面积为1.535,表示与正常女性对照相比,待测样本存在CYP21A1杂合性重复。CYP21A2-ex03所对应片段的荧光峰面积为0.512,表示与正常女性对照相比,待测样本CYP21A2基因杂合性缺失。DSS、DAX1、WNT4、SOX9、NR5A1 等性别相关基因未见异常。
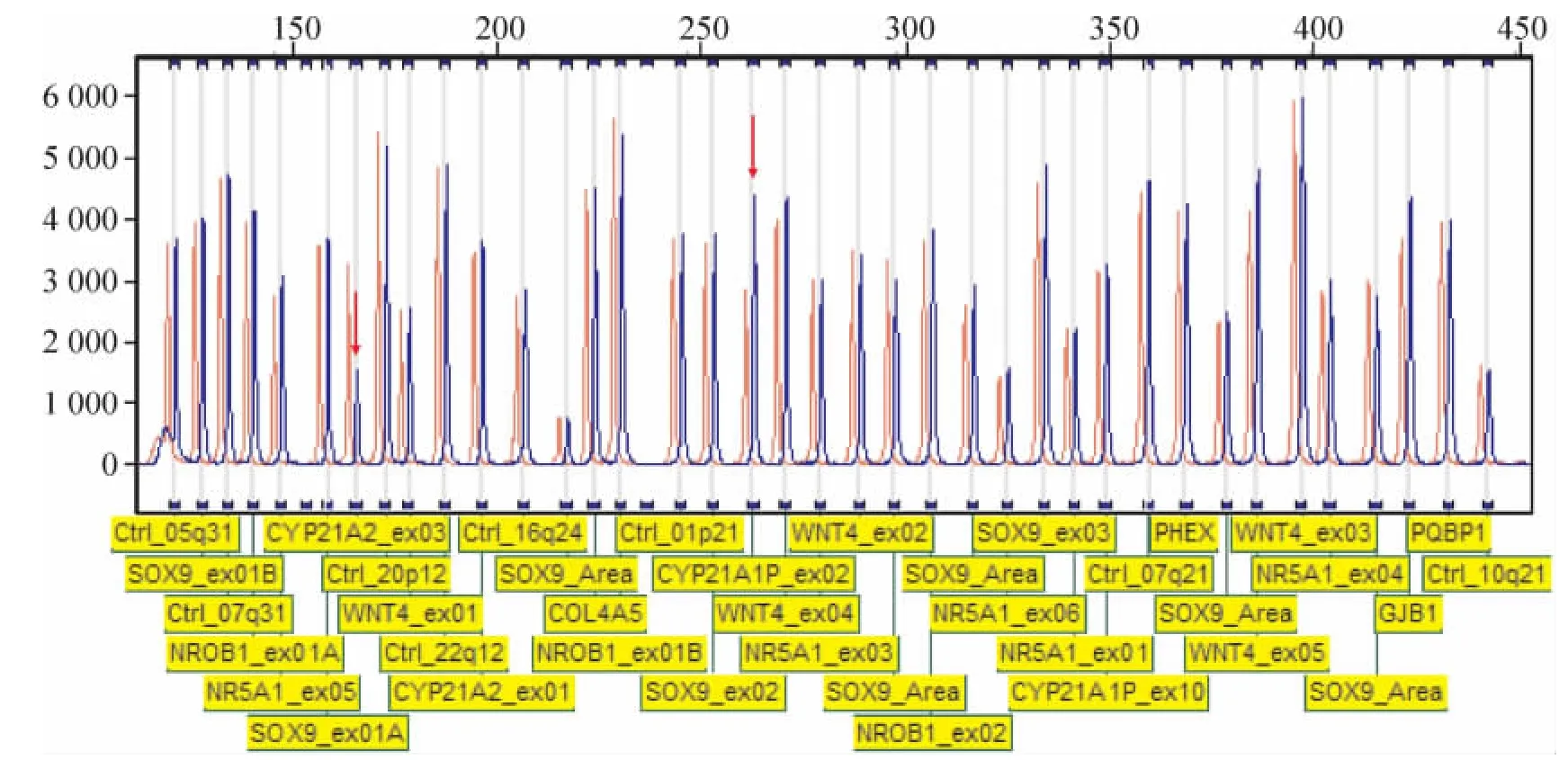
Figure2.MLPA results of the proband of female pseudoherma-phroditism.Blue signal stands for sample and red signal stands for normal control.Peak at 265 nt stands for the second exon of CYP21A1,as well as peak at 169 nt stands for the third exon of CYP21A2.Arrows indicate differentiated peaks of the sample.图2 女性假两性畸形母亲的MLPA验证结果
图3为女性假两性畸形患者父亲的MLPA验证结果,图中可见 CYP21A1P-ex02和 CYP21A1P-ex10所对应片段在3100电泳图上的荧光峰面积分别为1.685和1.501,表示与正常男性对照相比,待测样本存在CYP21A1P杂合性重复;CYP21A2-ex01和CYP21A2-ex03所对应片段的荧光峰面积分别为0.644和0.523,表示与正常男性对照相比,待测样本CYP21A2基因杂合性缺失。DSS、DAX1、WNT4、SOX9、NR5A1等性别相关基因未见异常。

Figure3.MLPA results of the husband of the proband of female pseudoherma-phroditism.Blue signal stands for sample and red signal stands for normal control.Peak at 265 nt stands for the second exon of CYP21A1,as well as peak at 351 nt stands for the tenth exon of CYP21A1.Peak at 200 nt stands for the first exon of CYP21A2,as well as peak at 169 nt stands for the third exon of CYP21A2.Arrows indicate differentiated peaks of the sample.图3 为女性假两性畸形父亲的MLPA验证结果
4 FISH结果
图4为其中1例46,XX男性性反转综合征患者的X/Y/SRY染色体图染分析FISH的验证结果,3例患者的中期细胞分裂相上均可以看到2条X染色体(绿色)及1条红色荧光探针信号,其中红色荧光探针信号与绿色的X染色体着丝粒探针位于同一条染色体上,从位置上判断其位于短臂上。

Figure4.FISH results of the probes of Y chromosome/SRY and X centromere.Centromere probes of X chromosome exhibit green fluorescence.Red signal stands for probe labeled from Y chromosome.图4 X/Y/SRY染色体FISH检测结果
讨 论
性分化与性发育是一个复杂的过程,人类性别分化主要是由性染色体决定的,其中Y染色体在性别决定中起主导作用,而睾丸分化又是性别决定的关键所在。研究表明SRY基因定位于Yp11.23,该基因的获得或缺失会引起性发育异常。但许多研究显示并不是每个性发育异常患者都能以SRY基因的存在或缺少、正常或异常来解释,性别决定是以SRY基因为主导,多个性别相关基因共同参与协调的结果。故常规检测SRY基因,并不能深入探讨性发育异常患者的发病机制[5]。以往只能应用PCR技术对单个性别相关基因逐一进行研究,本研究应用了MLPA技术,可在同一个反应体系中同时检测多个性别相关基因的拷贝数的变化,对其性别相关基因进行拷贝数筛查。本文在前人研究性发育异常发病机制基础上,对性发育异常患者先进行染色体核型分析鉴别染色体性别,之后利用MLPA技术在同一个反应体系中同时检测 SRY、DSS、DAX1、WNT4、SOX9、NR5A1、CYP21A2等性别相关基因拷贝数变化的优点,对其性别相关基因进行拷贝数筛查,然后选择异常基因片段进行荧光标记定位,进一步探讨性发育异常的发病机制。
1 46,XX男性性反转综合征
46,XX男性性反转综合征患者染色体核型为女性,但表型及性腺为男性,又称为De La Chapelle综合征,其发病率在男性中为 1∶20000 ~1∶25000[6]。在临床上可分为SRY基因阳性及SRY基因阴性患者,SRY基因阳性者约占85%~90%。关于46,XX男性性反转综合征可能的发病机制有多种学说,其中大多研究表明Xp-Yp易位假说占主导地位,即父系精子减数分裂过程中发生X-Y染色体末端异常交换(Xp-Yp易位),导致含SRY基因的X型精子产生,当其与卵子结合则可能导致子代46,XX男性产生。如本文3例患者MLPA检测到均含有2条X染色体,且性别决定基因 SRY(+),X/SRY FISH检测SRY基因定位在X染色体短臂末端,证实了Yp-Xp末端交换假说。目前,用分子杂交技术及PCR技术已证实了大部分46,XX男性患者某一X染色体末端存在Y染色体片段[7]。但是46,XX男性性反转综合征患者在临床表现上却有较大的异质性,SRY基因阳性者主要表现为青春期后不育、睾丸发育差等问题,但外生殖器发育正常,在青春期前与正常男性几无明显区别,故在青春期前不易被发现;SRY基因阴性者,其发病机制并不清楚,临床上主要表现为外生殖器异常,典型的表现为尿道下裂,可在出生后不久发现异常[8]。
2 女性假两性畸形
女性假两性畸形发病率约为1/40000,其核型为46,XX,性腺是卵巢,有子宫和阴道,外阴表现两性畸形。最常见原因为先天性肾上腺皮质增生(congenital adrenal hyperplasia,CAH),呈常染色体隐性遗传。其最主要的发病机制是21-羟化酶(21-hydroxylase,CYP21)基因突变引起肾上腺皮质无法将17-羟孕酮转化为皮质酮;后者合成减少时,对丘脑下部和垂体前叶的正常反馈消失,导致促肾上腺皮质激素增加而刺激肾上腺增生,使分泌的皮质酮趋于正常,同时也刺激肾上腺网状带产生大量雄激素,使女婴出现男性化表型,表现为女性假两性畸形,而男性则表现为性早熟[9]。由于本实验室此例患者已死亡,其母亲再次妊娠,现孕20周,来我实验室行产前诊断。对其父母进行性别相关基因检测,发现其母亲CYP21A2-ex03基因杂合性缺失,CYP21A1P-ex02基因杂合性重复;父亲CYP21A2-ex01和CYP21A2-ex03杂合性缺失,CYP21A1P-ex02和CYP21A1P-ex10杂合性重复。
在临床工作中如发现以生殖器发育异常、成年男性患者不育等为主诉的患者,不仅要进行SRY基因分析,还应该对其它性别相关基因如 SOX9、CYP21A1P、CYP21A2等进行分析,要在细胞遗传学检查的基础上,进行分子遗传学检测,有利于从基因水平揭示性别发育异常的原因,可为患者的临床诊断、治疗提供更好的依据。同时,产前诊断对于预防性发育异常缺陷儿的出生具有一定的意义,当产前超声与细胞遗传学结果不一致时,需对胎儿进行产前诊断。
[1]Jakubiczka S,Schröder C,Ullmann R,et al.Translocation and deletion around SOX9 in a patient with acampomelic campomelic dysplasia and sex reversal[J].Sex Dev,2010,4(3):143-149.
[2]Lee IW,Chou YY,Hsu KF,et al.Complex chromosome rearrangement 46,XY,der(9)t(Y;9)(q12;p23)in a girl with sex reversal and mental retardation[J].Urology,2011,77(5):1213-1216.
[3]侯红瑛,章 钧,范建辉,等.MLPA联合 FISH在DMD基因突变产前诊断中的价值探讨[J].中国病理生理杂志,2010,26(10):1895-1900.
[4]Varga Z,Gaspert A,Behnke S,et al.Tubular and endothelial chimerism in renal allografts using fluorescence and chromogenic in situ hybridization(FISH,CISH)technology[J].Pathol Int,2012,62(4):254-263.
[5]Villagómez DA,Lear TL,Chenier T,et al.Equine disorders of sexual development in 17 mares including XX,SRY-negative,XY,SRY-negative and XY,SRY-positive genotypes[J].Sex Dev,2011,5(1):16-25.
[6]Piccione M,Maresi E,Zollino M,et al.Sex reversal from functional disomy of Xp:prenatal and post-mortem findings[J].Am J Med Genet A,2008,146A(20):2681-2687.
[7]Queralt R,Madrigal I,Vallecillos MA,et al.Atypical XX male with the SRY gene located at the long arm of chromosome 1 and a 1qter microdeletion[J].Am J Med Genet A,2008,146A(10):1335-1340.
[8]Barbaro M,Balsamo A,Anderlid BM,et al.Characterization of deletions at 9p affecting the candidate regions for sex reversal and deletion 9p syndrome by MLPA[J].Eur J Hum Genet,2009,17(11):1439-1447.
[9]Choi JH,Jin HY,Lee BH,et al.Clinical phenotype and mutation spectrum of the CYP21A2 gene in patients with steroid 21-hydroxylase deficiency[J].Exp Clin Endocrinol Diabetes,2012,120(1):23-27.

