肥胖引起的线粒体功能及抗氧化异常促进小鼠卵母细胞排卵后老化*
李俐琳,任 姿,曾海涛,方 丛
(1中山大学附属第六医院生殖医学中心,广东 广州 510000;2广东省人民医院生殖医学中心,广东 广州 510080,3中山大学附属第三医院妇产科,广东 广州 510630)
随着生活水平的提高及生活方式的改变,全球肥胖症发生率迅速增加,并呈年轻化趋势。肥胖在多个方面影响着人类的生殖健康[1-2]。多数肥胖妇女存在与排卵异常相关的不孕症。另一方面,肥胖患者卵子内的物质和能量代谢也出现异常改变,对卵子质量产生不利影响。即使是进行辅助生育治疗的人群,肥胖患者促排卵时间、促性腺激素的使用量及因反应不良的周期取消率均增加,而获卵数目减少,此外肥胖可增加流产及多种产科合并症的发病率 [1-2]。
排卵后不及时受精,卵母细胞的生理生化反应活性将显著降低,这一现象称为卵母细胞的老化。卵母细胞老化表现为细胞内钙离子平衡失调、皮质颗粒外排、微管丢失、染色体不对称和松散分布、线粒体膜电位降低和基质膨胀等变化,是胚胎发育能力低下和早期流产的主要原因之一[3]。肥胖引起组织细胞代谢紊乱[4],导致ATP生成减少,机体活性氧类(reactive oxygen species,ROS)产生过多和(或)机体抗氧化能力下降,谷胱甘肽(glutathione,GSH)水平降低;ROS清除不足,导致ROS在体内增多并引起细胞氧化损伤的病理过程。这些提示肥胖患者卵母细胞存在能量和ROS代谢异常,导致排卵后卵母细胞老化加速,引起受孕能力减低,流产率增高[5]。本实验旨在研究肥胖对小鼠卵母细胞体内老化、体外受精和胚胎发育的影响及可能机制。
材料和方法
1 动物及主要试剂
动物DBA雄鼠和C57BL/6雌鼠购自北京实验动物中心,B6D2F1(C57BL/6*DBA)小鼠在本实验室繁殖获得。14周大小B6D2F1雌鼠随机分成2组,正常组给予普通饲料喂养,实验组每天自由采食高脂饲料[6],肥胖小鼠建模成功标准为:与正常饲养对照组比较,体重增加大于20%被认为营养性肥胖模型建立成功。孕马血清促性腺激素(pregnant mare serum gonadotropin,PMSG)和人绒毛膜促性腺激素(human chorionic gonadotropin,HCG)购自宁波制药厂,2',7'- 二氯二氢荧光素二乙酸酯(2',7'- dichlorodihydrofluorescein diacetate,DCFH -DA)购自 Molecular Probe,ATP和GSH检测试剂盒购自Promega,细胞凋亡与坏死检测试剂盒购自碧云天,其它试剂购自Sigma。采用HEPES-CZB液收集卵母细胞,CZB-G培养液进行体外培养。采用Vitro Research Media series(Cook Medical)进行体外受精和胚胎培养。
2 卵母细胞的收集及体外培养
B6D2F1雌鼠每只腹腔注射10 IU PMSG,48 h后腹腔注射10 IU HCG。分别于注射HCG 14、18和22 h后后断颈处死小鼠,收集输卵管中卵母细胞-卵丘颗粒细胞复合体。
3 卵丘颗粒细胞凋亡的检测
采用Hoechst 33342和碘化丙啶(propidium iodide,PI)双染的方法。实验按照试剂盒说明书进行,使用LSM-510激光共聚焦显微镜进行检测。
4 卵母细胞线粒体膜电位和ROS的检测
采用线粒体膜电位检测试剂盒(四氯四乙基苯并咪唑基羰花青碘化物,5,5',6,6'- tetrachloro - 1,1',3,3'- tetraethyl benzimidalyl carbocyanine iodide,JC-1)检查卵母细胞的线粒体膜电位。JC-1用DMSO溶解成1 mmol/L分装-20℃冻存,去除颗粒细胞的卵母细胞在37℃含1 μmol/L JC-1的培养液中培养15 min后进行检测。采用LSM-510激光共聚焦显微镜检测,红色荧光强度/绿色荧光强度的比值反映出线粒体的活性。去除颗粒细胞的卵母细胞在37℃、含10 μmol/L DCFH-DA的培养液中培养30 min后检测细胞中ROS水平。
5 卵母细胞ATP和GSH含量的检测
采用透明质酸酶去除颗粒细胞后,使用PBS收集卵母细胞,10 个卵母细胞∶10 μL PBS、50 个卵母细胞∶10 μL PBS分别用于检测卵母细胞中ATP和GSH水平,液氮中迅速冷冻后置于-80℃冻存。检测按照试剂盒说明书进行。
6 体外受精和胚胎培养
将成熟卵母细胞放入受精培养液中受精,置于37℃、5%CO2及饱和湿度的培养箱中培养6 h后,采用DAPI染色,如观察到有2个原核形成,并在卵周隙可看到1条精子尾,认为是正常受精。将正常受精卵再冲洗3次,移入用矿物油覆盖的、已平衡的20 μL胚胎培养液培养5 d,于第1 d和第5 d分别观察卵裂和囊胚形成。
7 统计学处理
实验重复3次,采用SPSS 11.0软件包进行统计学分析,数据以均数±标准差()表示,组间差异采用方差分析及卡方检验,以P<0.05为差异有统计学意义。
结 果
1 肥胖对排卵后卵丘颗粒细胞凋亡的影响
表1和图1A~F显示,注射HCG后,对照组和肥胖者的卵丘颗粒细胞的凋亡率无差别(P>0.05);注射HCG后18 h较注射HCG后14 h,2组卵丘颗粒细胞的凋亡率显著增加(P<0.05),其中肥胖组小鼠较对照组卵丘颗粒细胞的凋亡率增加显著(P<0.05);注射HCG后22 h较注射HCG后18 h,2组卵丘颗粒细胞的凋亡率均显著增加(P<0.05),其中肥胖组小鼠较对照组卵丘颗粒细胞的凋亡率增加更加明显(P<0.05),几乎达到后者的2倍。
表1 肥胖对排卵后卵丘颗粒细胞凋亡的影响Table1.The effect of obesity on the apoptosis of postovulatory cumulus cells(.n=3)
*P<0.05 vs control group;#P<0.05 vs the same group at 14 h;△P<0.05 vs the same group at 18 h.
Time(h) Group Apoptotic rate(%)14 Control 5.53 ±0.97 Obesity 6.91 ±1.0318 Control 7.19 ±1.72#Obesity 10.84 ±2.89*#22 Control 11.37 ±2.79△Obesity 18.50 ±3.86*△
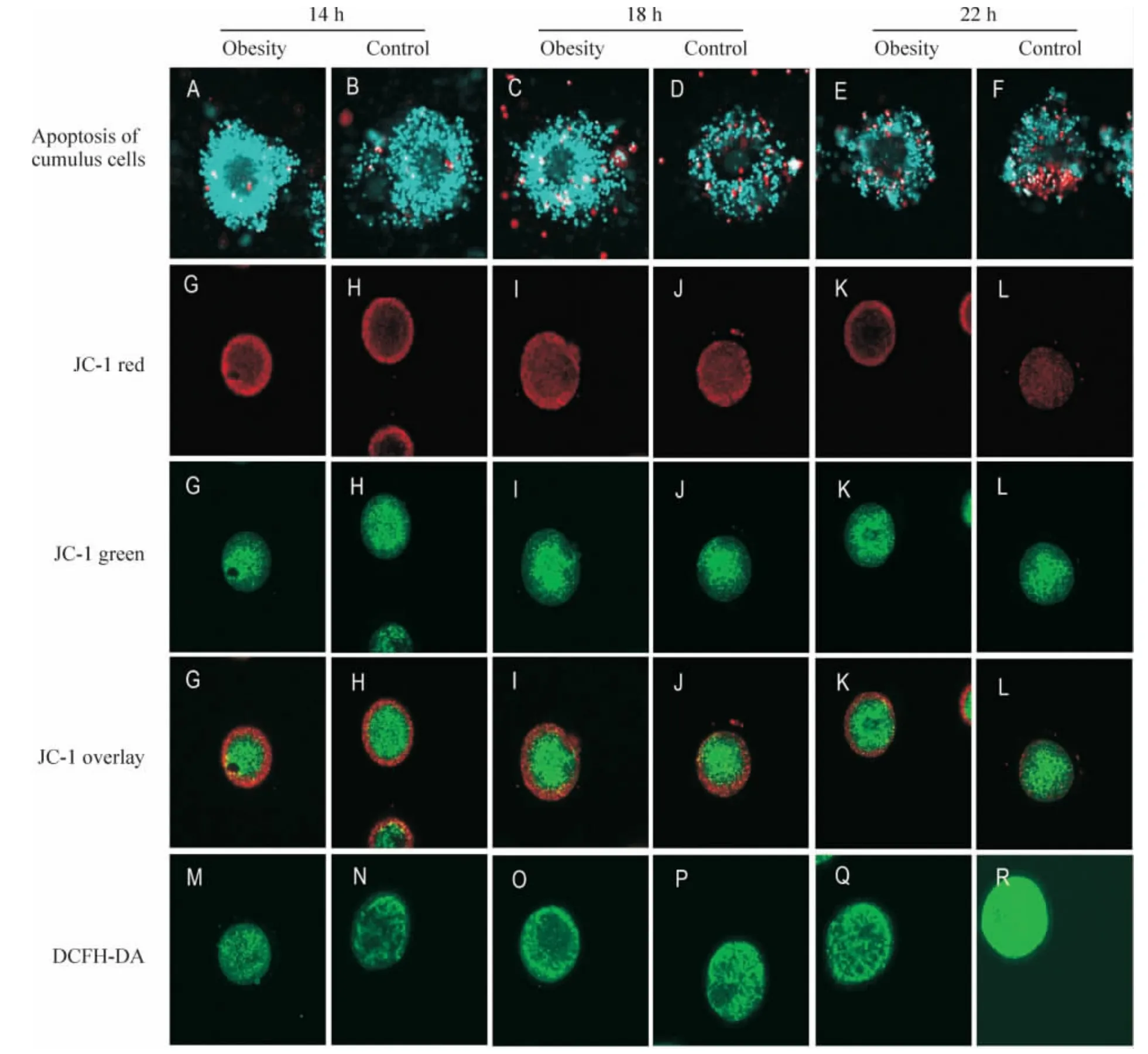
Figure1.Detection of apoptosis of cumulus cells,and mitochondrial membrane potential(MMP)and reactive oxygen species(ROS)levels in oocytes.A ~F:the cumulus-oocyte complexes(COCs)were stained by Hoechst 33342 and propidium iodide(PI).Cells with intact membrane fluoresced blue,whereas those with damaged membrane fluoresced red.G ~L:the potential-sensitive fluorescence dye JC-1 was used to measure the MMP.High MMP showed yellow-red fluorescence and the low one showed green fluorescence.M ~R:the COCs were stained by DCFH-DA for the ROS assay.图1 卵丘颗粒细胞凋亡、卵母细胞中线粒体膜电位和ROS水平的检测
2 肥胖对排卵后卵母细胞线粒体功能的影响
表2和图1G~L显示,注射HCG后14 h,卵母细胞线粒体膜电位及ATP含量在对照组和肥胖组均无显著差异(P>0.05);注射HCG后18 h较注射HCG后14 h,2组卵母细胞线粒体膜电位无差别,但肥胖组卵母细胞中ATP含量显著降低(P<0.05),其中肥胖组小鼠卵母细胞中ATP含量显著低于对照组(P<0.05);注射HCG后22 h较注射HCG后18 h,2组卵母细胞线粒体膜电位及ATP含量均进一步显著降低(P<0.05),其中肥胖组小鼠较对照组卵母细胞线粒体膜电位及ATP含量下降更加明显(P<0.05)。
表2 肥胖对排卵后老化卵母细胞线粒体膜电位及ATP含量的影响Table2.The effect of obesity on mitochondrial membrane potential(MMP)and ATP content in postovulatory aging mouse oocytes(.n=3)

表2 肥胖对排卵后老化卵母细胞线粒体膜电位及ATP含量的影响Table2.The effect of obesity on mitochondrial membrane potential(MMP)and ATP content in postovulatory aging mouse oocytes(.n=3)
*P<0.05 vs control group;#P<0.05 vs the same group at 14 h;△P <0.05 vs the same group at 18 h.
Time(h)Group MMP(red fluorescence/green fluorescence)ATP content(pmol/cell)14 Control 0.47 ±0.09 1.13 ±0.27 Obesity 0.44 ±0.12 1.17 ±0.2518 Control 0.48 ±0.11 1.16 ±0.22 Obesity 0.43 ±0.13 1.04 ±0.19*#22 Control 0.42 ±0.11△ 0.92 ±0.19△Obesity 0.35 ±0.12*△ 0.83 ±0.26*△
3 肥胖对排卵后卵母细胞ROS和GSH生成的影响
表3和图1M~R显示,注射HCG后14 h,对照组和肥胖组ROS水平无差别(P>0.05),肥胖组卵母细胞中GSH的水平显著低于对照组(P<0.05);注射HCG后18 h较注射HCG后14 h,对照组卵母细胞内ROS和GSH的水平无变化,而肥胖组卵母细胞内ROS的水平开始明显升高(P<0.05),GSH的水平显著降低(P<0.05);注射HCG后22 h较注射HCG后18 h,2组卵母细胞ROS和GSH的含量均进一步显著降低(P<0.05),其中和对照组比较,肥胖组小鼠卵母细胞ROS的水平升高更加明显(P<0.05),GSH的水平降低更加明显(P<0.05)。
4 肥胖对排卵后卵母细胞胚胎发育的影响
表4显示,注射HCG 14 h后,对照组和肥胖组的二细胞胚胎、囊胚形成率及囊胚细胞数均无显著差别(P>0.05);注射HCG后18 h,对照组和肥胖组的二细胞胚胎和囊胚形成率均无显著差别(P>0.05),而肥胖组囊胚的细胞数显著低于对照组(P<0.05),较注射HCG后14 h,肥胖组囊胚的细胞数显著减少(P<0.05);注射HCG后22 h,肥胖组囊胚的二细胞胚胎和囊胚形成率显著低于对照组(P<0.05),较注射HCG后18 h,2组卵母细胞二细胞胚胎和囊胚形成率均显著降低(P<0.05)。
表3 肥胖对排卵后老化卵母细胞ROS和GSH含量的影响Table3.The effect of obesity on ROS and GSH content in postovulatory aging mouse oocytes(.n=3)
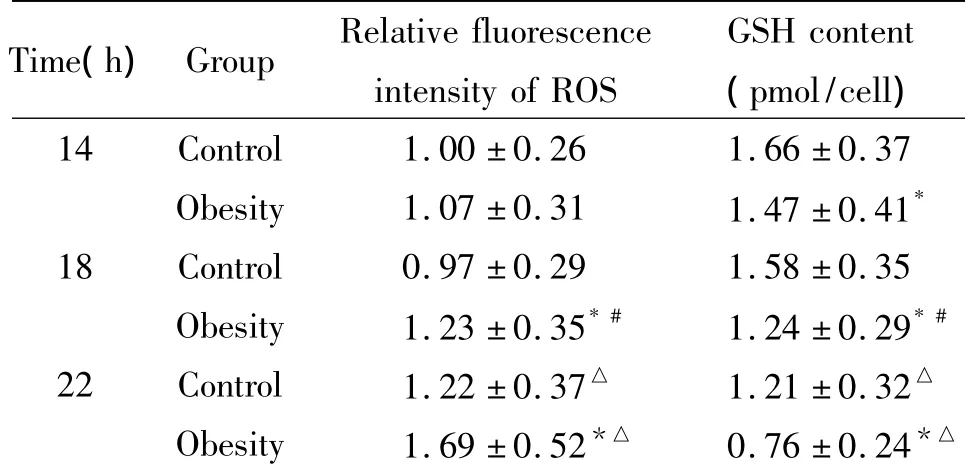
表3 肥胖对排卵后老化卵母细胞ROS和GSH含量的影响Table3.The effect of obesity on ROS and GSH content in postovulatory aging mouse oocytes(.n=3)
*P<0.05 vs control group;#P<0.05 vs the same group at 14 h;△P <0.05 vs the same group at 18 h.
Time(h)Group Relative fluorescenceGSH content intensity of ROS(pmol/cell)14 Control 1.00 ±0.26 1.66 ±0.37 Obesity 1.07 ±0.31 1.47 ±0.41*18 Control 0.97 ±0.29 1.58 ±0.35 Obesity 1.23 ±0.35*# 1.24 ±0.29*#22 Control 1.22 ±0.37△ 1.21 ±0.32△Obesity 1.69 ±0.52*△ 0.76 ±0.24*△
表4 肥胖对排卵后老化小鼠卵母细胞胚胎发育的影响Table4.The effect of obesity on embryonic development competence of postovulatory aging mouse oocytes fertilized in vitro(.n=3)

表4 肥胖对排卵后老化小鼠卵母细胞胚胎发育的影响Table4.The effect of obesity on embryonic development competence of postovulatory aging mouse oocytes fertilized in vitro(.n=3)
*P<0.05 vs control group;#P<0.05 vs the same group at 14 h;△P <0.05 vs the same group at 18 h.
TimeGroup Two-cell embryoBlastocystCell number of(h) formation rateblastocyst(%)(%)14 Control 96.1 85.7 61.8 ±8.4 Obesity 92.9 81.1 58.4 ±9.718 Control 94.6 83.9 64.7 ±8.9 Obesity 91.8 80.5 52.5 ±9.2*#22 Control 88.4△ 72.6△ 53.7±7.7△Obesity 76.3*△ 57.4*49.3±9.5
讨 论
营养性肥胖会影响女性生殖功能,降低受孕率。我们的研究表明,营养性肥胖促进小鼠排卵后的卵母细胞老化,卵母细胞受精及卵裂能力下降,其胚胎发育潜能明显降低,而对刚排卵的卵母细胞的胚胎发育潜能影响较小。这提示可能在体内,卵母细胞排出后,如未在排卵后4 h内受精,其胚胎质量较低,可能是营养性肥胖会影响女性生殖功能的主要原因。小鼠卵母细胞老化后进行体外受精,其受精率和胚胎发育率均降低。其它研究发现猪卵母细胞老化12 h受精率显著下降,异常受精率增加。对老化的猪卵母细胞核移植发现,激活1~2 h内核膜破裂率下降,囊胚数目减少[8]。小鼠类似的研究也证实了老化卵母细胞核移植后囊胚形成率明显降低[3,7]。
卵母细胞的老化是一个复杂的生理过程[3]。ROS是有氧代谢的产物,正常情况下ROS的产生和清除保持动态平衡[9],当这种平衡破坏而ROS过多时,就会影响卵母细胞成熟、受精、胚胎发育和妊娠等一系列生理过程[3]。我们的研究发现肥胖小鼠卵母细胞在体外老化的进程加快,细胞中ROS的水平在HCG注射后18 h就显著增加,而正常对照小鼠卵母细胞ROS在HCG注射后22 h才明显增加,而同时小鼠卵母细胞体外受精和胚胎发育潜能显著下降。其它研究用过氧化物处理新鲜和老化的卵母细胞,结果发现老化卵母细胞表现出高频率、低振幅的Ca2+波动,较低的受精率和囊胚率以及较高的胚胎碎片比例[3]。新鲜卵母细胞在低浓度H2O2下能加速老化进程[10]。
近年来研究表明线粒体内膜电位的下降,是凋亡发生的早期事件[11]。van Blerkom 等[12]证实,成熟卵的线粒体膜电位与年龄呈负相关,其胚胎发育潜力也随之降低。我们前期的研究发现未成熟卵的线粒体膜电位低,而成熟卵的线粒体膜电位高,且均匀分布在整个胞质[13]。发育潜能差的胚胎线粒体活性比发育潜能好的低,说明线粒体在卵和胚胎早期发育中起着重要的作用[12,14]。本研究结果显示,线粒体膜电位与卵母细胞的质量密切相关,与囊胚形成率呈正相关,提示卵母细胞线粒体内膜的完整性影响卵母细胞及胚胎的体外发育潜能。随着卵母细胞的老化,高浓度的活性氧对线粒体造成损伤,参与ATP代谢的相关基因表达水平下降,降低了产生ATP的能力[12]。我们的实验也证实,卵母细胞中ROS水平升高的同时,ATP的含量明显减少,其发育到囊胚的数减少。此外,其它研究还发现卵母细胞中ATP含量的减少会抑制蛋白质合成和其它功能[12]。GSH在卵母细胞中的主要功能是通过巯基基团参与抗氧化作用和抵抗ROS毒害作用来保护卵母细胞[15]。我们的研究也提示GSH浓度的高低对卵母细胞的成熟和受精是非常重要的,卵母细胞成熟期间GSH的积累能提高卵母细胞的胞质成熟质量,保护卵母细胞在受精后的胚胎发育阶段免受氧化损伤。
在肥胖诱导机体胰岛素抵抗、细胞能量代谢和抗氧化作用中,线粒体对脂肪酸的清除作用至关重要[16]。胞浆脂肪酸水平的进一步升高将导致线粒体功能障碍,同时细胞线粒体密度下降,ATP生成均明显减少。此外,肥胖患者细胞中超氧化物歧化酶(superoxide dismutase,SOD)活性下降。SOD作为机体内最广泛存在的一类金属抗氧化酶[17],能催化超氧阴离子自由基的歧化反应。因此细胞清除生命活动中产生的超氧离子的能力下降,ROS水平增加,诱导细胞凋亡。卵丘颗粒细胞是环绕在卵母细胞外的一种特殊体细胞,不仅在卵母细胞成熟、排卵和受精过程中有重要作用,而且对卵母细胞的老化也有影响[3]。我们的研究发现卵丘颗粒细胞在排卵后凋亡率逐渐增加,肥胖促进其凋亡发生。当机体存在肥胖的病理状态,颗粒细胞出现氧化应激代偿能力下降,抗氧化物质GSH等生成减少,同时自身大量的ROS释放入卵泡液中,严重影响了卵子的发育成熟[3]。可以推测,肥胖卵丘颗粒细胞的氧化应激降低了卵子的受精能力,导致了后续胚胎发育不佳。如前所述,颗粒细胞自身状态对卵子的发育影响较大。在肥胖的异常抗氧化状态下,颗粒细胞产生的过量ROS可直接导致自身凋亡,使得卵子失去颗粒细胞的保护及其它调节功能,进而损害卵子的发育。因此我们认为颗粒细胞氧化应激可通过凋亡影响卵子质量。除此之外,氧化应激还可能直接损害卵子质量。
本研究结果初步显示肥胖促进排卵后卵母细胞的老化,氧自由基对卵母细胞的损伤可能是引起母源老化不孕的重要原因。在对肥胖患者进行生殖健康宣教时,应突出在医生的指导下进行安全而有效的减肥和助孕治疗,把握排卵时机,选择排卵早期进行受精,避免卵子排卵后老化的影响,以提高受孕几率,减少流产发生。
[1]Moran LJ,Dodd J,Nisenblat V,et al.Obesity and reproductive dysfunction in women[J].Endocrinol Metab Clin North Am,2011,40(4):895-906.
[2]Ogbuji QC.Obesity and reproductive performance in women[J].Afr J Reprod Health,2010,14(3):143 -151.
[3]Miao YL,Kikuchi K,Sun QY,et al.Oocyte aging:cellular and molecular changes,developmental potential and reversal possibility[J].Hum Reprod Update,2009,15(5):573-585.
[4]Lumeng CN,Saltiel AR.Inflammatory links between obesity and metabolic disease[J].J Clin Invest,2011,121(6):2111-2117.
[5]Selesniemi K,Lee HJ,Muhlhauser A,et al.Prevention of maternal aging-associated oocyte aneuploidy and meiotic spindle defects in mice by dietary and genetic strategies[J].Proc Natl Acad Sci U S A,2011,108(30):12319 -12324.
[6]Glendinning JI,Breinager L,Kyrillou E,et al.Differential effects of sucrose and fructose on dietary obesity in four mouse strains[J].Physiol Behav,2010,101(3):331 -343.
[7]张国敏,周峥嵘,孙红艳,等.哺乳动物卵母细胞老化机制的研究进展[J].家畜生态学报,2012,33(1):9-13.
[8]Iwamoto M,Onishi A,Fuchimoto D,et al.Effects of caffeine treatment on aged porcine oocytes:parthenogenetic activation ability,chromosome condensation and development to the blastocyst stage after somatic cell nuclear transfer[J].Zygote,2005,13(4):335 -345.
[9]吴建宇,王淑秋,王柏欣,等.实验性2型糖尿病大鼠心肌线粒体的氧自由基损伤[J].中国病理生理杂志,2010,26(2):233-237.
[10]Goud AP,Goud PT,Diamond MP,et al.Reactive oxygen species and oocyte aging:role of superoxide,hydrogen peroxide,and hypochlorous acid[J].Free Radic Biol Med,2008,44(7):1295-1304.
[11]陈梦飞,陆大祥,戚仁斌,等.甘氨酸脂质体对心肌细胞线粒体膜电位及凋亡的影响[J].中国病理生理杂志,2008,24(7):1254-1258.
[12]van Blerkom J.Mitochondrial function in the human oo-cyte and embryo and their role in developmental competence[J].Mitochondrion,2011,11(5):797 -813.
[13]Zeng HT,Yeung WS,Cheung MP,et al.In vitro-matured rat oocytes have low mitochondrial deoxyribonucleic acid and adenosine triphosphate contents and have abnormal mitochondrial redistribution[J].Fertil Steril,2009,91(3):900-907.
[14]Zeng HT,Ren Z,Yeung WS,et al.Low mitochondrial DNA and ATP contents contribute to the absence of birefringent spindle imaged with PolScope in in vitro matured human oocytes[J].Hum Reprod,2007,22(6):1681 -1686.
[15]Hao ZD,Liu S,Wu Y,et al.Abnormal changes in mitochondria,lipid droplets,ATP and glutathione content,and Ca2+release after electro-activation contribute to poor developmental competence of porcine oocyte during in vitro ageing[J].Reprod Fertil Dev,2009,21(2):323 -332.
[16]Fresno M,Alvarez R,Cuesta N.Toll-like receptors,inflammation,metabolism and obesity[J].Arch Physiol Biochem,2011,117(3):151-164.
[17]Guo J,Chen Y,Yuan B,et al.Effects of intracellular superoxide removal at acupoints with TAT-SOD on obesity[J].Free Radic Biol Med,2011,51(12):2185 -2189.

