NO在脂联素抑制高脂血症大鼠血小板聚集中的作用*
樊 荣, 王文清, 李 榕, 张海锋
(第四军医大学 1基础医学部生理学教研室,2唐都医院血液科,陕西 西安 710032)
1000-4718(2012)10-1761-05
2012-04-20
2012-09-05
国家自然科学基金资助项目(No.81270401)
△通讯作者 Tel:029-84717724; E-mail:wangdacong@yahoo.com.cn
NO在脂联素抑制高脂血症大鼠血小板聚集中的作用*
樊 荣1, 王文清2△, 李 榕1, 张海锋1
(第四军医大学1基础医学部生理学教研室,2唐都医院血液科,陕西 西安 710032)
目的探讨一氧化氮(NO)信号转导通路在脂联素抑制高脂血症血小板聚集机制中的作用。方法采用成年大鼠饲以高脂饲料14周,分离其血小板并以重组脂联素(rAPN)孵育。采用免疫荧光、Western blotting等方法观察检测血小板聚集、NO含量、超氧化物含量、内皮型一氧化氮合酶(eNOS)/诱导型一氧化氮合酶(iNOS)的表达和抗氧化物活性。结果采用rAPN处理能抑制高脂血症诱导的血小板聚集(P<0.05),并导致血小板NO的生成显著减少。同时,在高脂血症血小板中,采用rAPN处理还能显著减少超氧化物的生成(降低62%,P<0.05) 并增强其抗氧化能力(增加38%,P<0.05)。此外,高脂血症诱导的eNOS磷酸化的降低和iNOS表达的增加在rAPN处理后被显著逆转(P<0.05,P<0.01)。结论脂联素是一种抑制高脂血症血小板聚集的脂肪细胞因子,其机制与减少超氧化物水平、增加抗氧化物活性和阻断iNOS的表达有关。
脂联素; 血小板; 高脂血症
代谢综合征(metabolic syndrome,MS)已成为20世纪以来严重危害人类健康的一大杀手。它可通过一系列代谢及血液动力学改变,包括内皮细胞损害及动脉粥样硬化,导致心血管疾病发生率显著增加。高脂血症,作为代谢综合征的一种主要临床征状,与动脉粥样硬化及血栓形成密切相关。 脂联素是一种主要由脂肪组织分泌的细胞因子,在血浆中含量丰富。大量研究表明脂联素是一种内源性的抗血小板聚集因子,其血浆水平的降低与血栓形成及心血管事件的高风险有关[1]。 目前脂联素抑制血小板聚集的机制仍很不清楚。血小板通过刺激众多信号转导途径而保证其在血管损伤部位的快速活化。同时,血小板可以产生一氧化氮(nitric oxide, NO)。大量研究表明,NO可通过刺激可溶性鸟苷酸环化酶(soluble guanylyl cyclase,sGC)以及下游的蛋白激酶G(protein kinase G,PKG)抑制血小板活化。然而,脂联素是否可通过调节NO的生成对血小板的活化聚集产生影响,从而抑制血栓形成及心血管事件的发生,至今尚无定论。 本研究旨在观察脂联素对高脂血症诱导的血小板聚集的影响,并进一步探讨了其作用机制是否与内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)/NO信号通路有关。
材 料 和 方 法
1动物与材料
20只雄性4周龄SD大鼠及高胆固醇饲料[配方:78.8%基础饲料、10%猪油,10%蛋黄粉、1%胆固醇及0.2%猪胆盐(参见中华人民共和国卫生部2003年颁布的保健食品检验与评价技术规范)],由第四军医大学实验动物中心提供。重组脂联素(recombinant full-length adiponectin, rAPN)购自BioVendor生物制品公司(Czech Republic)。抗氧化活性检测试剂盒购自南京建成生物工程研究所。抗p-eNOS、抗eNOS、抗诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)及抗β-actin抗体均购自Cell Signal。14周正常或高脂喂养后,动物以20%乌拉坦麻醉,采集腹腔静脉血,立即分离血小板。实验按以下方法进行。
2方法
2.1实验分组 实验分组为:正常对照大鼠血小板组,高脂血症血小板组,高脂血症血小板+rAPN组,高脂血症血小板+rAPN+ L-单甲基精氨酸(NG-monomethyl-L-arginine, L-NMMA)组等。
2.2血脂水平的测定 血浆胆固醇以及甘油三酯水平由生化检测仪(Cobas Integra 400 Plus, Roche)按相关操作规范进行。
2.3血小板分离 大鼠血小板的分离按以下方法进行[2]。腹腔静脉血使用柠檬酸(29.9 mmol/L 柠檬酸钠, 113.8 mmol/L 葡萄糖, 72.6 mmol/L 氯化钠,2.9 mmol/L 柠檬酸, pH 6.4)作为抗凝剂,富含血小板的血浆(platelet-rich plasma,PRP)以全血在200×g离心20 min获得,洗涤的血小板(washed platelets,WP)从PRP(含前列腺素E1, 50 μg/L)中800×g离心12 min获得。血小板调整密度为2×1011/L,在台氏液 (150 mmol/L NaCl, 5 mmol/L HEPES, 0.55 mmol/L NaH2PO4, 7 mmol/L NaHCO3, 2.7 mmol/L KCl, 0.5 mmol/L MgCl2, 5.6 mmol/L 葡萄糖, pH 7.4) 中备用。
2.4血小板聚集实验 血小板聚集实验采用改良的血小板比浊法进行[3],使用台氏液调整最小吸光度的基线。血小板聚集采用血小板聚集检测系统(PACKS-4型四通道血小板聚集仪,Helena)在持续恒定的搅拌状况下(900 r/min×6 min)以吸光度(A)评估的形式进行。大鼠 WP置于20孔培养板,在37 ℃下使用PBS或者10 mg/L rAPN,孵育1 h,加入凝血酶(1×103U/L) 1~5 min后血小板聚集时开始测定WP吸光值。一部分rAPN处理的血小板之前采用NOS抑制剂——L-NMMA(1 mmol/L)提前孵育10 min。每个处理组含有5孔血小板。聚集的百分率通过公式计算,以吸光度值衡量:聚集率(%)=(加凝血酶之前的A值-加凝血酶之后的A值)/( 加凝血酶之前的A值-台氏液的A值)×100%。
血小板聚集同时还用荧光显微镜以及免疫荧光检测,方法同前。血小板在25 ℃采用1%多聚甲醛固定30 min,涂片至载玻片上,包被的玻璃板使用PBS洗涤3次,异硫氰酸荧光素(fluorescein isothiocyanate,FITC)结合的兔抗鼠CD9单抗加入,37 ℃孵育 1 h,PBS洗涤4次。随后免疫荧光检测。对每个玻片随机选取10个视野,总计数100个血小板来确定聚集指数,采用盲法分析。
2.5总NO测定 血小板总NO的含量通过测定亚硝酸盐含量进行。血小板匀浆取上清液,按试剂盒要求,采用Griess呈色反应及比色方法测定NO含量[4],以NaNO2为标准品作标准曲线,用分光光度计测定吸光度(540 nm)并进行计算。正常及高脂血症大鼠的血小板采用rAPN (10 mg/L)或rAPN加L-NMMA进行。
2.6免疫印迹法检测eNOS 及iNOS的表达 血小板匀浆后,经Bradford法蛋白定量,取相同数量(50 μg)的蛋白样品进行SDS-PAGE,并电转移至PVDF膜上。滴加50 g/L脱脂奶粉封闭膜30 min,分别滴加1∶1 000工作浓度的抗p-eNOS、抗eNOS、抗iNOS或抗β-actin抗体孵育膜过夜。以工作浓度为1∶500的抗鼠或抗兔源性的IgG抗体于37 ℃孵育1 h,洗膜后用凝胶成像系统进行化学发光,采用LabImage软件分析数据。
2.7血小板抗氧化活性分析 血小板以0.9%氯化钠溶液超声溶解,3 000×g离心5 min,去除微粒,总抗氧化活性检测参照试剂盒说明书进行。30 μL的上清液加入含有黄嘌呤、黄嘌呤氧化酶和羟胺的反应缓冲液中,37 ℃孵育40 min,亚硝酸盐的含量采用Griess反应测定。血小板抗氧化活性与亚硝酸盐含量呈负相关。
2.8血小板超氧化物含量的测定 血小板超氧化物的测定采用流式注射化学发光法进行[5]。超氧化物含量以每微克蛋白的化学发光强度 [CI/(μg protein)]进行定量。
3统计学处理
结 果
1血脂水平
血浆总胆固醇和甘油三酯水平在高脂喂养大鼠中明显高于正常对照饮食组[总胆固醇:(2.0±0.1) mmol/Lvs(1.6±0.1) mmol/L,P<0.01;甘油三酯:(1.5±0.3) mmol/Lvs(1.1±0.3) mmol/L,P<0.05]。
2rAPN处理能抑制高脂血症诱导的血小板聚集
如图1所示,使用凝血酶处理5 min,与正常血小板相比,高脂血症能明显增加血小板聚集(P<0.01)。而提前使用rAPN预处理1 h则能明显减少高脂血症血小板的聚集(P<0.05)。在之前添加1 mmol/L L-NMMA能显著减弱rAPN对血小板聚集的抑制作用(P<0.01)。与正常血小板相比,高脂血小板表现出明显的聚集效应,rAPN处理后其聚集效应有所减低。加L-NMMA后,高脂血症血小板聚集又出现增强现象,见图2。另外,高脂血小板与对照组相比,表现出明显的聚集效应[(31±5)%vs(20±3)%,P<0.05],加rAPN后高脂血症血小板的聚集出现中等程度的减低[(31±5)%vs(25±3)%,P<0.05]。加L-NMMA后,血小板聚集又出现明显的促进效应[(25±3)%vs(56±7)%,P<0.01]。
3rAPN处理能降低高脂血症诱导的NO生成
尽管采用rAPN处理的血小板能明显降低高脂血症介导的血小板聚集,但此种处理减少而不是增加了总NO的生成(P<0.05), 见图3。结果表明还可能有更复杂的信号机制参与了rAPN对抗高脂血症诱导的血小板聚集。
4rAPN处理促进高脂血症血小板eNOS激活并降低iNOS的表达
在高脂血症血小板中,eNOS磷酸化水平与正常血小板相比显著降低(P<0.05),iNOS的表达则是显著增多(P<0.01)。高脂血症血小板rAPN预处理可使eNOS磷酸化水平显著升高(P<0.05), iNOS表达显著降低,即rAPN对p-eNOS和iNOS的表达具有反向调节作用,这种作用可能是rAPN明显抑制血小板聚集却减少总NO产生的重要原因,见图4。

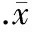
图1比浊法检测rAPN对正常及高脂血小板的聚集效应

Figure 2. Effect of rAPN on hyperlipidemia-induced platelet aggregation detected by immunofluorescence method.A:control;B:HL;C:HL+rAPN;D:HL+rAPN+L-NMMA.*P<0.05vscontrol;#P<0.05vsHL;△△P<0.01vsHL+rAPN.
图2免疫荧光法检测rAPN对高脂血症诱导的血小板的聚集效应

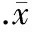
图3正常血小板与使用PBS、rAPN或rAPN+L-NMMA处理的高脂血小板总NO的生成
5rAPN处理能明显减少高脂血症血小板超氧化物的生成并提高抗氧化能力
高脂血症血小板超氧化物合成较正常血小板高出2.5倍,使用rAPN处理可明显减少高脂血症血小板超氧化物的水平(与PBS处理的高脂血症血小板相比,减少62%,P<0.05)。另外,rAPN处理后,可显著增加高脂血症血小板的抗氧化能力(与PBS处理的高脂血症血小板相比,增加38%,P<0.05),见图5。
讨 论
本研究中,我们观察到rAPN的急性处理能明显降低高脂血症诱导的血小板聚集。其次,我们提供了直接的证据表明抑制过氧化物的产生,抑制iNOS介导的NO的生成是脂联素发挥其抗血栓形成效应的主要机制。这些结果表明在代谢性疾病中,脂联素水平的减低有助于血栓的形成,并提供了rAPN临床应用的可能性,其可能是一种应用于动脉粥样硬化代谢性疾病的有效治疗因子。

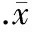
图4rAPN对正常及高脂血小板eNOS磷酸化以及iNOS表达的效应

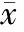
图5rAPN抑制高脂血症诱导的血小板超氧化物的过表达和抗氧化能力的降低
肥胖,代谢综合征以及动脉粥样硬化的紧密联系已经得到证实[6]。然而,肥胖促进血栓形成的机制仍不十分清楚。目前越来越多的注意力集中到来源于脂肪组织的血浆蛋白的直接抗血栓效应,特别是脂联素[7]。在糖尿病、代谢综合征以及冠状动脉疾病患者体内,观察到血浆脂联素的水平是降低的[8]。许多动物模型以及人体研究表明脂联素是一种重要的抗动脉粥样硬化分子,其减少可以导致血小板聚集及血栓形成[1,9]。本研究采取了不同的途径证实短时间的rAPN处理能显著减低高脂血症相关的血小板聚集。与我们的结果相比较,Riba等[2]认为重组的脂联素球形片段(gAd)而不是rAPN,可以通过酪氨酸激酶依赖的信号通路,刺激血小板聚集。造成这两个实验结果的差异可能是不同脂联素亚型通过不同的受体和/或各自独特的活化通路而对血小板的聚集产生了不同的效应。
研究表明rAPN通过其抗氧化特性抑制血小板聚集。首先,脂联素可以明显逆转高脂血症诱导的抗氧化活性的降低。由于抗氧化分子的增加或者氧化分子产生的减少能增强抗氧化活性,我们随后检测了脂联素对于超氧化物生成的效应,与Sanguigni等[10]的研究一致,我们发现高脂血症血小板超氧化物的生成增加, 而脂联素则可以显著抑制其产生。文献报道超氧化物和NO反应的速度比超氧化物和超氧化物歧化酶的反应速度快3倍[11]。前者的反应不仅能导致NO快速失活,促进白细胞及血小板聚集,也能产生过氧亚硝酸盐阴离子(ONOO-),一种高反应性和细胞毒性的分子[12]。因此这种过氧化物/NO反应是一种“毒性开关”,是血栓形成过程中的一个重要发病机制。
血小板中存在L-精氨酸-NOS-NO信号通路[13],越来越多的证据表明NO能抑制血小板聚集及活化[14]。既往在血小板内已表明血小板能够活化eNOS并增加NO合成[15-16]。有趣的是我们的结果表明尽管脂联素处理能够增加eNOS活性却减少NO合成。进一步研究发现高脂血症诱导iNOS的过表达,其可导致NO的过量生成,采用脂联素能抑制高脂血小板iNOS表达。同时在高脂血症时,NO和过量生成的超氧化物快速反应形成过氧化亚硝酸盐,一种NO的毒性代谢产物,能够导致血小板功能失调[17-18],以上实验结果表明脂联素抑制血小板活化可能是通过抑制NO的失活并通过抗氧化特性抑制伴随的过氧化亚硝酸盐的形成实现的。
[1] Ekmekci H, Ekmekci OB, Erdine S, et al. Effects of serum homocysteine and adiponectin levels on platelet aggregation in untreated patients with essential hypertension[J]. J Thromb Thrombolysis, 2009,28(4):418-424.
[2] Riba R, Hughes CE, Graham A, et al. Globular adiponectin induces platelet activation through the collagen receptor GPVI-Fc receptor gamma chain complex[J]. J Thromb Haemost,2008,6(6): 1012-1020.
[3] 张 梅, 余清声. 中华眼镜蛇毒F组份对血小板活化时蛋白酪氨酸磷酸化的影响[J].中国病理生理杂志,2005,21(2):293-295.
[4] Cosentino F, Hishikawa K, Katusic ZS, et al. High glucose increases nitric oxide synthase expression and superoxide anion generation in human aortic endothelial cells[J]. Circulation,1997, 96(1): 25-28.
[5] Yao D, Vlessidis AG, Gou Y, et al. Chemiluminescence detection of superoxide anion release and superoxide dismutase activity: modulation effect ofPulsatillachinensis[J]. Anal Bioanal Chem, 2004, 379(1): 171-177.
[6] Cooper-dehoff RM, Pepine CJ. Metabolic syndrome and cardiovascular disease: challenges and opportunities[J]. Clin Cardiol, 2007,30(12): 593-597.
[7] Goldstein BJ, Scalia R. Adiponectin: a novel adipokine linking adipocytes and vascular function [J]. J Clin Endocrinol Metab, 2004,89(6): 2563-2568.
[8] Ouchi N, Shibata R, Walsh K. Cardioprotection by adiponectin[J]. Trends Cardiovasc Med, 2006, 16(5): 141-146.
[9] Kato H, Kashiwagi H, Shiraga M, et al. Adiponectin acts as an endogenous antithrombotic factor[J]. Arterioscler Thromb Vasc Biol, 2006, 26(1): 224-230.
[10]Sanguigni V, Pignatelli P, Caccese D, et al. Increased superoxide anion production by platelets in hypercholesterolemic patients[J]. Thromb Haemost, 2002, 87(5): 796-801.
[11]Huie RE, Padmaja S. The reaction of no with superoxide[J]. Free Radic Res Commun, 1993,18(4): 195-199.
[12]Beckman JS, Koppenol WH. Nitric oxide, superoxide, and peroxynitrite: the good, the bad, and ugly[J]. Am J Physiol, 1996, 271(5 Pt 1): C1424-C1437.
[13]Sase K, Michel T. Expression of constitutive endothelial nitric oxide synthase in human blood platelets[J]. Life Sci, 1995, 57(22): 2049-2055.
[14]Gkaliagkousi E, Ritter J, Ferro A, et al. Platelet-derived nitric oxide signaling and regulation[J]. Circ Res, 2007, 101(7): 654-662.
[15]Chen H, Montagnani M, Funahashi T, et al. Adiponectin stimulates production of nitric oxide in vascular endothelial cells[J]. J Biol Chem, 2003, 278(45): 45021-45026.
[16]Li Z, Xi X, Gu M, et al. A stimulatory role for cGMP-dependent protein kinase in platelet activation[J]. Cell, 2003, 112(1): 77-86.
[17]Redondo PC, Jardin I, Hernndez-Cruz JM, et al. Hydrogen peroxide and peroxynitrite enhance Ca2+mobilization and aggregation in platelets from type 2 diabetic patients[J]. Biochem Biophys Res Commun, 2005, 333(3): 794-802.
[18]Olas B, Wachowicz B. Role of reactive nitrogen species in blood platelet functions[J]. Platelets, 2007, 18(8): 555-565.
Effectofnitricoxideonadiponectin-inducedinhibitionofplateletaggregationinhyperlipidemiarats
FAN Rong1, WANG Wen-qing2, LI Rong1, ZHANG Hai-feng1
(1DepartmentofPhysiology,SchoolofBasicMedicalSciences,2DepartmentofHematology,TangduHospital,FourthMilitaryMedicalUniversity,Xi’an710032,China.E-mail:wangdacong@yahoo.com.cn)
AIM: To investigate the mechanism that adiponectin inhibits platelet aggregation via nitric oxide (NO) signaling pathway.METHODSAdult rats were fed with normal or high-fat diet for 14 weeks. Their platelets were immediately isolated and treated with or without recombinant full-length adiponectin (rAPN). The platelet aggregation, NO and superoxide production, endothelial nitric oxide synthase (eNOS)/inducible NOS (iNOS) expression, and antioxidant capacity were determined.RESULTSTreatment with rAPN inhibited platelet aggregation induced by hyperlipidemia (P<0.05). Interestingly, total NO, a crucial molecule depressing platelet aggregate and thrombus formation, was significantly reduced, rather than increased in rAPN-treated platelets. Treatment with rAPN significantly decreased superoxide production by 62% (P<0.05) and increased antioxidant capacity by 38% (P<0.05) in hyperlipidemic platelets. Importantly, hyperlipidemia-induced reduction of eNOS phosphorylation and increase in iNOS expression were markedly reversed by rAPN treatment (P<0.05 andP<0.01, respectively).CONCLUSIONAdiponectin is an adipokine that inhibits platelet aggregation by enhancing eNOS activation and attenuating oxidative/nitrative stress including blockage of iNOS expression and superoxide production.
Adiponectin; Blood platelets; Hyperlipidemia
R363
A
10.3969/j.issn.1000-4718.2012.10.006

