TGF-β1/Smads 和ERK 表达异常在高盐饮食诱导的大鼠血管重构中的作用*
刘 婵, 商黔惠,△, 闵晓强, 陈剑玲, 毛万姮
(遵义医学院1临床医学研究所,2附属医院心内科,贵州 遵义563000)
高盐是导致心血管疾病发生的重要环境因素之一。流行病学调查发现每天多进食100 mmol/L NaCl 可增加脑卒中、冠心病及心血管疾病发生率[1]。长期高盐饮食不仅导致血压升高,而且有独立于血压之外的多重作用,可直接导致血管、心脏及肾脏等组织器官纤维化[2-4],但其机制尚未完全明了。转化生长因子β1(transforming growth factor β1,TGF-β1)被认为是最重要的细胞外基质调节因子之一,可促进细胞外基质沉积,抑制降解细胞外基质酶的活性[5],参与了包括高血压、血管成形术后再狭窄、动脉粥样硬化等心血管疾病的发病过程,与血管重构有着密切的关系。TGF-β1/Smads 信号通路是血管紧张素Ⅱ(angiotensin Ⅱ,Ang Ⅱ)、醛固酮(aldosterone,ALD)、炎症因子等所致器官纤维化的共同通路,调节成纤维细胞分化、增殖及胶原合成,TGF-β1通过其受体及下游的胞内效应分子Smad 蛋白家族实现调节细胞生物功能的细胞膜到细胞核的信息传递。高盐可使组织局部肾素- 血管紧张素系统(renin-angiotensin system,RAS)激活,诱导高血压大鼠动脉组织血管紧张素Ⅱ1 型(angiotensinⅡtype 1,AT1)受体密度和mRNA 表达增加、动脉壁增厚和胶原沉积[6-8]。已有研究表明,给予AngⅡ可促进肾脏,心脏TGF-β1的产生和激活,AT1受体拮抗剂(angiotensin receptor blocker,ARB)能抑制其过表达[9]。TGF-β1除通过Smad 通路,也通过介导细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)等通路传递信号至细胞核内[10]。Wang等[11]和Tharaux 等[12]证实ERK 阻断剂影响AngⅡ介导的Ⅰ型胶原合成从而缓解血管纤维化,TGF-β1介导的ERK 通路与血管重构关系密切,丝裂原激活蛋白激酶(mitogen-activated protein kinase,MAPK)超家族能通过与TGF-β1/Smads 通路的交互通话影响Smads 活性参与血管纤维化过程[13-14]。但TGF-β1/Smads 与ERK 信号通路在高盐饮食致血管重构中的作用及相互影响尚未完全明了。因此,本实验通过对TGF-β1/Smads 与ERK 信号通路中关键性信号分子表达的研究,进一步探讨高盐饮食引发血管重构的机制及ARB 干预的效应。
材 料 和 方 法
1 材料
雄性Wistar 大鼠由重庆第三军医大学大坪医院实验动物中心提供,许可证号为SCXK-(渝)2007-005;含NaCl 分别为0.5%和8%的颗粒饲料购自广东省医学实验动物中心,许可证号为SCXK-(粤)2008-0002;替米沙坦由海南赛力克药业有限公司惠赠;TGF-β1、磷酸化Smad2/3(phospho-Smad2/3,p-Smad2/3)和Smad7Ⅰ抗购自Santa Cruz,增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)和磷酸化ERK1/2 (phospho-ERK1/2,p-ERK1/2)Ⅰ抗购自武汉博士德生物技术有限公司,通用型免疫组化检测试剂盒(北京中杉金桥生物技术有限公司),浓缩型DAB 显色试剂盒(北京中杉金桥生物技术有限公司),Trizol 试剂购自Invitrogen,Qiagen RNeasy mini kit(Qiagen)。
2 方法
2.1 模型的建立及分组 Wistar 大鼠适应性饲养1周后,随机分为3 组:正常对照组(C 组)13 只,高盐模型组(M 组)24 只,替米沙坦干预组(T 组)13 只。C 组饲以正常盐饲料(0.5%NaCl),M 组饲以8%高盐饲料,T 组饲以8%高盐饲料,同时给予替米沙坦灌胃,替米沙坦起始剂量2 mg/kg,随后根据血压情况每2 周调整1 次剂量,使血压尽量控制在正常范围内,替米沙坦最大剂量至40 mg/kg。各组大鼠均在相同标准环境下饲养,自由饮用自来水,饲养24周。
2.2 血压测定 用BESN-Ⅱ多通道动物无创测压仪测量大鼠尾动脉压,每只大鼠测量3 次,取其平均值作为该大鼠该次的尾动脉压。大鼠适应性饲养1周后开始测压,作为基础压,随后每2 周测量1 次。实验结束后测定大鼠颈总动脉压。根据实验终末尾动脉压与基础压的比较及颈动脉压水平,将M 组分为模型高血压组(MH 组)12 只和模型血压正常组(MN 组)12 只,共饲养24 周。高血压大鼠判定标准:处理后血压增加20 ~30 mmHg 并>120 mmHg[15]。
2.3 HE 染色 组织经固定24 h 后,进行脱水、透明及石蜡包埋。脱蜡至水→苏木素染液3 ~4 min→自来水(流水)冲洗30 s→1%盐酸乙醇分化返兰2 ~3 s→自来水(流水)冲洗5 ~10 min→伊红染液2 min→自来水(流水)冲洗30 s →95%乙醇数秒→95%乙醇数秒→无水乙醇数秒→烤箱烤干,60 ℃3 ~5 min→中性树胶封片。统一在400 倍的显微镜下观察并拍片,每个标本选取5 个横切面,用Image Pro- Plus 6.0 图像分析系统测量主动脉和肠系膜动脉中膜厚度(media thickness,MT)(按顺时针方向测5 个值取均值)。
2.4 Masson 染色 取主动脉、肠系膜动脉一级分支固定24 h 后,进行脱水、透明及石蜡包埋。Masson染色步骤:石蜡切片脱蜡至水→苏木素染液7 min→流水冲洗→1%盐酸酒精分化→流水冲洗→丽春红酸性复红染色5 min→0.5%冰乙酸冲洗→1%磷钼酸数秒→0.5%冰乙酸冲洗→2%亮绿染色1 min →烤箱烤干(60 ℃3 ~5 min)→中性树胶封片。Masson染色使胶原纤维呈绿色,肌纤维和弹力纤维呈红色。每个标本随机取5 个视野,拍照记录。用Image-Pro Plus 6.0 软件进行分析,测量血管胶原容积分数(collagen volume fraction,CVF),CVF 为胶原面积与记录区域总面积的比值,每个标本取5 个视野的均值作为其结果。
2.5 主动脉Smad2、Smad3 和Smad7 实时荧光定量
PCR 用Trizol 试剂提取大鼠主动脉中膜总RNA,随后按Qiagen RNeasy Mini Kit 说明书对RNA 进行纯化,紫外分光光度计测定样本在260 和280 nm 的吸光度值(A260和A280),所得A260/A280在1.80 ~2.20之间认为纯度符合要求。配置40 μL 50 mg/L RNA逆转录液,逆转录合成cDNA 后,进行PCR 反应。结果以目的基因/β-actin 的比值进行统计分析。
2.6 免疫组化染色检测主动脉和肠系膜动脉PCNA、p-ERK1/2、TGF-β1、p-Smad2/3和Smad7 表达 主动脉、肠系膜动脉石蜡切片常规脱蜡至水,3%过氧化氢封闭10 min,然后进行抗原修复,检测TGF-β1和Smad7 的切片置入装有柠檬酸盐缓冲液(pH9.0)的微波盒中,微波中火修复12 min,取出微波盒自然冷却至室温;检测PCNA、p-ERK1/2 和p-Smad2/3 的切片放入装有柠檬酸盐缓冲液(pH 6.0)的高压锅中,修复90 s,关闭电源,冷却15 min后放气,打开锅盖,自然冷却至室温,取出玻片置于湿盒中,PBS 冲洗3 次,每次3 min,将组织周围的水擦干,滴加Ⅰ抗将整个组织覆盖(Ⅰ抗的浓度:PCNA 1∶100,p-ERK1/2 1∶50,TGF-β11∶100,p-Smad 2/3 1∶50,Smad7 1∶50),4 ℃冰箱过夜,将湿盒从冰箱取出,室温下复温20 min,PBS 冲洗,滴加Ⅱ抗聚合物,37 ℃孵育30 min,PBS 冲洗,滴加Ⅱ抗37 ℃孵育30 min,PBS 冲洗,DAB 显色,镜下控制反应时间,流水冲洗10 min,苏木素复染3 ~5 min,流水冲洗10 min,梯度乙醇脱水,二甲苯透明,中性树胶封片。使用Leica DM2500 光学显微镜照相记录图片,每张切片在固定的曝光时间、固定的光圈数和固定的显微镜亮度情况下,400 倍镜下进行图片的采集。利用Image-Pro Plus 6.0 图像分析软件,校正好光密度,随机对每个标本的5 幅图片进行分析平均吸光度(胞浆表达)或阳性细胞表达率(胞核表达),每组分析6 个标本。平均吸光度计算方法:即主动脉或肠系膜动脉中膜中阳性染色的积分吸光度(IA)与其动脉中膜面积的比值;阳性细胞表达率计算方法:即主动脉或肠系膜动脉中膜中阳性染色细胞核的数量与其动脉中膜总细胞核数量的比值。
3 统计学处理
应用SPSS 13.0 统计软件进行数据处理。计量数据用均数±标准差(±s)表示,两两比较采用t 检验;多组间比较采用方差分析,方差齐使用LSD 法,方差不齐使用Tamhane’s T2 法,以P <0.05 为差异有统计学意义。
结 果
1 大鼠血压和主动脉、肠系膜动脉中膜厚度变化
实验结束后,与C 组、MN 组和T 组相比,MH 组尾动脉收缩压和颈动脉平均压明显升高,差异有统计学意义(P <0.05),其余各组之间比较无统计学差异。TMH 组和MN 组主动脉和肠系膜动脉MT 与C组相比显著增高(P <0.05),T 组MT 降低(P <0.05),MH 组和MN 组比较无统计学差异,见表1。
表1 各组大鼠血压及主动脉、肠系膜动脉中膜厚度比较Table 1. The comparison of blood pressure and media thickness(MT)of aorta and mesenteric artery in various groups(±s)

表1 各组大鼠血压及主动脉、肠系膜动脉中膜厚度比较Table 1. The comparison of blood pressure and media thickness(MT)of aorta and mesenteric artery in various groups(±s)
C:control group;MH:high-salt model with hypertension group;MN:high-salt model without hypertension group;T:high-salt + telmisartan group. * P <0.05,**P <0.01 vs C;#P <0.05,##P <0.01 vs T;△P <0.05 vs MN.
Group n Systolic blood pressure(mmHg)Carotid blood pressure(mmHg)Aorta MT(μm)Mesenteric artery MT(μm)12±7.20 MH 12 161.21±21.65* #△ 145.82±5.84* #△ 115.29±16.25**## 71.87±15.93* #MN 12 123.25±11.20 125.04±6.16 103.22±7.98* # 63.75±2.23* #T 13 126.37±7.23 121.60±11.07 80.95±10.89 50 C 13 123.97±6.39 118.12±8.33 84.91±11.61 52..75±6.12
2 各组大鼠主动脉和肠系膜动脉HE 染色和Masson 染色
与对照组相比,MH 组和MN 组主动脉、肠系膜动脉中膜细胞层数增加,细胞核数量增加,平滑肌细胞排列紊乱,弹性膜弯曲、紊乱,T 组这些现象均明显减轻,见图1。
主动脉、肠系膜动脉中膜血管平滑肌细胞胞浆呈红色,胶原纤维呈绿色,细胞核呈棕紫色。与C 组比较,MH 组和MN 组中膜胶原容积分数显著增高(P <0.01);T 组主动脉和肠系膜动脉中膜胶原容积分数显著低于MH 和MN 组(P <0.01);MH 组与MN 组间比较无统计学意义(P >0.05),见图2。
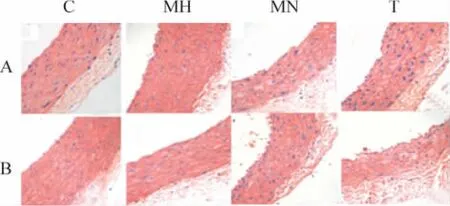
Figure 1. HE staining of aorta (A)and mesenteric artery (B)in various groups (×400).图1 各组大鼠主动脉和肠系膜动脉的HE 染色
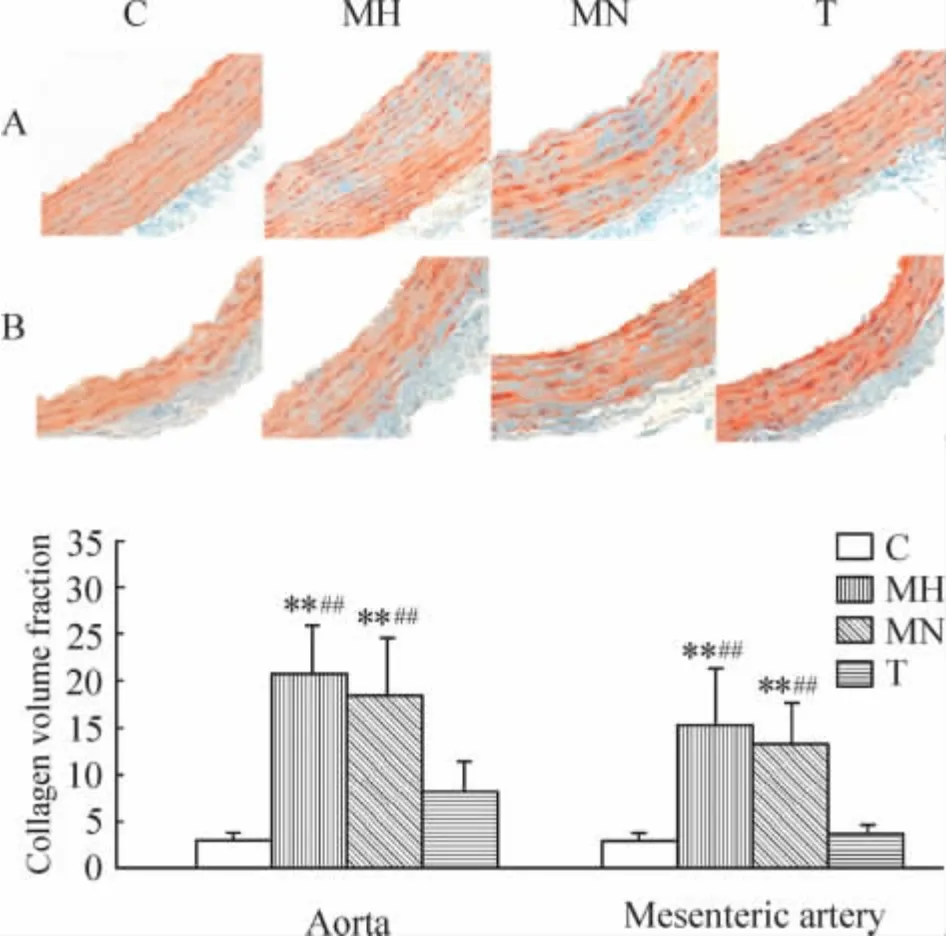
Figure 2. Masson staining of aorta (A)and mesenteric artery(B)in various groups (×400). ± s. n =5. **P <0.01 vs C;##P <0.01 vs T.图2 各组大鼠主动脉和肠系膜动脉Masson 染色
3 各组大鼠主动脉、肠系膜动脉PCNA 蛋白表达
免疫组化图片显示血管中膜平滑肌细胞中PCNA 蛋白被染成棕黄色,在胞核内表达。与C 组比较,MH 组和MN 组主动脉和肠系膜动脉中膜PCNA表达增高(P <0.05),表明主动脉和肠系膜动脉中膜血管平滑肌细胞(vascular smooth muscle cells,VSMCs)增殖;经替米沙坦干预后,PCNA 表达下降;与MN 组相比,MH 组表达无显著差异,见图3。
4 各组大鼠主动脉TGF-β1、Smad2、Smad3 及Smad7 mRNA 的表达情况
通过real-time PCR 检测大鼠主动脉中膜TGF-β1、Smad2、Smad3 及Smad7 mRNA 的表达,结果发现:与C 组比较,MH 组和MN 组主动脉的TGF-β1和Smad2 mRNA 表达增高(P <0.05),MN 组Smad3表达降低(P <0.05),MH 组Smad7 表达升高(P <0.05);经替米沙坦干预后,TGF-β1、Smad2 及Smad7 mRNA 表达下降(P <0.05);与MN 组相比,MH 组Smad3 和Smad7 mRNA 表达较高(P <0.05),而TGF-β1和Smad2 表达无显著差异,见图4。
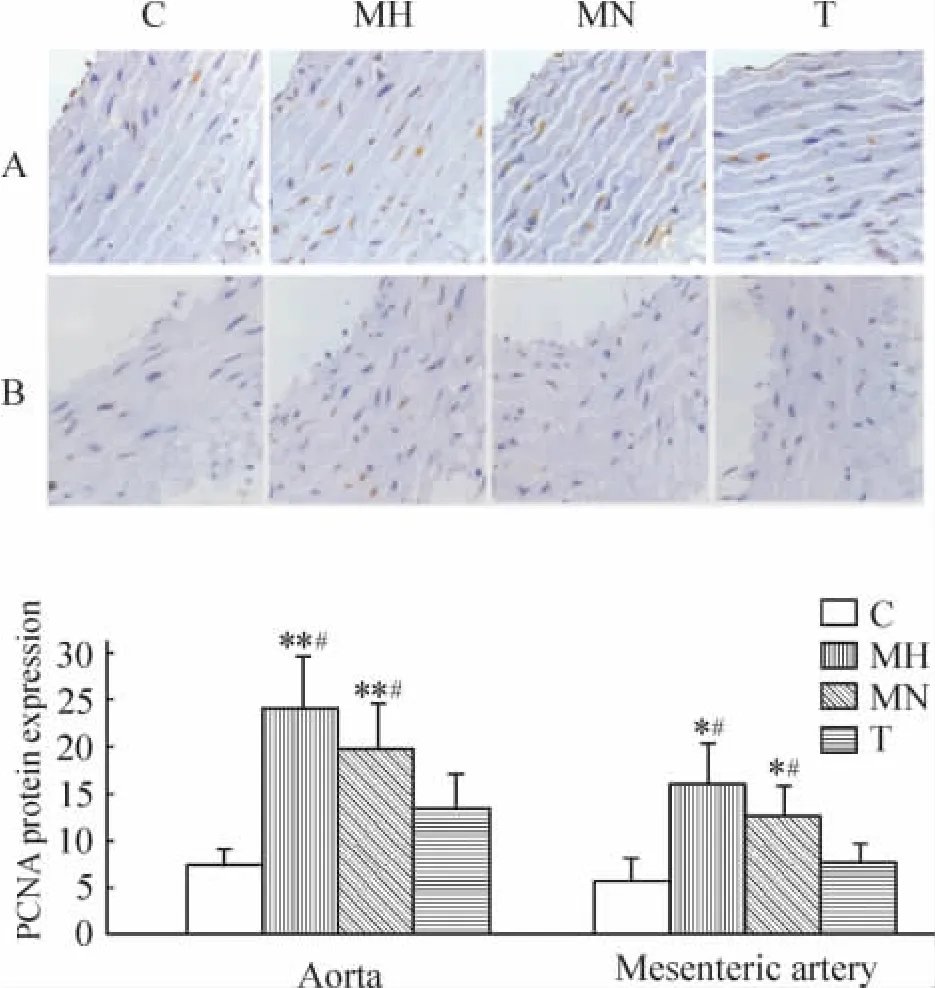
Figure 3. Immunohistochemical staining showed the expression of PCNA in aorta (A)and mesenteric artery (B). ±s.n =6. * P <0.05,** P <0.01 vs C;#P <0.05 vs T.图3 免疫组化染色显示主动脉和肠系膜动脉中PCNA 的表达
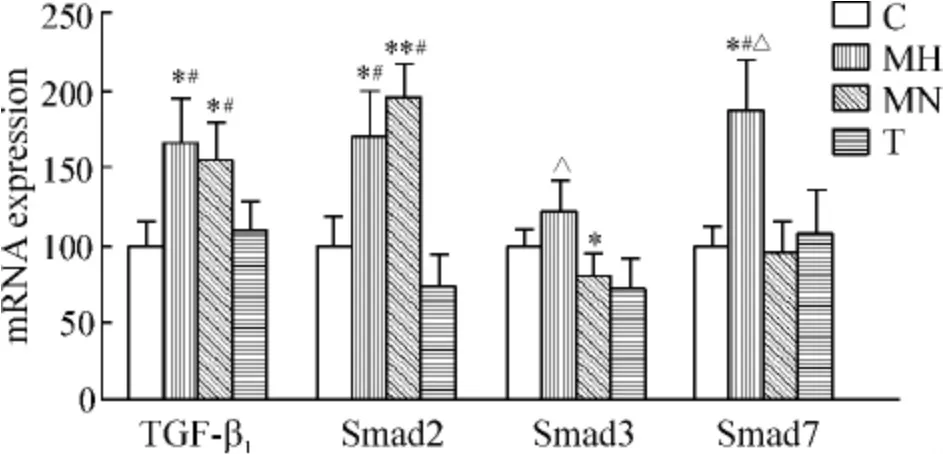
Figure 4. The expression of TGF-β1,Smad2,Smad3 and Smad7 mRNA in aorta from various groups. ±s.n =8. * P <0.05,**P <0.01 vs C;#P <0.05 vs T;△P<0.05 vs MN.图4 各组大鼠主动脉中TGF-β1、Smad2、Smad3 和Smad7 mRNA 的表达
5 各组大鼠主动脉和肠系膜动脉TGF-β1、p-Smad2/3、Smad7 和p-ERK1/2 蛋白表达情况
免疫组化图像可见血管中膜平滑肌细胞中TGF-β1蛋白呈棕黄色表达在胞浆内,p-Smad2/3 蛋白呈棕黄色在胞核内表达,Smad7 蛋白在胞核及核周围均有棕黄色表达。与C 组比较,MH 组和MN 组主动脉中膜的TGF-β1、p-Smad2/3 和p-ERK1/2 表达增高(P <0.05),而Smad7 表达减少(P <0.05);经替米沙坦干预后,TGF-β1、p-Smad2/3 和p-ERK1/2 表达下降,Smad7 表达上升(P <0.05);与MN 组相比,MH 组TGF-β1表达较高(P <0.05),Smad7 表达较低(P <0.05),而p-Smad2/3 和p-ERK1/2 表达无显著差异,见图5、表2。

Figure 5. Immunohistochemical staining showed the expression of TGF-β1,p-Smad2/3,Smad7 and p-ERK1/2 in aorta (×400)图5 免疫组化染色显示主动脉中TGF-β1、p-Smad2/3、Smad7 和p-ERK1/2 的表达
表2 各组大鼠主动脉中膜TGF-β1、p-Smad2/3、Smad7和p-ERK1/2 阳性表达百分比Table 2. The percentages of the positive expression of TGF-β1,p-Smad2/3,Smad7 and p-ERK1/2 in rat aorta from various group (±s.n=6)
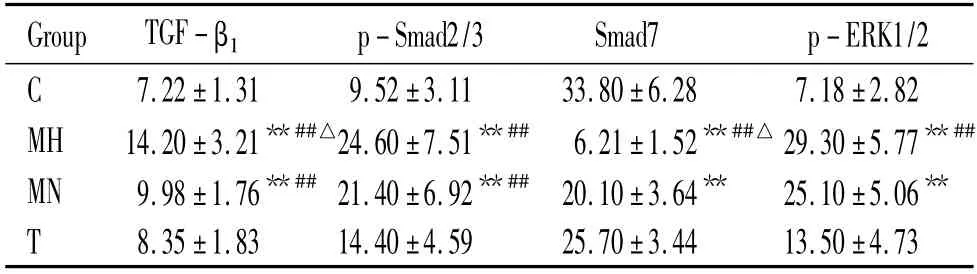
表2 各组大鼠主动脉中膜TGF-β1、p-Smad2/3、Smad7和p-ERK1/2 阳性表达百分比Table 2. The percentages of the positive expression of TGF-β1,p-Smad2/3,Smad7 and p-ERK1/2 in rat aorta from various group (±s.n=6)
**P <0.01 vs C;##P <0.01 vs T;△P <0.05 vs MN.
Group TGF-β1 p-Smad2/3 Smad7 p-ERK1/2 C 7.22±1.31 9.52±3.11 33.80±6.28 7.18±2.82 MH 14.20±3.21**##△24.60±7.51**## 6.21±1.52**##△29.30±5.77**##MN 9.98±1.76**## 21.40±6.92**## 20.10±3.64** 25.10±5.06**T 8.35±1.83 14.40±4.59 25.70±3.44 13.50±4.73
与C 组比较,MH 组、MN 组肠系膜动脉中膜的TGF-β1、p-Smad2/3 和p-ERK1/2 表达增高(P <0.01),Smad7 表达下降(P <0.01);经替米沙坦干预后,TGF-β1、p-Smad2/3 和p-ERK1/2 表达下降,Smad7 表达升高(P <0.01);与MN 组相比,MH 组TGF-β1表达较高(P <0.05),p-Smad2/3 有升高趋势(P >0.05),但无显著差异,而Smad7 和p-ERK1/2 表达无显著差异(P >0.05),见图6,表3。
讨 论
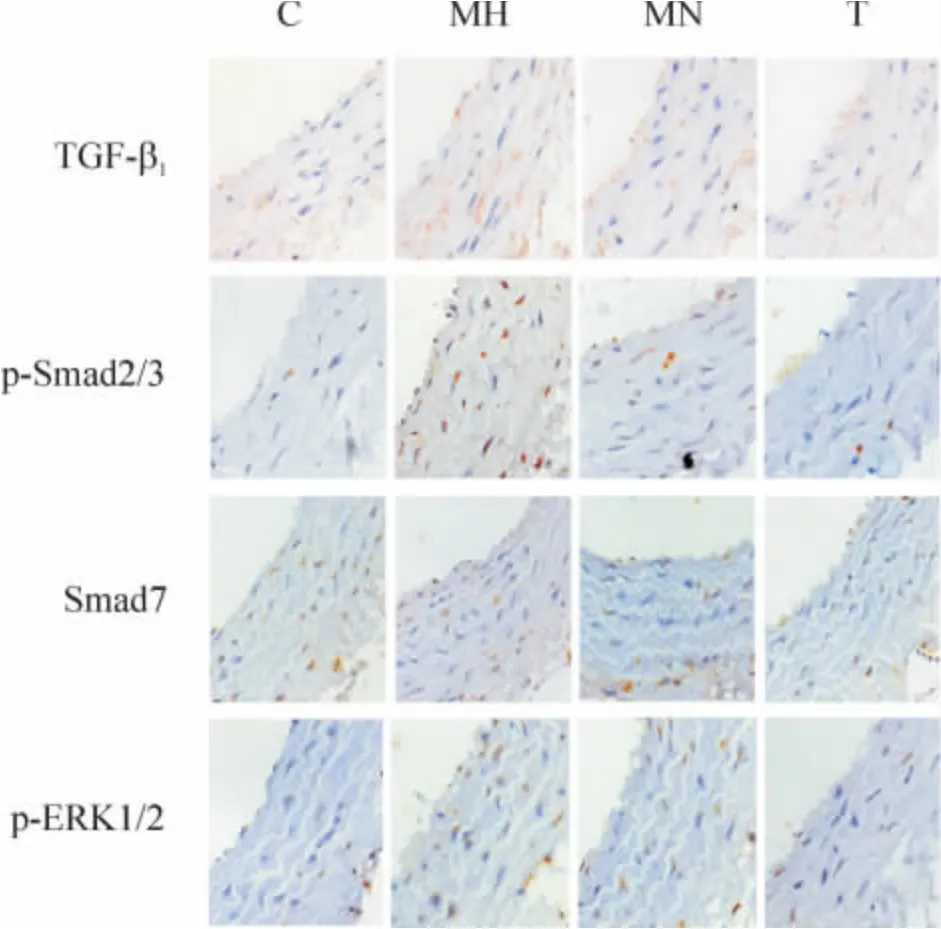
Figure 6. Immunohistochemical staining showed the expression of TGF- β1,p-Smad2/3,Smad7 and p-ERK1/2 in mesenteric artery (×400).图6 免疫组化染色显示肠系膜动脉中TGF-β1、p-Smad2/3、Smad7 和p-ERK1/2 的表达
表3 各组大鼠肠系膜动脉中膜TGF-β1、p-Smad2/3、Smad7 和p-ERK1/2 阳性表达百分比Table 3. The percentages of the positive expression of TGF-β1,p-Smad2/3,Smad7 and p-ERK1/2 in rat mesenteric artery from various groups (±s.n=6)

表3 各组大鼠肠系膜动脉中膜TGF-β1、p-Smad2/3、Smad7 和p-ERK1/2 阳性表达百分比Table 3. The percentages of the positive expression of TGF-β1,p-Smad2/3,Smad7 and p-ERK1/2 in rat mesenteric artery from various groups (±s.n=6)
**P <0.01 vs C;##P <0.01 vs T;△P <0.05 vs MN.
Group TGF-β1 p-Smad2/3 Smad7 p-ERK1/2 C 4.34±0.90 6.21±0.85 23.30±3.51 8.34±3.59 MH 10.40±2.01**##△29.80±6.21**## 14.60±3.25**## 21.60±3.84**##MN 8.95±1.98**## 25.40±4.97**## 14.20±3.13**## 18.10±3.99**##T 5.72±1.83 16.10±3.32 20.50±4.04 12.50±3.76
在高血压等病理状态下,VSMCs 功能发生改变,细胞由收缩表型向合成表型转变,细胞合成与分泌功能增强,导致细胞外基质含量增加,成分改变,尤其是胶原堆积,是导致血管重构的重要原因之一。慢性盐负荷可通过血压或独立于血压影响血管及心脏的结构和功能,增加心血管疾病的发生率和死亡率。7%NaCl 高盐饲养自发性高血压大鼠(spontaneously hypertensive rats,SHR)4 个月,其血压升高幅度较正常盐饲养的SHR 明显增大,血管明显增厚,弹性纤维和胶原纤维增多[16];用高盐喂养(8% NaCl)盐敏感性高血压大鼠后,其主动脉和肠系膜动脉管壁也明显增厚[17];Simon 等[10]研 究发 现高盐(2%NaCl)饮食虽不能引起SD 大鼠血压升高,但却可以引起血管明显的重构现象,故推测高盐饲养可直接致血管重构,而血压升高并非主要因素。目前国内外研究主要针对于盐敏感性高血压大鼠、SHR 及部分肾切除盐敏感性大鼠,而本实验以无遗传易感性或解剖生理学缺损的正常Wistar 大鼠为研究对象,给予长期(6 个月)高盐(8% NaCl)饲养后,无论大鼠是否形成高血压,均发生主动脉和肠系膜动脉中膜厚度增加,VSMCs 增殖,层数增多,排列紊乱,胶原纤维沉积,说明长期高盐饮食可以独立于血压导致正常Wistar 大鼠血管重构。
Smads 蛋白家族是TGF-β1信号转导途径中参与胞内信号转导或调节的重要分子。TGF-β 与受体结合后,使其下游信号通道蛋白Smad2 分子和Smad3 分子磷酸化,进而与Smad4 蛋白形成复合物,活化的复合物转移到核内与其它同时合成的核转录因子相互作用调节相关基因的转录。Smad2/3 是TGF- β1致纤维化作用的主要信号转导蛋白,而Smad7 是TGF-β1/Smads 信号转导通路中的主要抑制性调控蛋白,可抑制TGF- β1激活的Smad2/3 磷酸化和核转位,从而对TGF- β1信号转导通路起负反馈抑制作用,降低TGF-β1信号的强度和持续时间[14]。Smad7 过度表达还能明显减少血管外膜胶原含量,延缓球囊成形术后血管纤维化过程[18],提示Smad7 可以延缓血管纤维化过程。本实验结果显示,高盐模型组主动脉TGF-β1、Smad2、Smad3 及Smad7 mRNA 水平均较对照组升高,这与有关文献[19]报道在肝纤维化初期,TGF-β1可促进Smad7 mRNA 升高,但抑制作用仍不足以拮抗由Smad2 和Smad3 mRNA 升高所产生的肝纤维化进展的结论相符合;与正常盐对照组相比,高盐模型组TGF-β1及下游分子p-Smad2/3 蛋白表达上升,Smad7 蛋白表达减少,提示高盐饮食可以促进血管中膜TGF-β1和p-Smad2/3 表达,抑制Smad7 表达,TGF-β1/Smad 信号通路可能参与调控高盐所致大鼠血管重构过程。此外,有研究发现血浆TGF-β1水平升高与高血压的发生密切相关[20],我们的研究观察到,模型高血压组主动脉和肠系膜动脉TGF-β1表达高于模型正常血压组,提示TGF-β1在高盐诱导血压升高过程中发挥一定作用;模型高血压组主动脉Smad7 表达低于模型正常血压组,模型高血压组肠系膜动脉p-Smad2/3 蛋白表达较模型正常血压组有升高趋势。TGF-β1效应的发挥主要与TGF-β1和受体调节性Smad2/3 或抑制性Smad7 结合有关[21],在主动脉Smad7 表达减少,对TGF-β1信号转导途径起负反馈作用,增高TGF-β1信号的强度和持续时间,而在肠系膜动脉TGF-β1通过Smad2/3 使得信号转导路径激活,提示TGF-β1在主动脉和肠系膜动脉分别通过调节Smad7 和Smad2/3 表达共同参与高盐致高血压的发生发展。
TGF-β1激活的信号通路主要有以下几种,Smads 通路、MAPK 通路、NF-κB 通路、磷脂酰肌醇3-激酶/蛋白激酶B(phosphatidylinositol 3-kinase/protein kinase B,PI3K/Akt)通路等。MAPK 超家族包括3 个亚家族:p38 MAPK、ERK 和c-Jun 氨基末端激酶。MAPK/ ERK 的阻断剂可通过影响AngⅡ介导的Ⅰ型胶原合成从而缓解血管纤维化[12]。p38 MAPK 阻断剂可以抑制TGF-β1诱导的血管平滑肌细胞增殖,但并未影响Smads 的表达与功能,提示该阻断剂抑制TGF-β1诱导的细胞增殖不依赖Smads而通过MAPK 发挥作用[22]。MAPK 超家族激活可以促进胶原合成和VSMCs 增殖,但其中ERK 在高盐引起血管重构中的作用知之甚少。本实验结果表明在高盐饮食下,ERK1/2 蛋白磷酸化水平显著升高,说明ERK 通路也参与了高盐饮食诱导血管重构过程。MAPK 与TGF-β1/Smads 通路之间存在交互通话,Rodriguez-Vita 等[13]及Wang 等[11]分别应用p38 MAPK 或ERK1/2 抑制剂阻断AngⅡ介导的Smads活化及下游促血管重构相关基因转录与表达,证实MAPK 超家族通过与TGF-β1/Smads 通路的交互通话而影响Smads 活性最终参与血管重构过程。我们的结果显示高盐可使p-ERK1/2、p-Smad2/3 和Smad7 表达均发生改变,提示ERK 通路与Smads 通路共同参与了高盐饮食致血管重构的发生,但ERK1/2 与TGF-β1/Smads 交互对话机制,有待利用ERK 阻断剂进一步研究。
血管重构是高血压等心血管疾病共同的病理生理特征之一,与RAS 活性表达异常密切相关,AngⅡ可通过其AT1 受体介导慢性心血管疾病中心肌及血管胶原增生,导致胶原比例失调与心血管重塑。高盐可以使盐敏感大鼠组织局部RAS 激活,动脉组织AT1受体mRNA 和密度增加,血管紧张素转换酶(angiotensin converting enzyme,ACE)mRNA 和蛋白表达增加,动脉壁增厚和胶原沉积,AT1受体阻断剂和ACE 抑制剂能阻止高盐饮食诱导动脉胶原沉积和结构重塑[9,23-25]。从本实验结果可以看出替米沙坦能在一定程度内下调TGF-β1、p-Smad2/3 和p-ERK1/2 表达,上调Smad7 表达,有效抑制高盐所致大鼠主动脉和肠系膜动脉重构过程,表明替米沙坦可部分通过阻断AT1受体影响TGF-β1/Smads 和ERK 通路发挥抗血管重构作用。
[1] Umesawa M,Iso H,Date C,et al. Relations between dietary sodium and potassium intakes and mortality from cardiovascular disease:the Japan Collaborative Cohort Study for evaluation of cancer risks[J].Am J Clin Nutr,2008,88(1):195-202.
[2] Ferreira DN,Katayama IA,Oliveira IB,et al. Salt-induced cardiac hypertrophy and interstitial fibrosis are due to a blood pressure-independent mechanism in Wistar rats[J]. J Nutr,2010,140(10):1742-1751.
[3] Yu HC,Burrell LM,Black MJ,et al. Salt induces myocardial and renal fibrosis in normotensive and hypertensive rats[J].Circulation,1998,98(23):2621-2628.
[4] Varagic J,Frohlich ED,Susic D,et al.AT1receptor antagonism attenuates target organ effects of salt excess in SHRs without affecting pressure[J]. Am J Physiol Heart Circ Physiol,2008,294(2):H853-H858.
[5] Franck V,Alain M. Transforming growth factor-β signaling through the Smad pathway:role in extracellular matrix gene expression and regulation[J]. J Invest Dermatol,2002,118(2):211-215.
[6] de Cavanagh EM,Ferder LF,Ferder MD,et al. Vascular structure and oxidative stress in salt-loaded spontaneously hypertensive rats:effects of losartan and atenolol[J]. Am J Hypertens,2010,23(12):1318-1325.
[7] Bouillier H,Samain E,Rücker-Martin C,et al. Effect of extracellular matrix elements on angiotensin II-induced calcium release in vascular smooth muscle cells from normotensive and hypertensive rats[J]. Hypertension,2001,37(6):1465-1472.
[8] Forte A,Della-Corte A,De-Feo M,et al. Role of myofibroblasts in vascular remodelling:focus on restenosis and aneurysm[J].Cardiovasc Res,2010,88(3):395-405.
[9] Liang B,Leenen FH. Prevention of salt induced hypertension and fibrosis by angiotensin converting enzyme inhibitors in Dahl S rats[J]. Br J Pharmacol,2007,152(6):903-914.
[10]Simon G,Jaeckel M,Illyes G. Development of structural vascular changes in salt-fed rats[J]. Am J Hypertens,2003,16(7):488-493.
[11] Wang W,Huang XR,Canlas E,et al. Essential role of Smad3 in angiotensinⅡ-induced vascular fibrosis[J].Circ Res,2006,98 (8):1032-1039.
[12]Tharaux PL,Chatziantoniou C,Fakhouri F,et al. Angiotensin Ⅱactivates collagen I gene through a mechanism involving the MAP/ER kinase pathway[J].Hypertension,2000,36 (3):330-336.
[13] Rodriguez-Vita J,Sanchez-Lopez E,Esteban V,et al.Angiotensin Ⅱactivates the Smad pathway in vascular smooth muscle cells by a transforming growth factor-β-independent mechanism[J]. Circulation,2005,111(19):2509-2517.
[14]Itoh S,Itoh F,Goumans MJ,et al. Signaling of transforming growth factor-β family members through Smad proteins[J].Eur J Biochem,2000,267(24):6954-6967.
[15]顾德官.实验性高血压大鼠的血压观察[J]. 上海第二医学院学报,1985,88(2):102-104.
[16] Partovian C,Benetos A,Pommies JP,et al. Effects of a chronic high-salt diet on large artery structure:role of endogenous bradykinin[J]. Am J Physiol,1998,274(5 Pt 2):H1423-H1428.
[17]汪新良,何兆初,易家骥,等. 替米沙坦对盐敏感性高血压大鼠血管重构的影响[J]. 中国心血管杂志,2005,10(6):405-409.
[18]Mallawaarachchi CM,Weisberg PL,Siow RC. Smad7 gene transfer atenuates adventitial cell migration and vascular remodeling after balloon injury[J]. Arterioscler Thromb Vasc Biol,2005,25(7):1383-1387.
[19]张 国,王天才,唐望先,等.Smad3、Smad7 基因表达与肝纤维化发病关系研究[J]. 中华消化杂志,2002,22(11):647-650.
[20]钟 华,何 芳,胡清华,等.ERK 和Smad 通路在TGF-β1抑制大鼠血管平滑肌细胞增殖中的作用[J]. 中国病理生理杂志,2009,25(9):1665-1670.
[21] 王岚峰,张 蕾,张瑞英,等. Smad 表达与心肌梗死后心房重构的关系[J]. 中华心血管病杂志,2005,33(10):932-935.
[22] Seay U,Sedding D,Krick S,et al. Transforming growth factor-beta-dependent growth inhibition inprimary vascular smooth muscle cells is p38-dependent[J]. Pharmacol Exp Ther,2005,315(3):1005-1012.
[23]杨 婷,谢汝佳,罗新华,等. 丹芍化纤胶囊对肝纤维化大鼠肝脏Smads 分子表达的影响[J].中国病理生理杂志,2010,26(9):1807-1812.
[24]Liang B,Leenen FH. Prevention of salt-induced hypertension and fibrosis by AT1-receptor blockers in Dahl S rats[J]. Cardiovasc Pharmacol,2008,51(5):457-466.
[25]Kagiyama S,Matsumura K,Fukuhara M,et al. Aldosterone-and-salt-induced cardiac fibrosis is independent from angiotensin II type 1a receptor signaling in mice[J].Hypertens Res,2007,30(10):979-989.

