HSP90依赖的Akt线粒体转位参与IGF-1对低温保存心脏的保护作用*
余国伟, 陈 洁, 陈莹莹, 郑鸣之, 沈岳良△
(浙江大学医学院 1附属第一医院心胸外科,2病理与病理生理学系,浙江 杭州 310058;3浙江医学高等专科学校药理教研室,浙江 杭州 310053)
1000-4718(2012)10-1773-06
2012-04-28
2012-08-01
国家自然科学基金资助项目(No. 81070201);浙江省自然科学基金资助项目(No. Y2100092);浙江省教育厅科研项目(No. Y201019167)
△通讯作者 Tel: 0571-88208250; 0571-87692678; E-mail: shenyueliang@zju.edu.cn; zmzjjpdd181@sina.com
HSP90依赖的Akt线粒体转位参与IGF-1对低温保存心脏的保护作用*
余国伟1, 陈 洁2, 陈莹莹2, 郑鸣之3△, 沈岳良2△
(浙江大学医学院1附属第一医院心胸外科,2病理与病理生理学系,浙江 杭州 310058;3浙江医学高等专科学校药理教研室,浙江 杭州 310053)
目的观察胰岛素样生长因子1(IGF-1)是否可对抗低温保存诱导的心肌损伤,并探讨其可能的机制。方法观察SD大鼠心脏低温保存9 h后,再灌注期左心室发展压(LVDP)和细胞凋亡指数的变化。Western blotting法检测蛋白激酶B(Akt)蛋白表达。结果(1)Celsior保存液中加入10 nmol/L IGF-1可促进低温保存9 h后心脏收缩功能的恢复、减少心肌细胞凋亡的发生、抑制线粒体渗透性转换孔开放。(2)IGF-1可上调心脏Akt蛋白磷酸化水平。磷脂酰肌醇3-激酶(PI3K)特异性抑制剂LY294002不仅可降低IGF-1诱导的Akt磷酸化水平,且可逆转IGF-1促进低温保存心脏心功能的恢复和抗凋亡作用。(3)抑制热休克蛋白90(HSP90)可降低IGF-1诱导的Akt磷酸化和线粒体转位,阻断IGF-1的心肌保护作用。结论IGF-1可明显减少低温保存心脏心肌细胞凋亡的发生,促进再灌注期心功能的恢复,其机制可能与HSP90依赖性Akt的激活和线粒体转位有关。
心脏保存; 胰岛素样生长因子1; Akt; 热休克蛋白质90; 线粒体
心脏移植是一种用于治疗严重冠心病等终末期心脏病患者的有效外科手段。减轻供心低温保存过程中的损伤是心脏移植成功的关键,改良保存液配方可以相对延长供心的保存时间,既为潜在的免疫配型赢得机会,也能使远距离获取供心成为可能[1]。但遗憾的是,目前临床上心脏的低温保存时间局限在4~6 h以内,这与其它器官如肝、肾、胰的保存时间相比要短得多。因而如何提高供心在长时程低温保存的有效性,延长供心保存时间,是当前迫切需要解决的问题。胰岛素样生长因子1(insulin like growth factor 1,IGF-1)是一种与胰岛素原有高度同源性的多肽,具有促细胞分化、增殖功能和胰岛素样代谢作用。研究表明,IGF-1受体广泛存在于包括心血管系统在内的不同组织中,IGF-1可能通过自分泌和/或旁分泌机制对心脏起生理和病理调节作用,如IGF-1参与胚胎和出生早期的心脏发育,而且在心肌肥厚的形成中起了重要的作用[2]。而最近的研究发现,IGF-1还可减轻心肌缺血再灌注损伤[3];减少心肌组织重构,改善心力衰竭[4];减轻高脂饮食诱导的心肌收缩功能减弱[5]。这些实验证据提示,IGF-1具有心肌保护作用。然而,IGF-1是否可减轻供心低温保存诱导的损伤还不明了。故本实验将在大鼠心脏低温保存模型上,观察IGF-1是否可对抗低温保存诱导心肌细胞凋亡和复灌期心功能下降,并探讨其可能的机制。
材 料 和 方 法
1药品与溶液的配制
IGF-1、LY294002和17-丙烯胺基-17-去甲氧基格尔德霉素(17-allylamino-17-demethoxy-geldanamycin,AAG)均购自Sigma。蛋白激酶B(protein kinase B,PKB,又称Akt)抗体、p-Akt (Ser473) 抗体、细胞色素氧化酶IV亚基(subunit IV of cytochrome oxidase,COXIV)抗体和β-actin抗体购自CST。其余试剂均为市售分析纯级。Celsior液用于心脏的停搏与保存,其成分及含量为(mmol/L):NaOH 100,KCl 15,MgCl213,CaCl20.25,甘露醇 60,乳酸钠 80,组氨酸30,谷胱甘肽20,pH 7.4,渗透压320 mOsm/L。
2动物
雄性Sprague-Dawley(SD)大鼠(230~250 g)由浙江大学医学院实验动物中心提供。根据保存液成分的不同,随机分为7大组(n=8)。(1)空白对照(control)组:离体心脏不给予低温保存处理;(2)单纯Celsior组:离体心脏于Celsior液中4 ℃保存9 h;(3)IGF-1组:离体心脏于含10 nmol/L IGF-1的Celsior液中4 ℃保存9 h;(4)IGF-1+LY组:离体心脏于含10 nmol/L IGF-1和15 μmol/L LY294002的Celsior液中4 ℃保存9 h;(5)LY组:离体心脏于含15 μmol/L LY294002的Celsior液中4 ℃保存9 h;(6)IGF-1+AAG组:离体心脏于含10 nmol/L IGF-1和AAG(200 nmol/L)的Celsior液中4 ℃保存9 h;(7)AAG组:大鼠离体心脏于含AAG(200 nmol/L)的Celsior液中4 ℃保存9 h。
3离体鼠心灌流、低温保存和心功能测定
SD大鼠用戊巴比妥钠(50 mg/kg)腹腔麻醉后,迅速取出心脏,置于4 ℃ K-H液中除去血液,然后迅速转移并固定于Langendorff灌流装置上,用改良K-H液行常规逆行恒压灌注(76 mmHg),改良K-H液成分为(mmol/L):NaCl 118,KCl 4.7,KH2PO41.2,MgSO41.2,NaHCO325,CaCl21.25,葡萄糖 10,pH 7.4。整个灌注期间温度保持在37 ℃,灌流液用95% O2、5% CO2饱和。切开左心耳,将连有压力传感器的球囊送入左心室,压力传感器和MedLab生物信号采集处理系统(南京美易)连接。待离体鼠心收缩逐渐稳定后,往心室球囊内缓慢注入适量生理盐水,使左心室舒张末期压维持在6~8 mmHg。K-H液平衡灌注30 min后,改用4 ℃的Celsior液灌注,灌注时间控制在3 min以内,此时心脏表面同时降温,待心脏停搏后,各组心脏置于含不同添加剂的Celsior心肌保存液中。在4 ℃条件下保存9 h后,重新置于Langendorff装置上再灌注60 min。灌注条件同保存前保持一致。再灌注开始后的前10 min作为心脏复苏后的稳定期,测定再灌注60 min时左心室发展压(left ventricular developed pressure,LVDP)。
4心肌细胞凋亡指数
利用原位末端标记法(TdT-mediated dUTP nick end labeling,TUNEL)测定心肌细胞凋亡情况。切取左室心尖部全层心肌,10 %甲醛固定,常规脱水,石蜡包埋,切片。将组织切片用二甲苯脱蜡,梯度乙醇水化,37 ℃下用蛋白酶K处理30 min后再用PBS冲洗;0.3% H2O2甲醇溶液室温下孵育30 min,PBS冲洗后加入FITC荧光标记的核苷酸和脱氧核苷酸末端转移酶(terminal deoxynucleotidyl transferase,TdT)的混合液,37 ℃水浴箱中反应60 min,PBS冲洗;加辣根过氧化物酶孵育30 min(37 ℃),PBS冲洗;DAB显色(避光),苏木素复染后脱水,透明,封片。在高倍镜下检测,心肌凋亡阳性细胞核呈棕黄色,凋亡阴性细胞核呈蓝色。以凋亡阳性细胞数目占总心肌细胞数目的百分比作为心肌细胞凋亡指数(apoptotic index,AI)。
5Westernblotting分析
取左心室在冰上加裂解液(含有0.1% PMSF,0.1% 蛋白抑制剂 cocktail,1% 聚乙二醇辛基苯基醚,0.1% 十二烷基硫酸钠,10% 甘油,50 mmol/L Tris-HCl,150 mmol/L NaCl)裂解制备匀浆液,离心取蛋白沉淀。Lowry法测蛋白浓度。取20 μg蛋白于10%SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离后,转移至硝酸纤维素膜。然后,5%脱脂奶粉封闭硝酸纤维素膜1 h,洗膜后加入I抗(1∶1 000),4 ℃反应过夜。次日洗膜后,加入1∶2 500辣根过氧化物酶标记的II抗,室温孵育1 h。加入ECL显色剂,X片显影。用Quality One图像分析软件(Bio-Rad),根据吸光度定量分析。
6心肌线粒体的制备
采用差速分级离心法分离线粒体。将离体大鼠心脏置于预冷的匀浆介质(160 mmol / L KC1,10 mmol/L EDTA,0.5%牛血清白蛋白,pH 7.4)中尽快剪碎,用组织匀浆机制成10%匀浆,在4 ℃下,以1 000×g离心10 min,弃沉淀,上清液于4 ℃、8 000×g离心10 min;弃上清液,沉淀用重悬液(320 mmol/L蔗糖,10 mmol/L Tris-HCl,pH 7.4)重悬后再次于4 ℃、8 000×g离心10 min。所得沉淀即为线粒体。线粒体置于重悬液中用考马斯亮蓝蛋白测定法测定蛋白含量。
7线粒体渗透性转换孔的检测
用线粒体缓冲液{120 mmol/L KCl,20 mmol/L 3-(N-吗啉基)丙磺酸[3-(N-morpholino) propane sulfonic acid,MOPS],10 mmol/L Tris-HCl,5 mmol/L KH2PO4,pH 7.4}将心肌线粒体稀释至0.25 g/L 蛋白质浓度。随后加入200 μmol/L CaCl2,观察CaCl2加入前后520 nm处线粒体吸光度(A520)的下降情况。用A520max-A520min的差值表示线粒体渗透性转换孔(mitochondrial permeability transition pore,MPTP)的开放情况。当MPTP开放时,线粒体通透性增加,肿胀液中的溶质内流入线粒体基质,引起线粒体膨胀,外膜破裂,从而使得线粒体体积增大,520 nm处的吸光度下降明显,A520max-A520min的差值增大。
8统计学处理
结 果
1IGF-1对低温保存心脏心肌凋亡和心功能恢复情况
实验前各组LVDP无明显差异(数据未显示)。心脏低温保存9 h后,LVDP 恢复率明显下降(34.6%±6.2%vs97.3%±3.7%,P<0.01),细胞凋亡指数明显增加(42.1%±4.4%vs3.4%±1.3%,P<0.01),A520max-A520min差值增大(0.018±0.002vs0.010±0.003,P<0.01)。与单纯Celsior组相比,在保存液中添加10 nmol/L IGF-1后,LVDP恢复率明显增高,细胞凋亡指数明显下降,A520max-A520min差值减小(P<0.01),见图1。
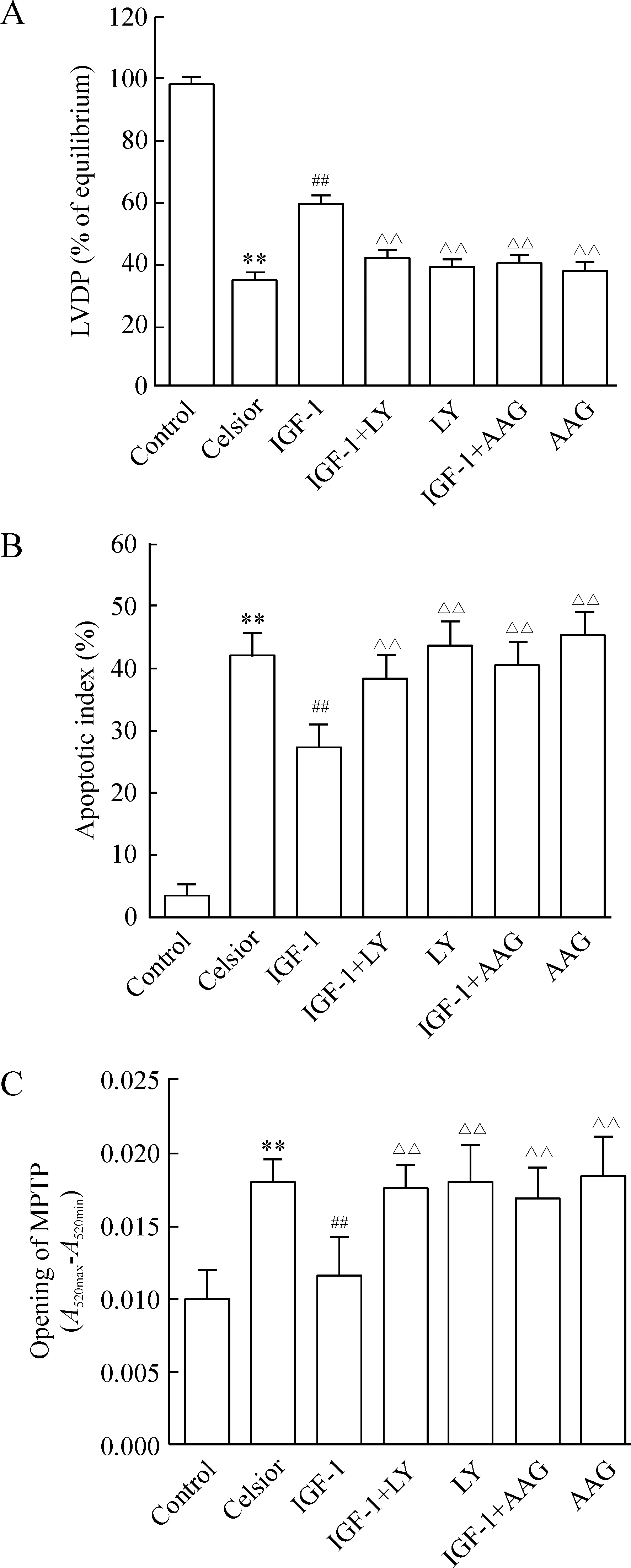
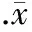
图1心脏低温保存9h再灌注60min后心脏LVDP恢复率、心肌凋亡和MPTP孔开放情况
2PI3K/Akt在IGF-1对抗低温保存心肌损伤中的作用
与单纯Celsior组相比,IGF-1组Akt蛋白总量无明显变化,但其磷酸化水平增加约2.7倍(P<0.01),见图2。与IGF-1组相比,在低温保存液中同时添加IGF-1和PI3K特异性抑制剂15 μmol/L LY294002后,心肌Akt磷酸化水平下降(P<0.01),见图2,且再灌注期心功能的恢复率下降,细胞凋亡指数增加(P<0.01),见图1。

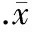
图2IGF-1对低温保存心脏总Akt表达和磷酸化水平的影响
3IGF-1处理不同时间后对线粒体Akt总量的影响
与单纯Celsior冷保存3、6和9 h组相比,在低温保存液中添加IGF-1各组全细胞Akt总量没有明显变化;但线粒体Akt总量明显增高(P<0.05),见图3。
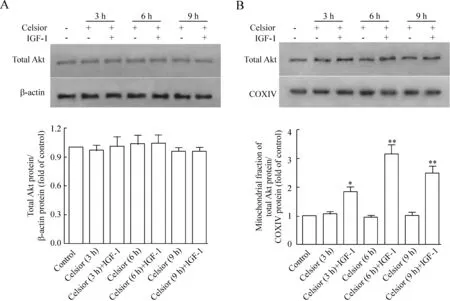
图3IGF-1处理不同时间后全细胞和线粒体内Akt总量的变化
4热休克蛋白90(heat-shockprotein90,HSP90)在IGF-1诱导的Akt磷酸化中的作用
与单纯Celsior组相比,在低温保存液中单独添加HSP90特异性抑制剂AAG,心功能恢复率和细胞凋亡指数无明显变化,见图1。但AAG可明显抑制IGF-1诱导的线粒体Akt总量和磷酸化水平增加(P<0.01),而对胞浆内Akt磷酸化水平无明显影响,见图4。与IGF-1组相比,IGF-1+AAG组心脏再灌注期心功能的恢复率下降,细胞凋亡指数增加(P<0.01),见图1。
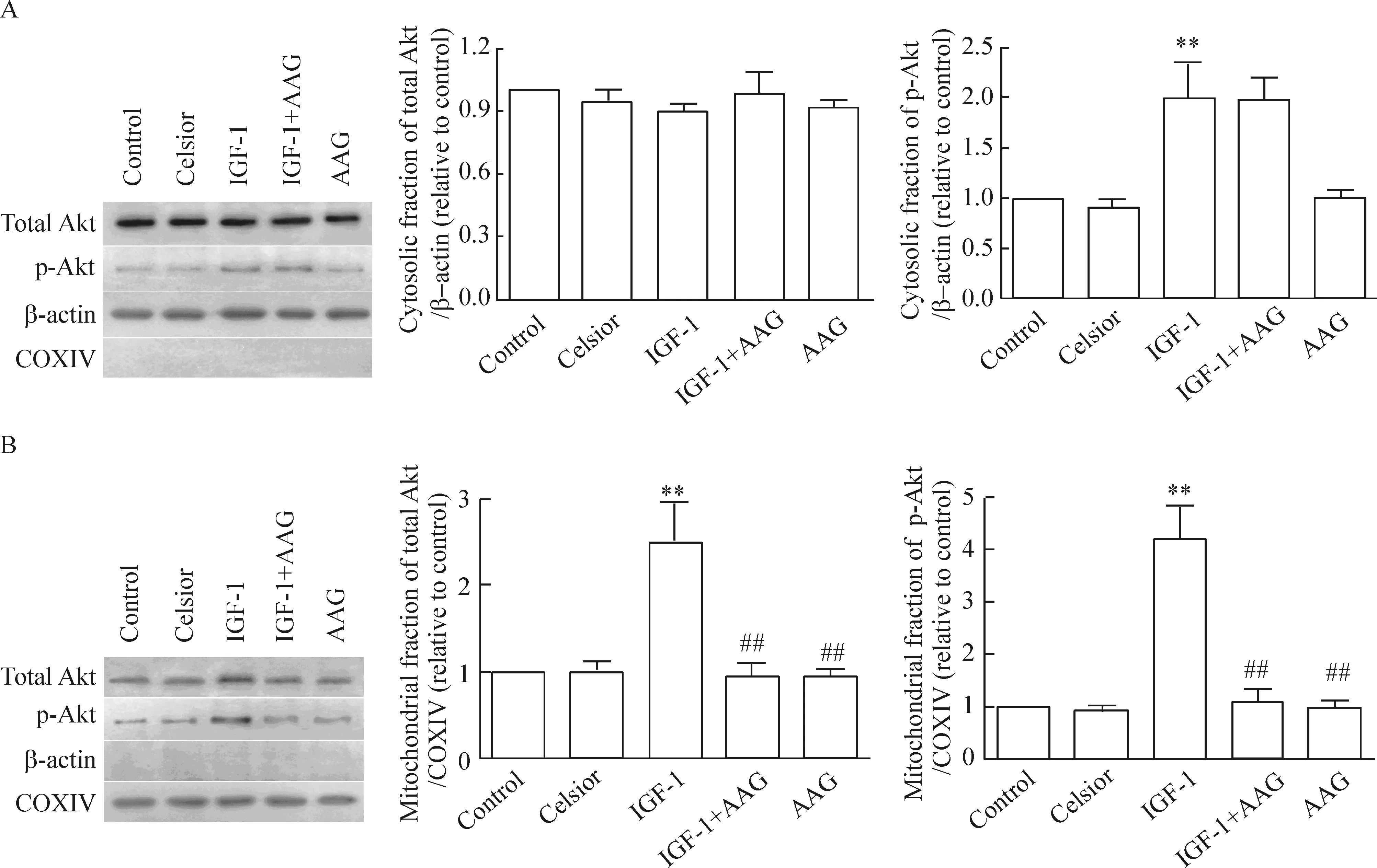
图4Westernblotting检测心肌细胞胞浆和线粒体中总Akt表达和磷酸化水平的变化
讨 论
研究表明,随着低温保存时间的延长,供心在再灌注期的心脏收缩功能明显下降,且心肌细胞凋亡的发生率也明显增加[6]。有效对抗低温缺血保存后再灌注损伤,促进供心心功能的恢复是心脏移植成功的关键。IGF-1是维持正常心功能的重要的生理性调节因子。流行病学调查发现,低水平的血清IGF-1水平与急性心肌梗死、缺血性心肌病、冠脉粥样硬化等的发生密切相关;而临床研究发现补充IGF-1可明显改善充血性心衰患者的心功能。动物实验也表明IGF-1可具有改善糖尿病心肌病、心衰和心肌梗死等作用[3-5]。最近研究报道,IGF-1可减轻缺氧诱导的心肌细胞凋亡[7]。我们的实验发现,在保存液中添加IGF-1同样可减少低温保存诱导的心肌细胞凋亡的发生,提高再灌注期心功能的恢复率。提示,IGF-1在心脏低温保存模型上同样具有保护作用。研究证实,MPTP开放是各种因素刺激心肌细胞线粒体凋亡途径的关键。本研究发现IGF-1可改善低温保存诱导的MPTP开放情况,提示IGF-1的心肌保护作用机制可能与其抑制MPTP开放有关。
IGF-1减轻低温保存诱导的心肌细胞凋亡的确切机制尚不明了。近年来的研究表明IGF-1可能通过多条信号转导机制发挥其保护作用,而PI3K/Akt的激活在其中起了关键的作用。已经证实,PI3K/Akt激活后可调节细胞多种功能,其中包括促生存、抗凋亡和自噬、调节蛋白合成和糖代谢、改善线粒体能量代谢、正性肌力作用等[7-9]。本实验发现, IGF-1可上调低温保存心脏Akt蛋白磷酸化水平,在低温保存液中添加PI3K特异性抑制剂LY294002不仅降低了IGF-1诱导的Akt磷酸化水平,且可取消IGF-1促进低温保存心脏心功能的恢复和抗凋亡作用。提示,PI3K/Akt在IGF-1抗低温保存诱导的心肌损伤中起了关键的作用。
以往的研究认为Akt大部分存在于胞浆中,极少量存在于细胞核中。2003年,Bijur等[10]首次报道Akt蛋白也可存在于神经细胞线粒体上;且在PI3K刺激下胞浆Akt蛋白可发生磷酸化激活,并迅速转位至线粒体。此后,Akt被报道同样存在于心肌细胞线粒体上[11]。我们的研究发现IGF-1对细胞总Akt含量不变,但胞浆和线粒体Akt蛋白磷酸化程度均明显增加。Ahmad等[12]在小鼠心脏缺血再灌注模型中发现,仅仅激活胞浆中的Akt不足以引发心肌保护作用,而磷酸化的Akt从胞浆转位至线粒体是引发心肌保护作用的关键。Akt线粒体转位诱导的抗凋亡作用分子机制还不明了。根据文献报道推测,Akt线粒体转位后可能主要通过以下3条途径维持线粒体的完整性[13],对抗低温保存诱导的心肌细胞损伤:(1)磷酸化Bad和Bax,抑制Bax向线粒体移位,从而调节MPTP开放;(2)使糖原合成酶激酶3的Ser9和Ser21位点磷酸化激活,抑制其活性,阻止MPTP开放;(3)激活线粒体己糖激酶II,抑制其从线粒体分离,从而减少MPTP开放。但具体机制仍需进一步实验证实。
虽然已经证实Akt线粒体转位具有抗凋亡作用,但IGF-1诱导Akt线粒体转位的分子机制仍不明了。HSP90是热休克蛋白家族最典型的成员之一。早在2000年Sato等[14]就报道了Akt作为一种典型的“雇主”蛋白受HSP90所调控。HSP90是维持Akt结构和功能稳定的关键因子,HSP90抑制剂可诱导Akt去磷酸化。而最近的研究证实,HSP90作为一种伴侣分子在参与蛋白线粒体转位中也起了关键的作用[15]。本实验结果显示,HSP90抑制剂可降低IGF-1诱导的线粒体Akt总量和磷酸化水平,但对IGF-1诱导的胞浆Akt磷酸化水平并无明显影响,且HSP90抑制剂可取消IGF-1的心肌保护作用,提示Akt可能通过HSP90依赖性模式完成线粒体转位。
综上所述,在低温保存液中添加IGF-1可明显降低心肌细胞凋亡的发生,促进再灌注期心功能的恢复。IGF-1的心肌保护机制可能与HSP90依赖性Akt激活和线粒体转位有关。
[1] Chien S, Zhang F, Niu W, et al. Fructose-1,6-diphosphate and a glucose-free solution enhances functional recovery in hypothermic heart preservation[J]. J Heart Lung Transplant, 2000, 19(3): 277-285.
[2] 黄顺伟, 高修仁, 唐可京. 原发性高血压患者循环中IGF-1水平与心肌肥厚的研究[J]. 中国病理生理杂志, 2005, 21(4): 696-699.
[3] Davani EY, Brumme Z, Singhera GK, et al. Insulin-like growth factor-1 protects ischemic murine myocardium from ischemia/reperfusion associated injury[J]. Crit Care, 2003, 7(6): R176-R183.
[4] Lai NC, Tang T, Gao MH, et al. Improved function of the failing rat heart by regulated expression of insulin-like growth factor I via intramuscular gene transfer[J]. Hum Gene Ther, 2012, 23(3): 255-261.
[5] Zhang Y, Yuan M, Bradley KM, et al. Insulin-like growth factor 1 alleviates high-fat diet-induced myocardial contractile dysfunction: role of insulin signaling and mitochondrial function[J]. Hypertension, 2012, 59(3): 680-693.
[6] 郑鸣之, 蒋建平, 陈文良, 等. 二氮嗪对冷保存诱导的大鼠供心Smac/DIABLO蛋白表达的抑制作用[J]. 中国病理生理杂志, 2009, 25(9): 1676-1680.
[7] Song HP, Zhang L, Dang YM, et al. The phosphatidylinositol 3-kinase-Akt pathway protects cardiomyocytes from ischaemic and hypoxic apoptosis via mitochondrial function[J]. Clin Exp Pharmacol Physiol, 2010, 37(5-6): 598-604.
[8] Kim SJ, Abdellatif M, Koul S, et al. Chronic treatment with insulin-like growth factor I enhances myocyte contraction by upregulation of Akt-SERCA2a signaling pathway[J]. Am J Physiol Heart Circ Physiol, 2008, 295(1): H130-H135.
[9] Troncoso R, Vicencio JM, Parra V, et al. Energy-preserving effects of IGF-1 antagonize starvation-induced cardiac autophagy[J]. Cardiovasc Res, 2012, 93(2): 320-329.
[10]Bijur GN, Jope RS. Rapid accumulation of Akt in mitochondria following phosphatidylinositol 3-kinase activation[J]. J Neurochem, 2003, 87(6): 1427-1435.
[11]Kobayashi H, Miura T, Ishida H, et al. Limitation of infarct size by erythropoietin is associated with translocation of Akt to the mitochondria after reperfusion[J]. Clin Exp Pharmacol Physiol, 2008, 35(7): 812-819.
[12]Ahmad N, Wang Y, Haider KH, et al. Cardiac protection by mitoKATPchannels is dependent on Akt translocation from cytosol to mitochondria during late preconditioning[J]. Am J Physiol Heart Circ Physiol, 2006, 290(6): H2402-H2408.
[13]Miyamoto S, Rubio M, Sussman MA. Nuclear and mitochondrial signalling Akts in cardiomyocytes[J]. Cardiovasc Res, 2009, 82(2): 272-285.
[14]Sato S, Fujita N, Tsuruo T. Modulation of Akt kinase activity by binding to Hsp90[J]. Proc Natl Acad Sci U S A, 2000, 97(20): 10832-10837.
[15]Fan AC, Bhangoo MK, Young JC. Hsp90 functions in the targeting and outer membrane translocation steps of Tom70-mediated mitochondrial import[J]. J Biol Chem, 2006, 281(44): 33313-33324.
Heat-shockprotein90-dependenttranslocationofAkttomitochondriamediatesinsulin-likegrowthfactor1-inducedprotectionofratheartsunderhypothermicpreservation
YU Guo-wei1, CHEN Jie2, CHEN Ying-ying2, ZHENG Ming-zhi3, SHEN Yue-liang2
(1DepartmentofCardiothoracicSurgery,theFirstAffiliatedHospital,2DepartmentofPathologyandPathophysiology,ZhejiangUniversitySchoolofMedicine,Hangzhou310058,China;3DepartmentofPharmacology,ZhejiangMedicalCollege,Hangzhou310053,China.E-mail:shenyueliang@zju.edu.cn;zmzjjpdd181@sina.com)
AIM: To investigate the effect of insulin-like growth factor 1 (IGF-1) on hypothermic preservation of rat hearts.METHODSIsolated rat hearts were preserved in Celsior solution with or without IGF-1 (10 nmol/L) for 9 h, followed by 60 min of reperfusion. Cell apoptosis was assessed by TUNEL method. The left ventricular developed pressure (LVDP) was recorded. Total Akt protein and phosphorylation of Akt protein were detected by Western blotting.RESULTSCompared with Celsior solution preservation group, IGF-1 significantly enhanced the LVDP recovery rate, decreased the apoptotic index, and inhibited the opening of mitochondrial permeability transition pore. IGF-1 increased the phosphorylation of Akt in 9 h of hypothemically preserved rat heart, which was inhibited by PI3K inhibitor LY294002. LY294002 also abolished the cardioprotection of IGF-1. 17-Allylamino-17-demethoxy-geldanamycin, a heat-shock protein 90 (HSP90) inhibitor, inhibited the IGF-1-induced increase in phosphorylation level of Akt and transolation to mitochondria, the improvement of cardiac functions, and the decrease in apoptosis.CONCLUSIONIGF-1 improves the cardiac functions and decreases apoptosis in the hearts under hypothermic preservation. The mechanism might involve in HSP90-dependent translocation in Akt to mitochondria.
Heart preservation; Insulin-like growth factor 1; Akt; Heat-shock proteins 90; Mitochondria
R331
A
10.3969/j.issn.1000-4718.2012.10.008

