地西他滨联合丙戊酸钠促进胃癌MGC-803 细胞凋亡和G0 /G1 期阻滞的机制研究*
张国强, 彭敏霞, 王晔恺, 周吉航, 曾 芳
(舟山医院1肝胆外科,2超声科,3检验科,4细胞分子生物学实验室,舟山 浙江316004)
转移抑制基因23 - H1(non - metastasis 23 -H1,nm23 -H1)参与肿瘤细胞的侵袭和转移过程。在多种肿瘤中如结肠癌[1]、前列腺癌[2]、非小细胞肺癌[3]中,抑癌基因nm23 -H1 的低表达与肿瘤侵袭、转移及患者预后高度相关,并且体外胃癌细胞株从低侵袭性的悬浮态向高侵袭性的黏附态转化中也出现胞内nm23 -H1 的表达降低[4]。地西他滨(decitabine,DCA)和丙戊酸钠(valproic acid,VPA)是2 种不同机制的表观遗传学药物,在多种肿瘤细胞中可联合诱导细胞凋亡和周期阻滞[5]。我们通过2 种药联用观察其对胃癌MGC -803 抑癌基因nm23 -H1表达的影响,探讨其对细胞凋亡、周期影响的可能机制。
材 料 和 方 法
1 药品、试剂和仪器
地西他滨(5 - 氮杂-2' - 脱氧胞嘧啶核苷粉剂)购自Sigma,注射用丙戊酸钠(德巴金针)购自赛诺菲-安万特公司,FITC 标记的膜联蛋白-碘化丙啶(Annexin V/PI)凋亡试剂盒、细胞周期分析试剂盒购自BD,DNA 提取纯化试剂盒购自Promega,Trizol购自Invitrogen,One Step SYBR GreenⅠ实时荧光定量PCR 试剂盒购自TaKaRa,小牛血清和RPMI -1640 培养液购自碧云天生物技术研究所。nm23 -H1 上游引物5’-TGGTGAAGACGGGCCGAGTCA -3’,下游引物5’-ATCAGATGGTCGGGGATGGTAACAC-3’,产物长度382 bp。GAPDH 上游引物5’-AAGGTGAAGGTCGGAGTCAAC-3’,下游引物5’-GGGGTCATTGATGGCAACAATA - 3’,产 物 长 度102bp。荧光PCR 仪为ABI 7500,CO2培养箱为德国Jouan IG150 产品,流式细胞仪为BD FACSCalibur 产品,获取软件为CellQuest,细胞周期分析软件为Flowjo,冰冻离心机为Eppendorf 5714R。
2 方法
2.1 细胞培养及药物处理 胃癌细胞株MGC -803购自中科院上海细胞库。用含10%小牛血清、100 U·L-1青霉素、100 mg·L-1链霉素的RPMI -1640培养液在37 ℃、5%CO2培养箱中培养,取对数期细胞备用。配制密度为1 ×108/L 的细胞悬液接种于6孔培养板,每孔2 ml,置37 ℃、5%CO2、饱和湿度培养箱中培养过夜,按照分组分别加入终浓度为DCA 1.5 μmol·L-1、DCA 3.0 μmol·L-1、VPA 1.5 mmol·L-1、DCA 1.5 μmol·L-1+VPA 1.5 mmol·L-1和DCA 3.0 μmol·L-1+VPA 1.5 mmol·L-1,每组设6复孔,作用72 h 后各孔吸出培养液,PBS 洗1 次,吸弃PBS 后进行实验。
2.2 Annexin V/PI 标记法观察细胞凋亡 2.1 步骤中细胞用预冷PBS 洗涤弃上清,残渣细胞收集至流式管。每管加5 μL Annexin V-FITC 和10 μL PI,避光静置15 min,加300 μL 预冷的PBS,振荡混匀上机检测其早、晚期凋亡率。
2.3 细胞周期分析 2.1 步骤中细胞用预冷PBS 洗涤弃上清,残渣细胞收集至流式管。每管依次加A、B、C 液,避光静置15 min,加300 μL 预冷的PBS,振荡混匀上机检测,用Flowjo 软件中的Watson(Pragmatic)模型分析细胞周期各期比例。
2.4 实时荧光定量PCR 检测nm23 -H1 mRNA 表达 Trizol 提取总RNA,A260/280鉴定完整性和纯度,反应体系20 μL:包括总RNA 2 μL,PCR 正反向引物(10 μmol/L)各1 μL,ROX Reference Dye Ⅱ0.4 μL,Primer Script One Step Enzyme Mix Ⅱ0. 8 μL,One Step SYBR RT-PCR Buffer 10 μL,加ddH2O 补足20 μL。反应条件:42 ℃5 min,95 ℃10 s,95 ℃5 s,55 ℃30 s,72 ℃ 45 s,40 个循环。2-ΔΔCt法分析nm23 -H1 mRNA 相对表达量。
3 统计学处理
结 果
1 Annexin V/PI 法检测细胞凋亡
所有加药组早期凋亡率均高于对照组,差异有统计学意义(P <0.01);VPA 1.5 mmol·L-1+DCA 1.5 μmol·L-1联合用药组高于DCA 1.5 μmol·L-1组和VPA 1.5 mmol·L-1组,差异有统计学意义(P<0.01);VPA 1.5 mmol·L-1+DCA 3.0 μmol·L-1联合用药组高于DCA 3.0 μmol·L-1组和VPA 1.5 mmol·L-1组,差异有统计学意义(P <0.01),见图1、表1。
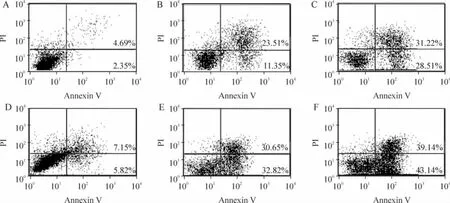
Figure 1. Synergistic effect of DCA and VPA on MGC-803 cell apoptosis detected by Annexin V/PI staining. A:normal control;B:DCA 1.5 μmol·L-1;C:DCA 3.0 μmol·L-1;D:VPA 1.5 mmol·L-1;E:VPA 1.5 mmol·L-1 +DCA 1.5 μmol·L-1;F:VPA 1.5 mmol·L-1 +DCA 3.0 μmol·L-1.图1 Annexin V /PI 染色检测地西他滨联合丙戊酸钠对MGC-803 细胞凋亡的影响
表1 地西他滨联合丙戊酸钠对MGC-803 细胞凋亡的影响Table 1. Synergistic effect of DCA and VPA on MGC-803 cell apoptosis (%. ±s.n=6)
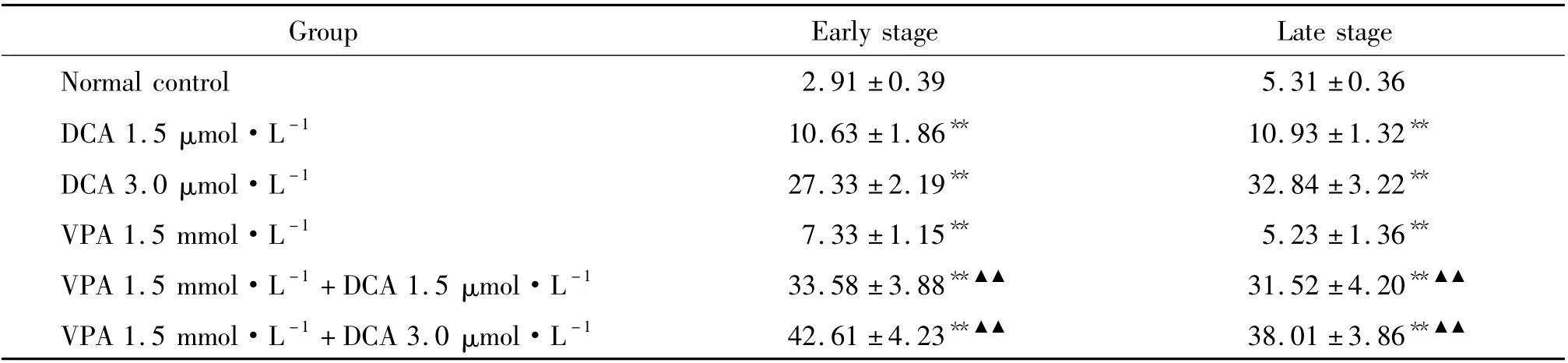
表1 地西他滨联合丙戊酸钠对MGC-803 细胞凋亡的影响Table 1. Synergistic effect of DCA and VPA on MGC-803 cell apoptosis (%. ±s.n=6)
** P <0.01 vs normal control group;▲▲P <0.01 vs corresponding concentration of single drug group.
Group Early stage Late stage Normal control 2.91 ±0.39 5.31 ±0.36 DCA 1.5 μmol·L -1 10.63 ±1.86** 10.93 ±1.32**DCA 3.0 μmol·L -1 27.33 ±2.19** 32.84 ±3.22**VPA 1.5 mmol·L -1 7.33 ±1.15** 5.23 ±1.36**VPA 1.5 mmol·L -1 +DCA 1.5 μmol·L -1 33.58 ±3.88**▲▲ 31.52 ±4.20**▲▲VPA 1.5 mmol·L -1 +DCA 3.0 μmol·L -1 42.61 ±4.23**▲▲ 38.01 ±3.86**▲▲
2 地西他滨联合丙戊酸钠对MGC-803 细胞细胞周期的影响
SubG1期:VPA 1.5 mmol·L-1+DCA 1.5 μmol·L-1联合用药组(15.39% ±0.73%)和VPA 1.5 mmol·L-1+ DCA 3.0 μmol·L-1联 合 用 药 组(18.79% ±1.26%)均高于各自的单药组,差异有统计学意义(P <0.01);G0/G1期:VPA 1.5 mmol·L-1+ DCA 1.5 μmol·L-1联 合用 药 组(61.55% ±2.38%)和VPA 1.5 mmol·L-1+DCA 3.0 μmol·L-1联合用药组(66.75% ±2.48%)均高于各自的单药组,差异有统计学意义(P <0.01);S 期:VPA 1.5 mmol·L-1+ DCA 1.5 μmol·L-1联 合 用 药 组(11.17% ±0.94%)和VPA 1.5 mmol·L-1+ DCA 3.0 μmol·L-1联合用药组(6.97% ±1.10%)均低于各自的单药组,差异有统计学意义(P <0.01);G2/M 期:VPA 1.5 mmol·L-1+DCA 1.5 mmol·L-1联合用药组(11.89% ± 3.08%)和VPA 1.5 mmol·L-1+ DCA 3.0 μmol·L-1联合用药组(8.50% ±2.81%)均低于各自的单药组,差异有统计学意义(P<0.01),见图2、表2。
3 地西他滨联合丙戊酸钠对MGC-803 细胞中nm23-H1 mRNA 表达的影响
所有加药组nm23 - H1 mRNA 均高于对照组,差异有统计学意义(P <0.01);VPA 1.5 mmol·L-1+DCA 1.5 μmol·L-1联合用药组高于DCA 1.5 μmol·L-1组和VPA 1.5 mmol·L-1组,差异有统计学意义(P <0.01);VPA 1.5 mmol·L-1+DCA 3.0 μmol·L-1联合用药组高于DCA 3.0 μmol·L-1组和VPA 1.5 mmol·L-1组,差异有统计学意义(P <0.01),见表3。
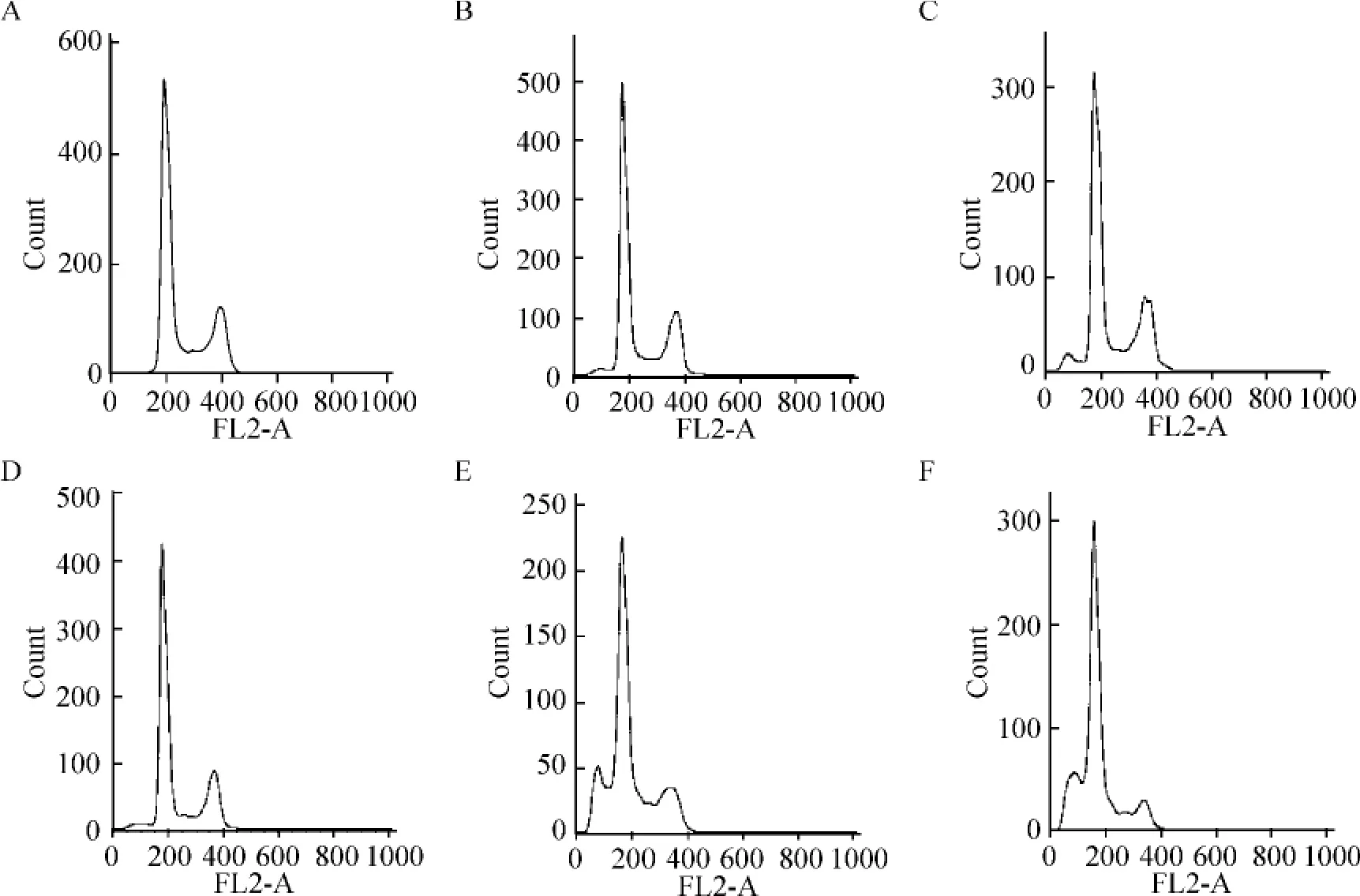
Figure 2. Synergistic effect of DCA and VPA on cell cycle of MGC-803 cells.A:normal control;B:DCA 1.5 μmol·L -1;C:DCA 3.0 μmol·L -1;D:VPA 1.5 mmol·L -1;E:VPA 1.5 mmol·L -1 +DCA 1.5 μmol·L -1;F:VPA 1.5 mmol·L -1 +DCA 3.0 μmol·L -1.图2 地西他滨联合丙戊酸钠对MGC-803 细胞周期的影响
表2 地西他滨联合丙戊酸钠对MGC-803 细胞周期的影响Table 2. Synergistic effect of DCA and VPA on cell cycle of MGC-803 cells (%. ±s.n=6)
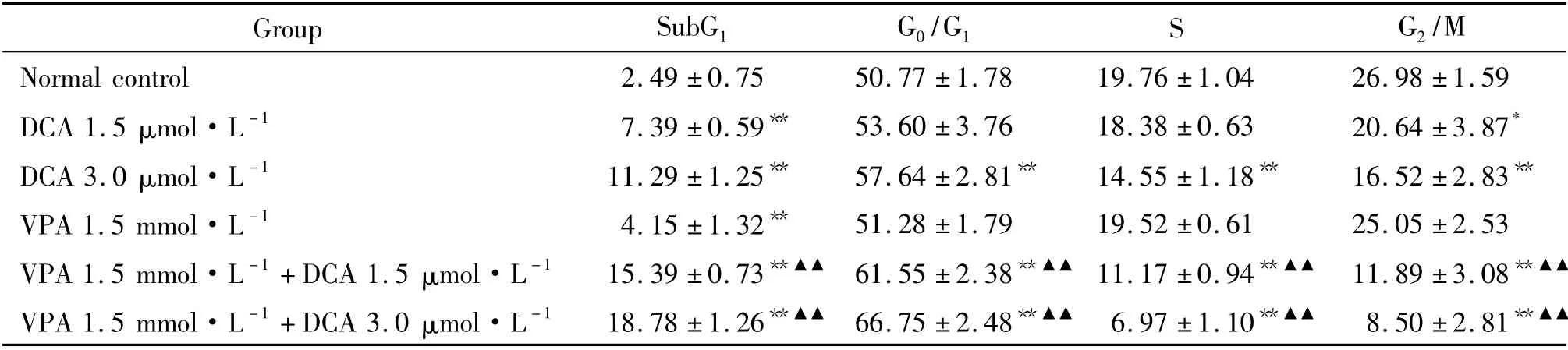
表2 地西他滨联合丙戊酸钠对MGC-803 细胞周期的影响Table 2. Synergistic effect of DCA and VPA on cell cycle of MGC-803 cells (%. ±s.n=6)
* P <0.05,**P <0.01 vs normal control group;▲▲P <0.01 vs corresponding concentration of single drug group.
Group SubG1 G0/G1 S G2/M Normal control 2.49 ±0.75 50.77 ±1.78 19.76 ±1.04 26.98 ±1.59 DCA 1.5 μmol·L -1 7.39 ±0.59** 53.60 ±3.76 18.38 ±0.63 20.64 ±3.87*DCA 3.0 μmol·L -1 11.29 ±1.25** 57.64 ±2.81** 14.55 ±1.18** 16.52 ±2.83**VPA 1.5 mmol·L -1 4.15 ±1.32** 51.28 ±1.79 19.52 ±0.61 25.05 ±2.53 VPA 1.5 mmol·L -1 +DCA 1.5 μmol·L -1 15.39 ±0.73**▲▲ 61.55 ±2.38**▲▲ 11.17 ±0.94**▲▲ 11.89 ±3.08**▲▲VPA 1.5 mmol·L -1 +DCA 3.0 μmol·L -1 18.78 ±1.26**▲▲ 66.75 ±2.48**▲▲ 6.97 ±1.10**▲▲ 8.50 ±2.81**▲▲
表3 地西他滨联合丙戊酸钠对HL-60 细胞中nm23-H1 mRNA 表达的影响Table 3. Synergistic effect of DCA and VPA on nm23 -H1 mRNA expression in MGC-803 cells (±s.n=6)

表3 地西他滨联合丙戊酸钠对HL-60 细胞中nm23-H1 mRNA 表达的影响Table 3. Synergistic effect of DCA and VPA on nm23 -H1 mRNA expression in MGC-803 cells (±s.n=6)
**P <0.01 vs normal control group;▲▲P <0.01 vs corresponding concentration of single drug group.
Group nm23-H1/GAPDH Normal control 0.43±0.12 DCA 1.5 μmol·L -1 0.96±0.21**DCA 3.0 μmol·L -1 1.31±0.20**VPA 1.5 mmol·L -1 0.69±0.09**VPA 1.5 mmol·L -1 +DCA 1.5 μmol·L -1 1.84±0.46**▲▲VPA 1.5 mmol·L -1 +DCA 3.0 μmol·L -1 2.88±0.42**▲▲
讨 论
nm23 -H1 可通过多信号通路调控细胞活性、生长、分化,目前的研究显示B 细胞中nm23 -H1 通过上调凋亡蛋白如caspase -3、caspase -9、Bcl -X 及P53、P21 表达进而影响细胞凋亡,以及通过下调cyclin D1 表达水平引起细胞G0/G1期阻滞[6]。本研究显示,DCA 和VPA 2 种药物能促进细胞凋亡和G0/G1期阻滞,并且和DCA 呈一定的剂量依赖性。DCA和VPA 除了直接作用于细胞活性以外,两药联用还能间接增强部分肿瘤细胞的对外部处理因素的敏感性,如Lee 等[7]观察到两药联用能增强结肠癌细胞和乳腺癌细胞的辐射敏感性。本研究显示,2 种药物能共同作用于促胃癌细胞MGC -803 细胞凋亡,并且早期/中晚期凋亡率均呈DCA 剂量依赖性,其中可能和共同促抑癌基因nm23 -H1 的表达有关。在体外,在肿瘤细胞中通过载体过表达nm23 -H1 也能显示细胞多种活性受到抑制[8]。DCA 和VPA 虽都作用于转录调节,但DCA 主要通过抑制甲基化转移酶抑制剂,而VPA 主要通过抑制组蛋白去乙酰化,但对胃癌细胞的研究发现,高甲基化的、转录静止的基因通过组蛋白去乙酰化酶抑制剂和DNA 甲基转移酶抑制剂处理后能再活化,但仅用组蛋白去乙酰化酶抑制剂则收效甚微。这一研究提示了DNA 甲基化在转录调控中占主导地位,它可以通过不依赖于组蛋白去乙酰化的方式抑制基因的转录[9]。
目前临床胃癌的一线化疗方案的顺铂、表柔比星、氟尿嘧啶等药物多为细胞周期特异性或非特异性药物,通过干扰细胞分裂某一特定或多个时期实现对肿瘤细胞的增殖抑制,对正常细胞带有非特异性杀伤作用,副作用多。研究发现用表观遗传学药物治疗几种类型的血液肿瘤,起效快,副作用小,优于传统的化疗药物,但在实体瘤如胃癌中疗效却不如血液肿瘤稳定,我们认为可能和血液系统肿瘤细胞的分散相有利于充分接触药物有关。虽然本研究中观察到nm23 -H1 基因得到了激活,但由于表观遗传学药物具有激活多种抑癌基因的效果,故我们不排除两药联合作用于MGC -803 细胞凋亡中有其它抑癌基因的参与。
[1] Pasz-Walczak G,Salagacka A,Potemski P,et al.Maspin and Nm23 - H1 expression in colorectal cancer[J]. Neoplasma,2010,57(2):95 -101.
[2] Andolfo I,De Martino D,Liguori L,et al. Correlation of NM23 -H1 cytoplasmic expression with metastatic stage in human prostate cancer tissue[J]. Naunyn Schmiedebergs Arch Pharmacol,2011,384(4 -5):489 -498.
[3] Liu C,Liu J,Wang X,et al. Prognostic impact of nm23-H1 and PCNA expression in pathologic stage I non -small cell lung cancer[J]. J Surg Oncol,2011,104(2):181 -186.
[4] Iizuka N,Tangoku A,Hazama S,et al. Nm23 -H1 gene as a molecular switch between the free - floating and adherent states of gastric cancer cells[J]. Cancer Lett,2001,174(1):65 -71.
[5] Hrebackova J,Hrabeta J,Eckschlager T.Valproic acid in the complex therapy of malignant tumors[J]. Curr Drug Targets,2010,11(3):361 -379.
[6] Choudhuri T,Murakami M,Kaul R,et al. Nm23 -H1 can induce cell cycle arrest and apoptosis in B cells[J].Cancer Biol Ther,2010,9(12):1065 -1078.
[7] Lee JH,Lee KH,Lee JH,et al. Decreased incidence of febrile episodes with antibiotic prophylaxis in the treatment of decitabine for myelodysplastic syndrome[J].Leuk Res,2011,35(4):499 -503.
[8] Marino N,Marshall JC,Steeg PS. Protein-protein interactions:a mechanism regulating the anti-metastatic properties of Nm23 - H1[J]. Naunyn Schmiedebergs Arch Pharmacol,2011,384 (4 -5):351 -362.
[9] Meng CF,Zhu XJ,Peng G,et al. Promoter histone H3 lysine 9 di -methylation is associated with DNA methylation and aberrant expression of p16 in gastric cancer cells[J]. Oncol Rep,2009,22(5):1221 -1227.

