TIMP-1 B细胞表位的预测和鉴定*
杜 玲,孙 俊,刘建生,程计林△
(1上海市公共卫生临床中心消化科,2上海瑞金医院集团闵行区中心医院消化科,上海 201508)
金属蛋白酶组织抑制物-1(tissue inhibitor of metalloproteinase-1,TIMP-1)由激活的肝星状细胞、肝细胞和内皮细胞分泌表达,其主要作用是抑制胶原酶的活性,同时抑制基质分解素和明胶B[1-2]。TIMP-1可以抑制大部分基质金属蛋白酶 (matrix metalloproteinases,MMPs),尤其是MMP-1的活性,使细胞外基质(extracellular matrix,ECM)降解减少,促进肝纤维化的形成,被认为在肝纤维化进程中发挥了重要的作用[1-3]。大量研究显示,肝组织内TIMP-1水平与肝组织炎症和肝纤维化程度呈密切相关关系。已有研究表明抑制TIMP-1活性能缓解甚至抑制肝纤维化进程,因而TIMP-1成为抗肝纤维化免疫治疗的一个重要靶点[1-5]。
TIMP-1蛋白约28.5 kD,其编码基因位于X染色体p11区,含有1个开放读码区,编码208个氨基酸,蛋白的N端为主要活性区域[1-2,5-7]。基于 TIMP - 1 的一级结构,利用生物信息学技术预测TIMP-1 B细胞表位,采用8分支多重抗原肽(multiple antigen pepetide,MAP)系统设计合成多抗原肽[8-9];以白细胞介素1β(interleukin-1 beta,IL -1β)163 -171肽作为通用型辅助表位肽(T-helper epitope,TH),能增强其它抗原肽的细胞免疫和体液免疫反应[10-12]。将二者联合起来免疫动物,诱导产生多克隆抗体,应用间接酶联免疫吸附测定、免疫印迹及免疫组化鉴定多克隆抗体滴度、特异性及其抗原在组织细胞中的表达,从而获得潜在的B细胞表位肽,为以TIMP-1为靶标的抗纤维化免疫治疗研究提供前期实验依据。
材料和方法
1 材料
商品化TIMP-1重组蛋白(北京义翘神州生物技术有限公司,货号为10934-HNAH);商品化抗体为多克隆兔抗人TIMP-1蛋白抗体(Epitomics,货号为S0636)和单克隆鼠抗人TIMP-1全长蛋白抗体(Abcam,货号为ab1827);弗氏完全佐剂及不完全佐剂(Sigma-Aldrich,F5881,F5506);酶标羊抗兔IgG-HRPⅡ抗(武汉博士德生物技术有限公司,批号为BA1054);Western blotting化学发光试剂盒(上海康成生物工程公司,批号 KC-420);蛋白质 marker(Bio-Rad,批号为161-0376)。A431肺癌细胞购于上海复旦大学医学院附属中山医院肝癌研究所。白毛黑眼兔(日本大白兔的1个支系)由上海市公共卫生临床中心动物中心饲养。
2 方法
2.1 B细胞表位预测 利用DNAStar软件和BcePred在线预测工具分析人TIMP-1的208个氨基酸序列,得到其编码蛋白的物理和化学特性如亲水性、可及性及可塑性等,并由此评估TIMP-1分子高亲水性区域的抗原性。综合2种分析方法,取其预测结果的重叠区域,作为TIMP-1蛋白的候选B细胞优势表位。
2.2 B细胞表位MAP抗原肽的合成 委托吉尔生化(上海)有限公司完成。以所选氨基酸肽段为基础,采用8分支肽设计,固相合成法在多肽合成仪上合成,多肽经高压液相层析纯化,纯度达到97%以上。
2.3 MAP抗原肽与TIMP-1全蛋白抗体的结合力 分别用浓度为10 mg/L的不同MAP抗原肽或TIMP-1重组蛋白,按100 μL/well包被96孔酶联板,4 ℃过夜,封闭后,加入1∶4000稀释的商品化抗体,100 μL/well,以1:4000正常兔血清作对照。结果以双复孔A均值表示,实验重复3次。
2.4 动物分组 雄性6月龄白毛黑眼兔18只,每只体重约2.5 kg,随机分为6 组(MAP1 ~4、TIMP -1及正常组),每组3只。
2.5 免疫方法 MAP1~4组分别以8分支肽MAP为免疫原,共注射4次,每次间隔2周。首次免疫用弗氏完全佐剂,加强免疫用弗氏不完全佐剂。首次及加强免疫量为每只MAP 1 mg,TIMP组每只200 μg,同时混入等量的 TH线性短肽,溶于0.5 mL PBS中,与0.5 mL弗氏佐剂乳化后,在背部皮内作多点注射。正常组每只采用0.5 mL PBS与等量弗氏佐剂完全乳化后注射。
2.6 标本采集与抗体检测 首次免疫前及每次免疫10 d后采血,共采血5次。前4次耳中央动脉采血,最后1次采取颈总动脉放血,收集血液并分离血清。采用标准间接ELISA法测定血清中抗体滴度,分别用浓度为10 mg/L的MAP、TIMP-1重组蛋白及TH肽,按100 μL/well包被96孔酶联板,4℃过夜,封闭后,Ⅰ抗为倍比稀释的待测动物免疫血清,免疫前血清作阴性对照,结果以双复孔A均值表示,实验重复3次。以待测标本A值/阴性对照A值>2.1为阳性标准,以出现阳性反应的最高稀释度作为该样本中抗体滴度。
2.7 蛋白电泳及蛋白印迹分析 将传代培养的A431肺癌癌细胞(3×107)裂解后提取细胞蛋白,蛋白质的SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)参考 Laemmli等[13]的方法。Ⅰ抗分别为自制的MAP或TIMP-1兔血清抗体或商品化TIMP-1抗体,稀释度为1∶3000,(商品化抗体稀释度为1∶200),以免疫前兔血清作阴性对照。
3 统计学处理
应用SPSS 13.0软件进行统计学处理,数据以均数±标准差()表示,多个样本均数比较应用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 B细胞表位预测与多肽合成
BcePred分析预测TIMP-1可能的B细胞表位排名如下(95~109:YFHRSHNRSEEFLIA;133~147:LAQRRGFTKTYTVGC;57~71:LYQRYEIKMTKMYKG;27~41:VPPHPQTAFCNSDLV;193 ~207:EPGLCTWQSLRSQIAL),而DNAStar软件预测TIMP-1 B细胞表位排名为(95~109位,133~147位,57~71位,27~41位,173~187:QLLQGSEKGFQSRH,193~207位肽段)。2种方法所得结果基本一致。综合2种分析方法,可以认为4个肽段具有良好的亲水性、可及性及可塑性,在二级结构上位于蛋白伸展结构或无规则卷曲结构内,最可能为其优势B细胞表位。因此,我们以TIMP-1氨基酸序列为基础分别合成4个8分支肽MAP,见表1。

表1 BcePred和DNAStar联合预测的TIMP-1 B细胞抗原表位Table1.The B-cell epitopes predicted by BcePred and DNAS-tar softwares
2 合成MAP与TIMP-1全蛋白抗体的结合力
利用间接ELISA检测所合成的MAP多肽与TIMP-1全长蛋白免疫抗体的结合力,结果发现MAP4多肽与TIMP-1全蛋白抗体的结合力明显强于 MAP1、MAP2和 MAP3,见图1。
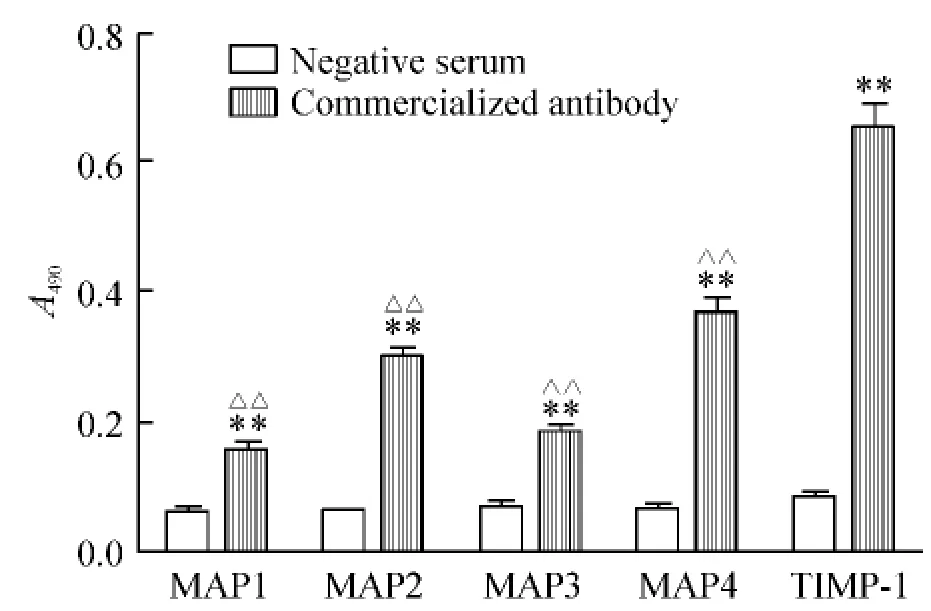
Figure1.Binding affinity of different MAPs with the commercialized rabbit anti-TIMP-1 antibody and control rabbit serum..n=3**P<0.01 vs negative serum;△△P<0.01 vs TIMP -1.图1 不同MAP与商品化TIMP-1抗体(单克隆鼠抗人TIMP-1全长蛋白抗体ab1827)的结合力
3 兔抗体滴度的动态变化
首次免疫10 d后即可检出特异性抗体,MAP2、MAP3和MAP4免疫后3只兔子的平均最高抗体滴度为1∶80000、1∶8000和1∶120000。MAP2免疫的抗体滴度在第3次免疫后达高峰,MAP4免疫的抗体滴度在第3次免疫后达到平台期,MAP3免疫的抗体滴度在第2次免疫后达到平台期,对照组无抗体产生,TH肽与3种抗血清均无反应,且4种MAP免疫血清与4种MAP之间均无交叉反应,见图2。

Figure2.Dynamic changes of anti-MAP antibody titers in rabbit serum..n=3**P<0.01 vs MAP1;△△P<0.01 vs MAP2.图2 不同MAP免疫后兔血清特异性抗体滴度动态变化
4 蛋白电泳及蛋白印迹分析
以提取的A431细胞总蛋白为样品,分别用MAP1-4抗血清与之反应,用商品化兔抗人TIMP-1抗体作阳性对照,用相应兔免疫前血清作阴性对照。商品化抗体在分子量约28.5 kD处出现1条清晰条带,MAP1~4及重组TIMP-1抗血清均在分子量28.5 kD处出现清晰条带。依据商品化抗体说明书,28.5 kD处为TIMP-1蛋白。阴性对照在无明显条带出现,见图3。
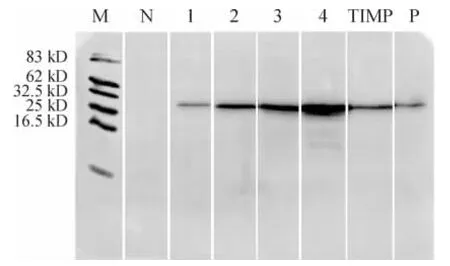
Figure3.Specificity of the rabbit antisera against MAPs detected by Western blotting.M:protein marker;N:negative control,THpeptide antiserum;1~4:MAP1~4 antisera;TIMP:TIMP -1 antiserum;P:positive control,TIMP-1 rabbit antibody S0636.图3 蛋白免疫印迹分析4种MAP兔抗血清抗体的特异性
讨 论
肝纤维化是各种慢性肝病所引起的慢性肝损伤,对于中国为数众多的肝炎患者,干预肝纤维化的形成与发展对防治肝硬化具有重要意义[15]。目前一般选用药物对肝纤维化发生发展的不同环节入手进行干预,但疗效欠佳,且需长期服药。不仅增加了患者和社会的成本,而且严重降低了生活质量。因此,发展包括免疫治疗在内的新型肝纤维化治疗方法势在必行,本研究拟筛选和鉴定TIMP-1的多抗原肽疫苗,试图通过多抗原肽免疫抑制TIMP-1功能甚至逆转肝纤维化进程,从而为肝纤维化的治疗提供新的思路。
针对肝纤维化发生和发展过程中的主要环节,ECM的降解异常是肝纤维化的一个重要因素。ECM的降解主要由一组依赖锌的中性蛋白酶——MMP介导。TIMP是MMP的特异性抑制剂,在ECM的代谢调节中,是与MMP对应的副调节剂。最近,在大鼠肝纤维化自发逆转模型上的研究发现,纤维化的逆转伴随TIMP-1和TIMP-2表达的迅速下降,MMP的mRNA表达无变化,而其活性显著增加,表明TIMP降低可提高MMP活性,使ECM降解重建[1-3]。而且,国内最近也有文献报道直接将MMP表达载体导入纤维化大鼠肝内,其逆转纤维化的作用有限,这从侧面提示MMP活性的抑制物TIMP可能在肝纤维化发生机制中的作用更为重要[3]。
诱导针对特异性肿瘤抗原或标志物的体内免疫反应是当前重要的免疫治疗策略,但肿瘤抗原一般具有很低的免疫原性,难以获得理想的免疫反应强度;因此筛选获得重要的B细胞表位并辅以T细胞抗原肽共同免疫是理想的解决方案。另外,免疫反应性弱,难以诱导产生有效的免疫反应等也是多肽应用的瓶颈所在。因此本研究基于前期对肝素酶表位肽疫苗免疫策略的探讨,建立了诱导高滴度体液免疫反应的方法[14],并将以此实现对TIMP-1的抑制作用:利用TIMP-1 B细胞免疫优势表位,通过优化的免疫策略(MAP+T细胞表位肽)在体内诱导高滴度抗体,从而抑TIMP-1活性。这里我们仅针对TIMP-1蛋白的B细胞表位,而不是针对T细胞表位研究,因为我们主要是想通过B细胞表位肽来激活保护性的体液免疫,而不是激活具有杀伤性的细胞免疫,毕竟表达TIMP-1的主要细胞——肝星状细胞也是分泌MMP的主要细胞,我们没必要对其进行杀伤。
为验证预测的B细胞表位是否具有特异性免疫原性,我们人工合成相应的MAP,并与T辅助表位肽一起免疫兔子后,得到多克隆抗血清。ELISA结果显示,MAP2、MAP3和MAP4均能在体内诱导产生 TIMP-1特异性抗体,其中MAP2和MAP4能诱导高滴度抗体,且与全长商品化抗体显示了较高的亲和力。这一结果提示,MAP2和MAP4为抗原优势表位,以其作为免疫原将可能诱导针对TIMP-1的特异性体液免疫反应。针对TIMP-1的免疫治疗尚需更深入的研究去阐明这些抗原表位是否为TIMP的中和性表位,即它们诱导产生的抗体能否在与TIMP-1结合后,抑制后者活性,而起到抑制肝纤维化进程的作用。
[1]褚云香,郑 勇.MMP-1、TIMP-1及其在肝纤维化中的作用[J].国际消化病杂志,2006,26(3):109-112.
[2]邹海峰,刘 洋,徐华锋,等.TIMP-1在肝纤维化形成过程中的作用[J].哈尔滨医科大学学报,2005,39(5):25-28.
[3]杨长青,胡国龄,谭德明,等.实验性肝纤维化时MMP-1、TIMP-1的表达与Ⅰ、Ⅲ型胶原含量变化的关系[J].临床肝胆病杂志,2000,16(4):222-224.
[4]赖 辉,黄 飞,向光明,等.金属蛋白酶组织抑制因子-1 RNA干扰靶位的筛选[J].四川医学,2009,30(5):1215-1217.
[5]Adams LA.Biomarkers of liver fibrosis[J].J Gastroenterol Hepatol,2011,26(5):802 -809.
[6]O’Shea M,Willenbrock F,Williamson RA,et al.Sitedirected mutations that alter the inhibitory activity of the tissue inhibitor of metalloproteinases-1:importance of theN-terminal region between cysteine 3 and cysteine 13[J].Biochemistry,1992,31(7):10146-10152.
[7]Yoshiji H,Kuriyanta S,Miyamoto Y,et al.Tissue inhibitor of metalloproteinase-1 promotes liver fibrosis development in atransgenic mouse model[J].Hepatology,2000,32(8):1248-1254.
[8]Amexis G,Yong NS.Multiple antigenic peptides as vaccine platform for the induction of humoral responses against dengue-2 virus[J].Viral Immunol,2007,20(4):657 -663.
[9]Haro I,Gómara MJ.Different approaches to potentiate the immune response induced by a 12-Mer synthetic peptide[J].Curr Protein Pept Sci,2000,1(2):125 -137.
[10]Rovero S,Boggio K,Carlo ED,et al.Insertion of the DNA for the 163-171 peptide of IL1β enables a DNA vaccine encoding p185neuto inhibit mammary carcinogenesis in Her- 2/neu transgenic BALB/c mice[J].Gene T-her,2001,8(6):447 -452.
[11]Dechamma HJ,Dighe V,Kumar CA,et al.Identification of T-helper and linear B epitope in the hypervariable region of nucleocapsid protein of PPRV and its use in the development of specific antibodies to detect viral antigen[J].Vet Microbiol,2006,118(3-4):201-211.
[12]Boraschi D,Tagliabue A.Interleukin-1 and interleukin-1 fragments as vaccine adjuvants[J].Methods,1999,19(1):108-113.
[13]Laemmli UK.Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].Nature,1970,227(5259):680-685.
[14]杜 玲,王惠菊,杨建民,等.TH线性肽对人肝素酶B细胞表位多抗原肽的免疫增强作用[J].中华微生物学和免疫学杂志,2008,28(10):869-872.
[15]陈丽霞,刘立新,张海燕,等.抗IGFBPrP1抗体对小鼠肝纤维化的预防作用及其机制的研究[J].中国病理生理杂志,2010,26(11):2185-2190.

