杆状病毒表面展示丙型肝炎病毒结构蛋白及其对丙型肝炎病毒的检测*
李 祥,金爱慧,邹立林,高基民,吕建新
(温州医学院浙江省医学遗传学重点实验室,浙江省模式生物技术与应用重点实验室,浙江 温州 325035)
丙型肝炎是一种主要经血液传播的疾病,丙型肝炎病毒(hepatitis C virus,HCV)慢性感染可导致肝脏慢性炎症性坏死和纤维化,部分患者可发展为肝硬化甚至肝细胞癌(hepatic celluler cancar,HCC)。因此,肝炎病毒的早期检测对治疗和防御疾病的恶化至关重要。
近年来,国内外对HCV的检测技术越来越先进,如PCR技术和基因芯片的应用等。HCV-RNA核酸扩增检测技术(nucleic-acid amplification technology,NAT)可精确地检测血清中HCV的载量,是预测和观察抗病毒效果的重要指标。但HCV RNA在达到峰值或重新出现前数天或数周内偶尔也可能检测不到[1]。此外,其它很多因素也影响患者的HCV检出率。目前,美国已采用了RIBA 3.0试剂检测技术来检测HCV,但是抗-HCV检测方法阳性率低。另外,由于“窗口期”的存在,仍有一定的漏检率[2]。
对于抗-HCV的检测,核心蛋白(core,C)和外膜蛋白(envelope,E)被认为能有效提高抗-HCV的灵敏度,但其对抗体的检出率依赖于抗原的获得方法,可能与抗原的构象表位有关[3-4]。而开发HCV抗体蛋白芯片检测技术已经成为科研人员关注的热点。在HCV检测中,加强和扩大对HCV不同编码区的抗体检测,是近年来该领域研究的一个新热点,它直接关系到检测技术的准确率和应用率。
杆状病毒表面展示(baculovirus surface display)系统是在对病毒基因组结构和功能深刻认识的基础上发展起来的。通过在病毒衣壳蛋白插入外源肽、与衣壳蛋白融合表达或与特异性的锚定部位结合,杆状病毒表面展示系统可以在被感染细胞或病毒粒子的表面大量展示目的多肽或蛋白[5-6],而且还能对外源蛋白进行糖基化加工和折叠等翻译后修饰,尤其适合于展示需要特异的翻译后加工才能有效折叠和具有生物活性的细胞表面蛋白和分泌蛋白[5,7]。目前研究及应用最为广泛的杆状病毒表面展示系统是苜蓿银纹夜蛾核多角体病毒(Autographa canifornica multiple nucleopolyhedrovirus,AcMNPV)表面展示系统[6,8],效率最高的展示措施是将外源肽或蛋白与膜融合蛋白GP64融合形成融合蛋白。外源蛋白插入N端信号肽后与GP64融合,加工后信号肽被切除,形成的N端融合蛋白可以稳定地表达在病毒粒子的表面[9]。
本实验根据杆状病毒表面展示系统的特点,我们将HCV的C、E1和E2抗原两两融合或三者融合构建成重组杆状病毒并将这些蛋白表达在病毒粒子的表面;将重组杆状病毒粒子经过浓缩纯化后对HCV的样品进行检测。
材料和方法
1 细胞系和病毒
实验所使用的昆虫细胞系为Sf9。Sf9来源于Spodoptera frugiperda(草地夜蛾)卵巢细胞,由中国科学院武汉病毒研究所中国典型培养物保藏中心(CCTCC,武汉)。Sf9传代培养采用25 cm2的培养瓶以单层细胞的形式多次传代,培养基为含10%胎牛血清的Grace培养基(Gibco-BRL),培养温度为27℃。
2 主要试剂和仪器
限制性核酸内切酶、核酸分子量marker、T4 DNA连接酶及其配套缓冲溶液均购自TaKaRa。PCR产物回收试剂盒和质粒纯化试剂盒购自V-Gene。HCV C抗体、Cy3标记的羊抗小鼠IgG、碱性磷酸酶标记的羊抗小鼠IgG和小鼠抗人IgG购自深圳晶美生物公司;NBT和BCIP溶液购自碧云天生物公司。HCV抗体ELISA试剂盒购自上海科华公司。分析缓冲液、增强液等购自广州达瑞公司,时间分辨荧光免疫分析仪购自PE。
3 主要方法
3.1 重组病毒的构建及其制备 我们首先将经PCR获得的HCV C、E和CE基因分别插入pSKF64载体的Sal I和Pst I及Pst I和Xba lI位点(C基因上游引物5'-GGG CTG CAG GAG CAC TGC AAC GCG CAA -3',下游引物 5'-GGG AAG CTT TTA ATA TTG TCT ATT ACG GTT TCT AA-3';E基因上游引物5'-GGG AGA TCT TAC CAA GTG CGC AAT TCC-3',下游引物 5'- GGG GAA TTC GCC GCT ACC CGA GCC CGC CTC CGC TTG GGA TAT-3';CE基因上游引物5'-GGG ACT AGT ATG AGC ACG AAT CCT AAA CCT -3',下游引物5'-GGG CTG CAG CGC CTC CGC TTG GGA TAT-3'),这些质粒分别被命名为pSKF-C/E/CE。在此基础上将Flag、信号肽及HCV C、E和CE基因通过Sal I和Pst I及Pst I和Xba lI位点一起克隆到pFastbacDual-GFP载体的相同位点,分别命名为 pFBDeGFP-Flag-HCV C-GP64、pFBDeGFP-Flag-HCV E-GP64和pFBDeGFP-Flag-CE-GP64。然后通过Bac-to-Bac系统将pFBDeGFP-Flag-HCV C-GP64、pFBDeGFP-Flag-HCV E-GP64和pFBDeGFP-Flag-CEGP64质粒转座到Ac-bacmid中,经PCR鉴定正确后分别命名为Ac-Flag-HCV C-GP64、Ac-Flag-HCV E-GP64和Ac-Flag-CE-GP64。在35 mm的培养皿中接种1×106的Sf9细胞,27℃培养过夜;弃去上层培养基,加入1 mL不含血清的培养液洗涤细胞2次,再加入1 mL不含血清的培养基于27℃培养0.5 h以上;在细胞室中将1~2 μg重组bacmid DNA与10 μL cellfectin分别用无血清Grace稀释至50 μL,5 min后将DNA加入稀释后的cellfectin中,每隔5 min轻轻混匀1次,45 min后在聚丙烯管中轻轻加入900 μL不含血清的Grace培养基,混匀。弃去35 mm培养皿中的培养基,加入含有转染混合物的Grace培养基,28℃温箱培养;6 h后用含10%血清的Grace培养替换原有的培养基;3 d后若观察到GFP表达说明重组病毒包装成功,收集细胞上清(重组病毒)保存或进行再次感染进行功能分析。
3.2 Western blotting 收集病毒感染72 h的Sf9细胞总蛋白,用SDS-PAGE上样缓冲液裂解。煮沸10 min后进行SDS-PAGE(7.5%),用半干法将胶上蛋白转移到硝酸纤维素膜上。封闭液(含5%脱脂奶粉的TBS)封闭1 h后,以溶解一定浓度Ⅰ抗的封闭液4℃过夜。经TBST洗脱后,以溶解一定碱性磷酸酶标记的Ⅱ抗封闭液孵育1 h,经TBST洗脱后,BCIP/NBT显色检测。
3.3 免疫荧光染色 在22 mm×22 mm的1.5号玻璃盖玻片上培养细胞,用含2%多聚甲醛的 PBS(pH 7.4)溶液在20℃固定细胞15 min。用 PBS(pH 7.4)洗 3次,每次 10 min;用含0.2%Triton X-100和1%正常山羊血清(normal goat serum,NGS)的PBS溶液在冰上,透化5 min;用PBS加1%NGS洗3次,每次10 min;在盖玻片上加30 μL稀释的抗体,并将盖玻片倒置在玻璃载玻片上,然后将载玻片放到湿盒里以室温孵育1 h;用PBS加1%NGS洗3次,每次10 min;在湿盒里与稀释为4 mg/L的Ⅱ抗,室温孵育1 h;用PBS洗4次,每次10 min;将盖玻片封在载玻片上。用激光共聚焦扫描显微镜进行观察。
3.4 重组出芽病毒(budded virus,BV)的纯化 重组病毒的BV来源于经细胞培养扩增后的培养基上清。病毒的扩增如下,在75 cm2培养瓶中按感染复数(multiplicity of infection,MOI)=0.1加入杆状病毒的BV,25℃温箱培养,当BV的产量达到最高峰时收集含有BV的培养液。含有病毒的培养液收集后,于1000×g离心10 min,收集上清。收集的上清于4℃、50000×g离心1 h,弃上清,沉淀溶解在PBS溶液中。然后将其加在经梯度混合仪制成的25%~56%的蔗糖梯度上,于4℃、100000×g离心2 h;在45%蔗糖浓度的部位有白色带出现,即重组病毒BV。收集病毒带,转移至1个新的离心管中,用PBS稀释10倍。稀释后的病毒液在4℃、50000×g离心1 h,弃上清,沉淀溶解在PBS溶液中,病毒粒子经负染后,用透射电子显微镜(H-7000FA)鉴定纯度。
3.5 免疫胶体金标记 将镍网在纯化好的BV样品液中悬滴反应5 min;在滤纸上晾干4℃过夜;再用含5%牛血清白蛋白(bovine serium albumin,BSA)的PBS(pH 7.2)悬滴反应30 min;取出镍网用0.1%BSA的 TBS(pH 7.4)稀释抗体(1∶500)作用1 h;然后用 0.1%BSA 的 TBS(pH 7.4)洗涤 3次(每次5 min);再用0.1%BSA的TBS(Tris-HCl缓冲盐溶液,pH 8.2)稀释胶体金(1∶25)作用 1 h 后用 0.1%BSA 的TBS洗涤3次(每次5 min);最后用2%磷钨酸(phosphotungstic acid,PTA)染色3 min,进行电镜观察。
3.6 间接时间分辨荧光免疫分析法(time-resolved fluoroimmunoassay,TRFIA)检测临床样本HCV IgG (1)固相包被板的制备:分别将HCV C、E、CE的重组杆状病毒上清用包被液(50 mmol/L,pH 9.6 的碳酸盐缓冲液)稀释为1 mg/L,100 μL每孔加入96孔板中,于4℃过夜。弃去包被液,加入封闭液(去金属离子的 20 g/L BSA),150 μL/well,于 37 ℃ 3 h弃去封闭液真空抽干,-20℃保存。(2)Eu3+标记鼠抗人IgG的制备与纯化:将0.5 mg鼠抗人IgG加入到带有滤膜的离心管中,以8000 r/min离心3 min。用标记缓冲液 (50 mmol/L Na2CO3,pH 9.5)重复洗涤6 次后,将250 μL 标记抗体和0.5 mg Eu3+标记试剂混匀后于4℃过夜。将标记抗体加入到Sephadex G-50层析柱(1×30 cm)中,用洗脱液洗脱。收集流出液(1 mL/tube),测定蛋白含量,合并洗脱峰的各管。(3)间接TRFIA检测人HCV IgG程序:向包被板中加90 μL样品稀释液,10 μL质控血清或临床病人血清,室温孵育1 h。用洗涤液洗板4次,拍干。再加入1∶200稀释的Eu3+标记鼠抗人IgG 100 μL,于室温孵育40 min。用洗涤液洗板6次,拍干。最后加入200 μL增强液振摇5 min后由时间分辨荧光免疫分析仪检测荧光值。
4 统计学处理
采用SPSS 13.0软件进行分析,配对数据用McNemer检验。
结 果
1 重组Bacmid的构建
利用AcMNPV Bac-to-Bac系统,分别以pFBDeGFPFlag-HCV C-GP64、pFBDeGFP-Flag-HCV E-GP64和pFBDeGFP-Flag-CE-GP64质粒转座含有辅助质粒(helper plasmid)与Ac-bacmid(AcMNPV的Bac to Bac系统)的大肠杆菌DH10B,得到重组AcMNPV bacmid:Ac-Flag-HCV C-GP64、Ac-Flag-HCV E-GP64和Ac-Flag-CE-GP64,见图1A。利用M13F(M13上游引物)和目的基因下游引物(HCV C下游引物5'-GGG GGA TCC TGT CGT GGC GAT TGT AGC ACG AAT CCT AAA C-3';HCV E下游引物:5’-GGG CTG CAG CGC CTC TTG GGA TAT-3’)进行 PCR 鉴定:分别产生了3.3 kb、4.4 kb 和 5.0 kb 左右的带,见图 1B,表明目的片段插入的位置正确。将重组bacmid DNA分别转染Sf9细胞得到重组病毒vAc-Flag-HCV C-GP64、vAc-Flag-HCV E-GP64和 vAc-Flag-CE-GP64。同时构建vAc-bacmid-GFP作为对照病毒。
2 Western blotting检测
分别收集重组病毒感染后的细胞,检测目的蛋白的表达。免疫印迹显示当用HCV C抗体检测时,重组病毒vAc-Flag-HCV C-GP64的样品有21 kD的特征带,见图2A,重组病毒vAc-Flag-CE-GP64的样品有84 kD的特征带出现,见图2C。当用HCV E抗体检测重组病毒vAc-Flag-CE-GP64的样品时,出现63 kD的特征带,见图2B。在这些检测过程中,对照病毒vAc-bacmid-GFP感染的样品中无这些特征带出现。Western blotting结果证明能够在vAc-Flag-HCV C-GP64、vAc-Flag-HCV E-GP64和vAc-Flag-CE-GP64感染的细胞中检测到目的蛋白的表达,说明HCV C、E和CE能够成功展示在重组病毒粒子的表面。
3 HCV C、E和CE融合蛋白在被感染sf9细胞上的定位
重组病毒 vAc-Flag-HCV C-GP64、vAc-Flag-HCV E-GP64和vAc-Flag-CE-GP64和野生型病毒AcMNPV以10 MOI感染接种于盖玻片上的sf9细胞,在感染后72 h观察细胞内红色荧光的分布情况。在对照病毒vAc-bacmid-GFP感染后的细胞内和细胞膜上均未观察到红色特异性荧光;而在重组病毒感染后的细胞膜上看到一圈强烈的红色特异性荧光(代表HCV C、E和CE融合蛋白),细胞内则未出现红色荧光,见图3。这说明HCV C、E和CE融合蛋白最终是定位在被感染Sf9细胞的膜上,随后在病毒粒子出芽过程中整合到病毒粒子上。
4 HCV C、E和CE融合蛋白在BV上的定位
图4显示,在重组病毒 vAc-Flag-HCV C-GP64(图4B)、vAc-Flag-HCV E-GP64(图4C)和vAc-Flag-CEGP64(图4D)的BV上看到了大量的黑色金颗粒,对照病毒vAc-bacmid-GFP的BV上没有(图4A)。这表明HCV C、E和CE融合蛋白展示在BV囊膜上。
5 间接TRFIA检测人HCV IgG
收集温州医学院第二附属医院丙型肝炎患者血清106例,分别以间接ELISA和间接TRFIA检测人HCV IgG。TRFIA检测时,分组如下:TRFIA(C):包被HCV C重组杆状病毒;TRFIA(E):包被HCV E重组杆状病毒;TRFIA(C+E):包被HCV C重组杆状病毒和HCV E重组杆状病毒;TRFIA(CE):包被HCV CE重组杆状病毒。
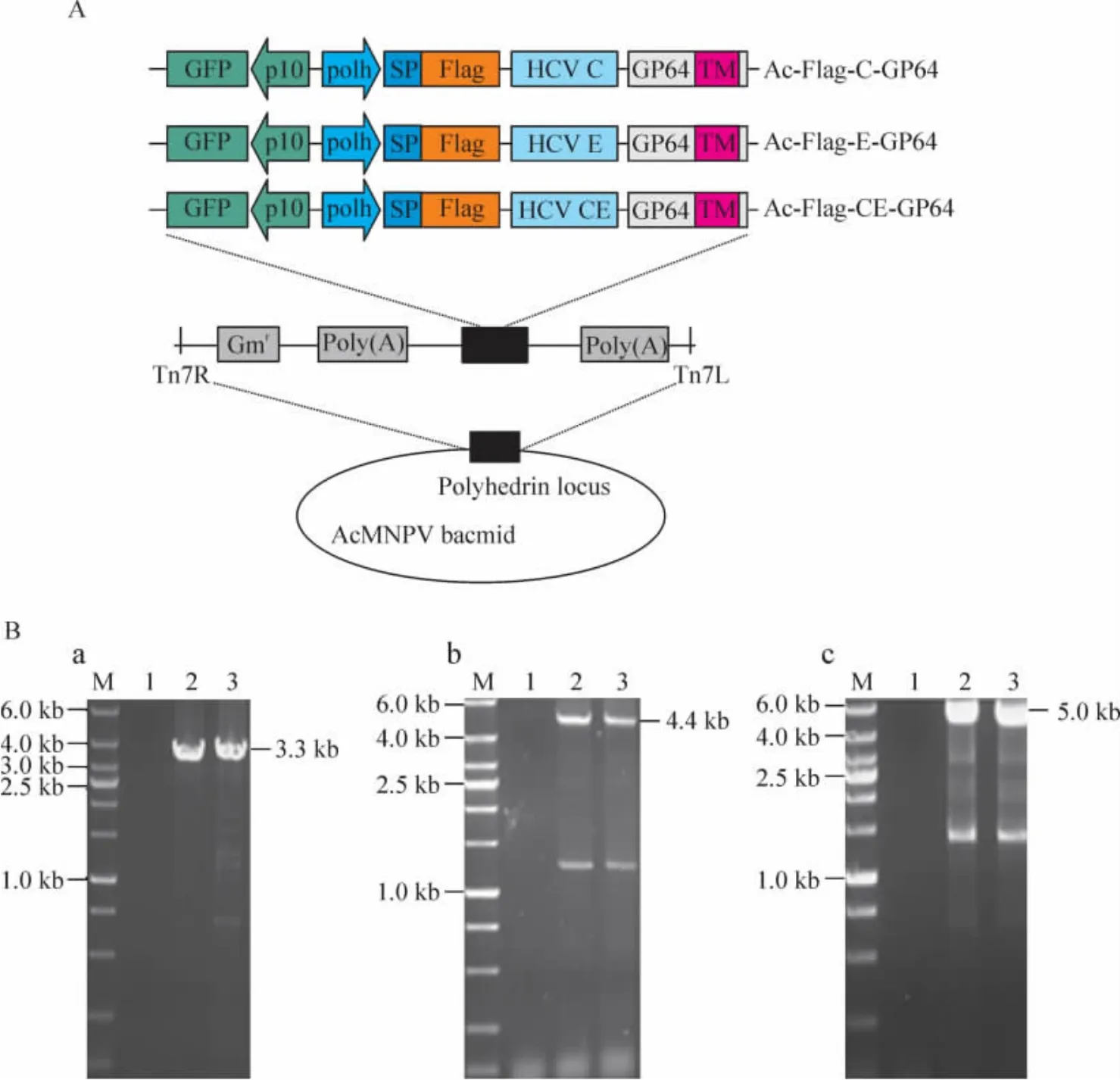
Figure1.Construction of the recombinant bacmids.A:the strategy for insertion of the gene cassettes into the polyhedrin locus of the Ac-MNPV bacmid.FLAG-HCV C,E or CE was fused with AcMNPV GP64 protein after the signal peptide(SP).The cassettes depicted were inserted into the attB site(indicated by right and left insertion sites,Tn7R and Tn7L)in the polyhedrin locus by Tn-based transposition and generated the recombinant bacmids,Ac-Flag-C-GP64,Ac-Flag-E-GP64 and Ac-Flag-CE-GP64.B:identification of recombinant bacmids by PCR.a:Ac-Flag-C-GP64(using M13 forward primer and HCV C reverse primer).1:negative control;2,3:Ac-Flag-C-GP64.b:Ac-Flag-E-GP64(using M13 forward primer and HCV E reverse primer).1:negative control;2,3:Ac-Flag-E-GP64.c:Ac-Flag-CE-GP64(using M13 forward primer and HCV E reverse primer).1:negative control;2,3:Ac-Flag-CE-GP64.图1 重组病毒的构建

Figure2.Expression of fusion proteins in Sf9 cells infected with recombinant viruses was detected by Western blotting.M:protein marker;1:negative control(vAc-bacmid-GFP);2:vAc-Flag-C-GP64(A),vAc-Flag-E-GP64(B)or vAc-Flag-CE-GP64(C).图2 重组病毒蛋白在Sf9细胞中的表达
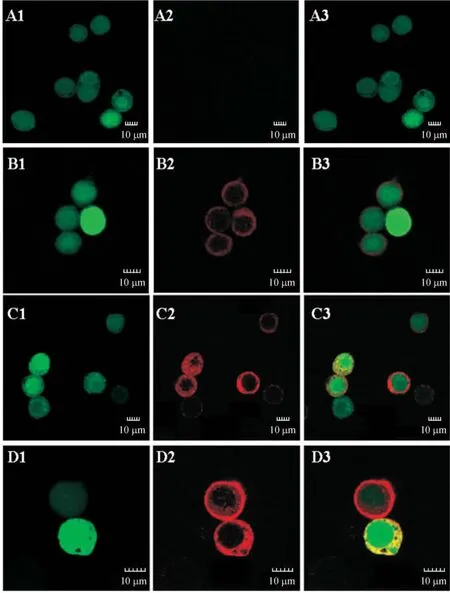
Figure3.Immunofluorescence analysis of HCV C,E and CE expression in infected Sf9 cells using an anti-HCV core monoclonal antibody.Sf9 cells were infected with vAc-bacmid-GFP(A),vAc-Flag-C-GP64(B),vAc-Flag-E-GP64(C)and vAc-Flag-CE-GP64(D)at multiplicity of infection(MOI)of 10 and were examined under confocal microscope.1:green fluorescent(GFP);2:red fluorescent(Cy3 - labeled HCV C,E or CE);3:merged images.图3 HCV C,E和CE融合蛋白在感染的Sf9细胞中的分布
ELISA检测丙型肝炎患者HCV抗体的阳性率为84.0%(89/106);TRFIA(C)和TRFIA(E)检测阳性率分别为58.5%(62/106)、53.8%(57/106),与 ELISA 检测具有统计学差异。TRFIA(C+E)和TRFIA(CE)检测阳性率分别为78.3%(83/106)和80.2%(85/106),与ELISA检测结果无统计学差异,见表1。
TRFIA和ELISA检测HCV抗体的灵敏度比较:将HCV抗体阳性质控血清以 PBS 溶液进行 1(未稀释)、2、4、8、16、32、64、128 倍稀释,以 ELISA 和 TRFIA(C)、TRFIA(E)、TRFIA(C+E)和TRFIA(CE)进行检测。TRFIA(C+E)和TRFIA(CE)的检测敏感性高于ELISA,TRFIA(C)检测敏感性和ELISA基本相同,TRFIA(E)的检测敏感性略低于ELISA,见表2。
讨 论
丙型肝炎是一种流行较为广泛的病毒性疾病。据估计,全球有1.7亿人口,即全世界人口的3%左右感染了HCV(世界卫生组织,1999年)。而且,每年有300~400万新发病例。在HCV感染者中,实际上仅有20%的患者被诊断出丙型肝炎。HCV慢性感染可导致肝脏慢性炎症坏死和纤维化,部分患者可发展为肝硬化甚至 HCC[10]。因此加强对HCV的检测具有十分重要的意义。但是由于感染HCV后血中抗体(抗-HCV)出现时间晚,从HCV感染后到抗体转阳的时间平均为50~70 d,有的患者可延长至6~9个月,检测的“窗口期”较长。对于抗-HCV的检测,C和E蛋白被认为能有效提高抗-HCV的灵敏度[11-12]。因此在HCV检测中,加强和扩大对HCV不同编码区的抗体检测,它直接关系到检测技术的准确率和应用率。

Figure4.Electron micrograph of immunogold-labeled purified vAc-bacmid-GFP(A),vAc-Flag-C-GP64(B),vAc-Flag-E-GP64(C)and vAc-Flag-CE-GP64(D)BVs.BVs were probed using anti-HCV core antibody counterstained with gold spheres coupled to anti-mouse IgG.图4 免疫胶体金检测HCV C,E和CE在BV上的定位
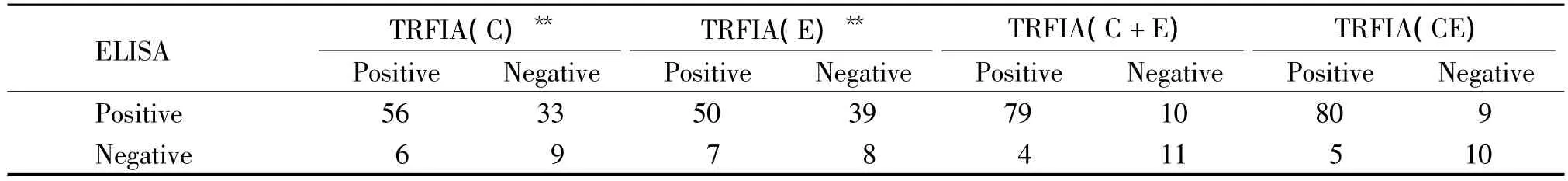
表1 丙型肝炎患者血清的TRFIA和ELISA检测结果Table1.Results of serum of patients with HCV detected by TRFIA and ELISA(n=106)
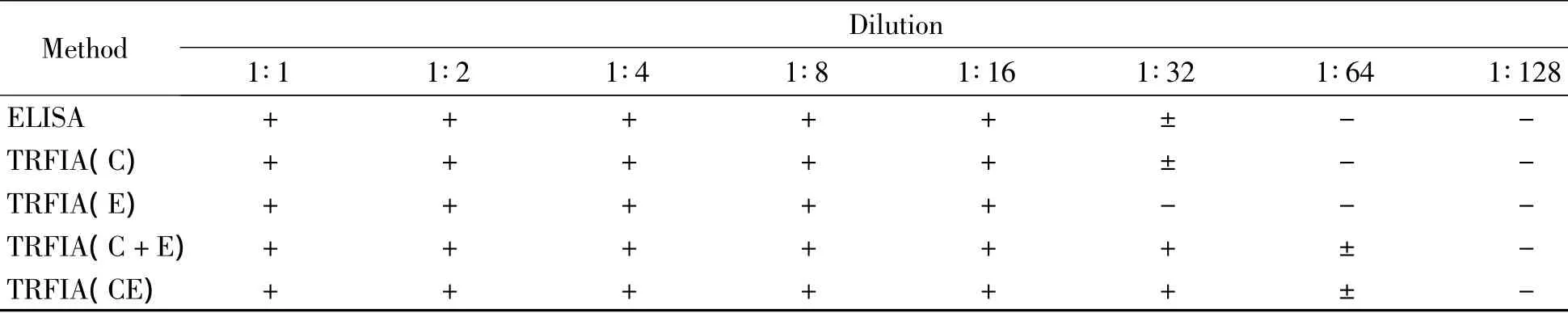
表2 TRFIA和ELISA检测的灵敏度比较Table2.Comparison of the sensitivity between TRFIA and ELISA
杆状病毒展示系统具有许多优点,能够通过在病毒基因组上直接克隆展示片段或在感染昆虫细胞表面表达以及在病毒颗粒表面表达来展示抗原产生抗体及进行疫苗相关研究展示复杂有活性的蛋白[13-14]。由于杆状病毒展示表面展示系统的优点,使其在高亲和力抗体及多肽药物的筛选、蛋白质抗原表位分析、新受体及天然配体结合结构域的识别和鉴定、药物(激动剂和多肽药物)筛选、设计和制备、重组疫苗的建立、酶的固定化和再生等方面具有广阔的应用前景[11-12,15]。
为了提高HCV的检测率,本实验通过杆状病毒表面展示系统构建了HCV C、E和CE融合蛋白的重组病毒。通过Western blotting检测发现在重组病毒感染的细胞中有HCV C、E和CE蛋白的存在(图2);同时免疫荧光染色结果表明HCV C、E和CE融合蛋白定位在被感染Sf9细胞的膜上(图3)。进一步,免疫胶体金技术将HCV C、E和CE融合蛋白定位于BV的囊膜上(图4),表明成功地将HCV C、E和CE融合蛋白展示在病毒的表面。对重组病毒浓缩后,建立时间分辨荧光免疫技术检测HCV抗体的方法,与ELISA进行比较,包被有2种蛋白的TRFIA(C+E)和TRFIA(CE)的检测敏感性高于ELISA,而只包被一种蛋白的TRFIA(C)或TRFIA(E)检测敏感性和ELISA基本相同。用HCV临床样本进行检测,结果显示单独包被HCV C重组病毒或HCV E重组病毒的TRFIA检测阳性率明显低于ELISA检测,这是由于ELISA试剂盒的微孔板上包被了更多的HCV特异性蛋白,提高了HCV抗体的检出率;包被HCV CE重组病毒时TRFIA检测阳性率为80.2%,明显高于单独包被HCV C和HCV E重组病毒的TRFIA检测,接近目前使用的ELISA检测试剂盒。我们拟通过改进浓缩纯化的方法和工艺,进一步提高丙型肝炎的诊断敏感性,为HCV抗体检测带来新的希望。
[1]陈朝霞,闵保华,陈延平.影响HCV-RNA荧光定量PCR检测的因素及其对策[J].国际检验医学杂志,2007,28(2):175-176.
[2]谢 立,吴晓东.丙型肝炎病毒检测方法的研究进展及其临床意义[J].世界华人消化杂志,2005,13(7):884-886.
[3]魏葆珺,李金明.丙型肝炎病毒感染筛检中抗原表位的应用及其研究进展[J].中华肝脏病杂志,2006,14(12):955-957.
[4]邵圣文,武文斌,于建国,等.丙型肝炎病毒F蛋白抗原性及患者血清F抗体流行率的研究[J].中华肝脏病杂志,2006,14(12):890-893.
[5]Grabherr R,Ernst W,Oker- Blom C,et al.Developments in the use of baculoviruses for the surface display of complex eukaryotic proteins [J]. Trends Biotechnol,2001,19(6):231-236.
[6]Kaba SA,Hemmes JC,van Lent JW,et al.Baculovirus surface display of Theileria parva p67 antigen preserves the conformation of sporozoite - neutralizing epitopes[J].Protein Eng,2003,16(1):73-78.
[7]Ernst WJ,Spenger A,Toellner L,et al.Expanding baculovirus surface display.Modification of the native coat pro-tein gp64 of Autographa californica NPV[J].Eur J Biochem,2000,267(13):4033-4039.
[8]Rahman MM,Gopinathan KP.Bombyx mori nucleopolyhedrovirus-based surface display system for recombinant proteins[J].J Gen Virol,2003,84(Pt 8):2023 -2031.
[9]Boublik Y,Di Bonito P,Jones IM.Eukaryotic virus display:engineering the major surface glycoprotein of the Autographa californica nuclear polyhedrosis virus(AcNPV)for the presentation of foreign proteins on the virus surface[J].Biotechnology(N Y),1995,13(10):1079 -1084.
[10]王齐欣,魏 来,高 燕,等.丙型肝炎病毒感染自然过程中的准种变化[J].中华传染病杂志,2004,22(5):323-324.
[11]Oker-Blom C,Airenne KJ,Grabherr R.Baculovirus display strategies:Emerging tools for eukaryotic libraries and gene delivery[J].Brief Funct Genomic Proteomic,2003,2(3):244-253.
[12]Riikonen R,Matilainen H,Rajala N,et al.Functional display of an α2integrin - specific motif(RKK)on the surface of baculovirus particles[J].Technol Cancer Res Treat,2005,4(4):437 -445.
[13]Konig M,Lengsfeld T,Pauly T,et al.Classical swine fever virus:independent induction of protective immunity by two structural glycoproteins[J].J Virol,1995,69(10):6479-6486.
[14]van Zijl M,Wensvoort G,de Kluyver E,et al.Live attenuated pseudorabies virus expressing envelope glycoprotein E1 of hogcholera virus protects swine against both pseudorabies and hogcholera[J].J Virol,1991,65(5):2761 -2765.
[15]Ribeiro BM,Gatti CD,Costa MH,et al.Construction of a recombinant Anticarsia gemmatalis nucleopolyhedrovirus(AgMNPV -2D)harbouring the β - galactosidase gene[J].Arch Virol,2001,146(7):1355 -1367.

