人胎脑神经干细胞的体外分离、培养与鉴定
方 庆 朱庆丰 尹国才 陈新生
1.安徽医科大学附属安庆医院神经外科,安徽 安庆 246003;2.安庆师范学院生命科学系,安徽 安庆 246003
中枢神经系统的许多疾病都存在不同程度和方式的神经细胞缺失或变性死亡,并由此引起神经功能的损害。传统的治疗效果多不显著,神经干细胞(NSCs)的发现与移植研究为其治疗带来了新的思路和方法。本研究旨在探索人胎脑神经干细胞的体外分离培养条件,从而在体外大量增殖神经干细胞,并观察神经干细胞增殖和分化的特点。
1 材料与方法
1.1 材料
水囊引产的14周妊娠胎儿1例,由临床科室提供,孕妇自愿捐献,对其使用遵守医学伦理原则并经医院伦理委员会批准。
1.2 主要试剂
DMEM/F12(1:1)培养基、B27、N2、碱性成纤维生长因子(bFGF)(Gibco 公司)、 表皮生长因子 (EGF)(Invitrogen 公司)、鼠抗人巢蛋白(Nestin)单克隆抗体、FITC标记的山羊抗小鼠IgG(Bdbioscience公司)、鼠抗人神经特异烯醇化酶(NSE)单克隆抗体、鼠抗人胶质纤维酸性蛋白(GFAP)单克隆抗体(Neomarkers公司)。
1.3 实验方法
1.3.1 取材及原代细胞培养 取14周水囊引产的人胚胎,无菌条件下取海马组织,用D-Hanks液漂洗,剪成1 mm3大小的组织块,经0.25%胰蛋白酶消化15 min,用200目不锈钢细胞筛,去除大块组织,离心后收集沉淀细胞,将其重悬于含B27(1∶50)、N2(1∶100)、EGF(20 ng/mL)、bFGF(20 ng/mL)的DMEM/F12培养液中。记数细胞活力后,按2×105/mL接种密度于T25细胞培养瓶,37℃、5%CO2静置培养,每天观察细胞的生长状况,3 d半量换液1次。
1.3.2 细胞传代培养 传代时,将神经细胞球收集于离心管经0.125%胰酶2 min,1000 r/min离心5 min后加入新鲜的全培养基,用移液器吹打10~15次,计数并以2×105个/mL细胞密度接种于T25细胞培养瓶中,37℃、5%CO2继续培养,每3~4 d换半液1次,7~10 d传代1次,方法同前。
1.3.3 神经球细胞爬片的制备及诱导分化 收集培养3~4代的“神经球”,接种于含有10%胎牛血清的24孔培养板中(内置经多聚赖氨酸涂片的载玻片),37℃、5%CO2,贴壁培养约4 h,取出部分载玻片。将未取出的附着在载玻片上的“神经球”诱导分化3~5 d,取出载玻片。取出的载玻片经4%多聚甲醛固定后-20℃保存备用。
1.3.4 免疫荧光细胞化学鉴定 取出3~4代的“神经球”细胞爬片,行Nestin免疫荧光染色鉴定。另将上述经10%胎牛血清诱导分化后的细胞爬片行NSE、GFAP免疫荧光单标染色,同时做阴性对照。室温下,正常山羊血清作用阻断非特异性结合位点,湿盒下孵育一抗和荧光二抗,荧光倒置显微镜下观察和记录照相。
2 结果
2.1 原代、传代活细胞形态学观察
初分离的细胞悬浮于培养液中,为圆形亮球状,周围有清晰的光晕,内部背景清晰;经锥虫蓝染色计数,活细胞在95%以上。2~3 d后,分裂形成多个细胞组成的悬浮生长细胞团,形状不规则,大小不一,细胞之间结合较为松散(图1)。6~7 d后,可见达数十个细胞构成的细胞团,呈球形或卵圆形,镜下细胞团周边细胞较亮,中心区细胞密度高,透光性差,有细胞溶解死亡现象(图2),此时需及时传代。在传代过程中,第2~6代的神经干细胞生长迅速。形成的神经球内细胞结合相当紧密,不易分开(图3)。
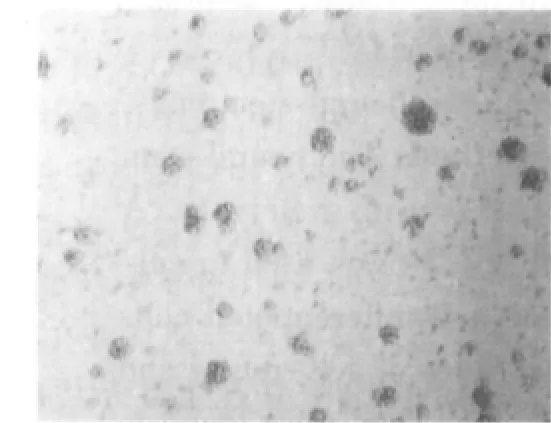
图1 原代培养3 d的细胞团(×200)
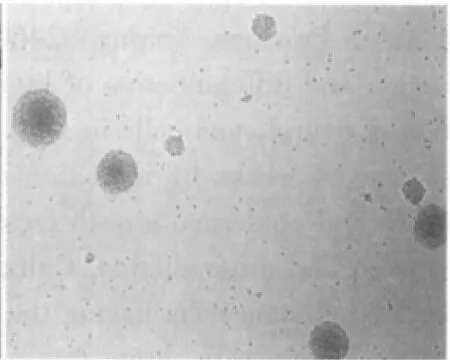
图2 原代培养6 d的细胞团(×200)
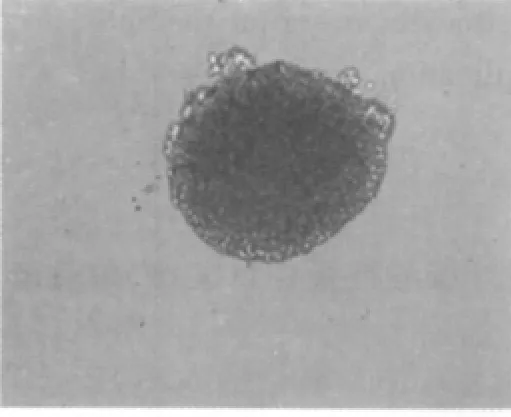
图3 第3代的神经干细胞球(×200)

图4 诱导分化5 d后,神经元样细胞(×100)
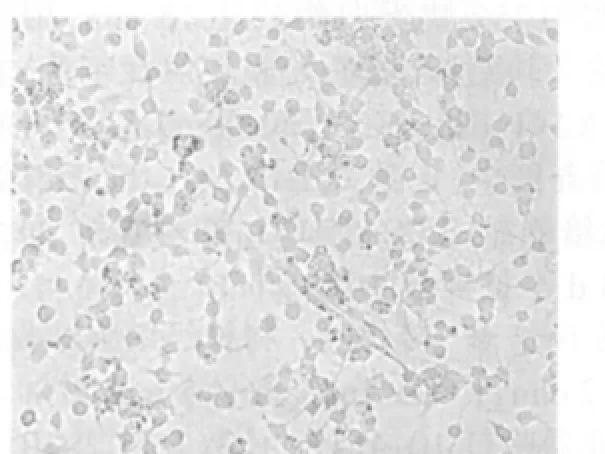
图5 诱导分化后5 d,星形胶质细胞样细胞(锥虫蓝×100)
2.2 诱导分化的活细胞观察
神经球3~4 h后很快贴壁,培养24 h后可见单个细胞从“神经球”内爬出。2 d后突起不断增粗和伸长,形态不规则,与周围细胞互相联接。5 d后分化出细胞逐渐增多,形成较大的冠面,根据细胞形态主要分为三种类型:①神经元样细胞(图4);②星形胶质细胞样细胞(图5);③少突胶质细胞样细胞。
2.3 细胞标志物的鉴定
3~4代后,细胞球中大多数细胞免疫荧光染色呈阳性反应,表达NSC的特征性标志抗原Nestin(图6)。10%胎牛血清培养基诱导后NSE或GFAP免疫荧光染色结果显示部分细胞胞浆呈绿色荧光,即为NSE和GFAP阳性表达(图7、8)。
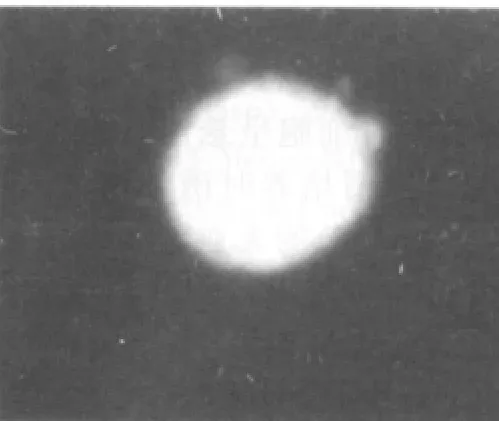
图6 神经球Nestin免疫荧光染色阳性(×200)

图7 诱导分化5 d后,免疫荧光染色呈NSE阳性的神经元(×400)
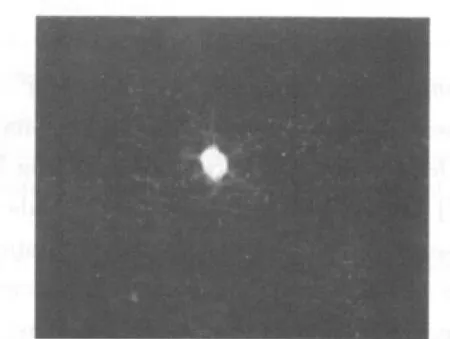
图8 诱导分化5 d后,免疫荧光染色呈GFAP阳性的星形胶质细胞(×400)
3 讨论
原代取材是进行组织培养的第一步。比较从胚胎期、新生儿期、婴幼儿期及成年期尸体分离培养的神经干细胞,胚胎期分离的神经干细胞具有更强的增殖能力[1-3],并且成体神经干细胞在体外培养的传代能力有限,长期体外培养也不能产生足够数量的神经元[4]。在人胎脑的研究方面,国内学者通过研究同一胎龄不同部位来源的神经干细胞,得出以下结论:在人胎脑的海马、室下区、纹状体、额叶、颞叶、顶叶、枕叶7个部位均存在神经干细胞且数量依次逐渐减少[5-6]。在本研究中,笔者取材于14周人胎脑海马区的神经干细胞,经培养后细胞数目明显增多,且能够在体外培养条件下连续分裂增殖。
生长因子在无血清培养基中对于维持神经干细胞生长与增殖是不可或缺的[7-8]。bFGF和EGF是在神经干细胞基础研究中用于其培养最多见的两种神经生长因子[9]。它们主要是作为神经干细胞有丝分裂中的分裂原而产生作用的,大量研究证明,EGF主要是在体外培养的早期为神经干细胞所需,bFGF主要是在神经干细胞增殖过程中发挥作用,它们共同作用以维持神经干细胞体外有丝分裂以及增殖[10-12]。
传代操作对于培养的成功与否是至关重要的。文献报道中主要包括机械分离和胰酶消化两种。研究证实,单纯吸管吹打无论从分离细胞的数量或存活率方面均不及酶消化结合吸管吹打的方法,这主要由于吸管吹打的机械切割作用使细胞活性受到一定影响且不利于分离组织内的细胞[13]。培养过程中,一般以神经球的大小作为判断传代时机的标志,笔者的经验是神经球的直径在0.6~0.8 mm时进行传代是最适合的,神经球过大或过小都对传代后神经干细胞的活性造成损害[14]。
神经干细胞免疫化学鉴定标记物中最常用的为Nestin。该蛋白只在多潜能的神经外胚层细胞表达,随着神经上皮的分化成熟逐渐消失,其功能现在尚未完全明确,可能具有机构和信息传递的功能。神经干细胞的鉴定,还应看是否能分化成神经元、胶质细胞及是否能分裂增殖。本研究中笔者分别用Nestin单抗标记神经干细胞,用NSE单抗标记神经元,用GFAP单抗标记星形胶质细胞,利用免疫荧光技术观察到了绿色荧光,证明从人胎脑海马获得了NSCs,且其具有自我更新能力和多向分化的潜能,为进一步用于基础及临床研究奠定了基础。
[1]Palmer TD,Schwartz PH,Taupin P,et al.Cell culture.Progenitor cells from human brain after death[J].Nature,2001,411(6833):42-43.
[2]Schwartz PH, Bryant PJ,Fuja TJ,et al.Isolation and characterization of neural progenitor cells from post-mortem human cortex [J].J Neurosci Res,2003,74(6):838-851.
[3]Xu Y,Kimura K,Matsumoto N,et al.Isolation of neural stem cells from the forebrain of deceased early postnatal and adult rats with protracted post-mortem intervals[J].J Neurosci Res,2003,74(4):533-540.
[4]Galvin KA,Jones DG.Adult human neural stem cells for cell-replacement therapies in the central nervous system[J].Med J Aust,2002,177(6):316-318.
[5]尹晓娟,巨容,封志纯.32周胎龄人胎脑神经干细胞发育状态的研究[J].中国小儿急救医学,2006,13(5):457-458.
[6]尹晓娟,封志纯.36周胎龄人胎脑不同部位神经干细胞的变化特征研究[J].临床儿科杂志,2006,24(10):838-840.
[7]Dietus C,Tronnier V,Unterberg A,et al.Comparative analysis of in vitro conditions for rat adult neural progenitor cells[J].J Neurosci Methods,2007,161(2):250-258.
[8]Hulspas R,Tiarks C,Reilly J,et al.In vitro cell density-dependent clonal growth of EGF-responsive murine neural progenitor cells under serum-free conditions[J].Exp Neurol,1997,148(1):147-156.
[9]Israsena N,Hu M,Fu W,et al.The Presence of FGF2 signaling determines whether Beta-catenin exerts effects on proliferation or neuronal differentiation of neural stem cells[J].Dev Biol,2004,268(l):220-231.
[10]Taupin P,Ray J,Fischer WH,et al.FGF-2-responsive neural stem cell proliferation requires CCg,a novel autocrine/paracrine cofactor[J].Neuron,2000,28(2):385-397.
[11]Vseeovi AL,Parati EA,Gritti A,et al.Isolation and cloning of mutipotential stem cells from the embryonic human CNS and establishment of transplantable neural Stem cells lines by epigenetic stimulation[J].Exp Neurol,1999,156(1):71-83.
[12]Alvarez-Buylla A,Garcia-Verdugo JM.Neurogenesis in adult subventricular zone[J].J Neurosci,2002,22(3):629-634.
[13]任萍,关云谦,张愚.人胚皮层神经干细胞培养方法的探讨(简报)[J].分子细胞生物学报,2007,40(1):79-83.
[14]孙鹏,董恺,董朝轩,等.人胚额叶皮层和海马干细胞的自主分化研究[J].中华神经外科杂志,2006,22(10):620-623.

