鸟氨酸脱羧酶基因沉默对子宫内膜癌细胞Ishikawa的影响
楚广民 张建波▲ 陈小兵▲ 刘红亮
1.河南省肿瘤医院 郑州大学附属肿瘤医院病理科,河南 郑州 450008;2.河南中医学院第一附属医院老年科,河南 郑州 450003
在真核生物代谢过程中,鸟氨酸脱羧酶(ornithine decarboxylase,ODC)是控制多胺生成的限速酶,多胺则是调控细胞增殖的重要因子,在肿瘤发生发展中起重要作用。在乳腺癌、肝癌等多种肿瘤研究中发现ODC和多胺高表达,抑制ODC活性可使多胺生成减少,从而抑制肿瘤发生发展[1-2]。本实验通过RNA干扰技术抑制ODC在子宫内膜癌Ishikawa细胞株的表达,探讨ODC在子宫内膜癌细胞增殖中的作用。
1 材料与方法
1.1 细胞培养
人子宫内膜癌细胞Ishikawa购自南京凯基生物科技有限公司细胞库,置于含10%胎牛血清的DMEM-F12培养基中、5%CO2、37℃及饱和湿度培养箱中培养,2~3 d传代 1次,取对数生长期的细胞进行试验。
1.2 主要试剂
DMEM-F12购自杭州吉诺生物医药技术有限公司。小牛血清购自杭州四季青公司;ODC抗体、β-actin抗体均购于Santa Cruz Biotechnology公司。Lipofectamine TM2000脂质体购于美国Invitrogen公司。逆转录试剂盒购自Promega公司。SYBR Green RT-PCR试剂盒购自北京天根生物技术有限公司。噻唑蓝(MTT)、二甲基亚砜(DMSO)和Trizol等试剂购自Sigma公司。DNA Marker购自天根生化科技有限公司;PCR引物由上海生工生物工程技术服务有限公司合成。siRNA真核表达载体pSUPER-EGFP空质粒由郑州大学基础医学院组织学与胚胎学教研室构建惠赠。
1.3 细胞转染
按照标准在6孔板进行细胞转染。ODC siRNA的序列,F:CACCCGAAGTAGAGGAACATTCAAGAGATGTTCCTCTAC TTCGGGTG;R:GTGGGCTTCATCTCCTTGTAAGTTCTCTACAAGGAGATGAAGCCCAC。构建了携带ODC siRNA的序列的真核表达载体pSUPER-EGFP-ODC。在无菌EP管内加入质粒4.0 μg,加入无双抗无血清培养基至250 μL混匀,静置5 min;另 lipofectamine TM2000脂质体 10 μL,加入无双抗无血清培养基至250 μL混匀,轻轻混合上述两种溶液,室温放置20 min备用。细胞弃去原培养基,用2 mL无血清的培养基孵育细胞2 h,弃去培养液加入上述溶液,将培养板置于细胞培养箱内孵育5 h后去除转染混合液,更换为普通全培基。实验分三组:Ishikawa组,pSUPER-EGFP组,pSUPEREGFP-ODC组。Ishikawa为未转染细胞;pSUPER-EGFP为转染空质粒细胞;pSUPER-EGFP-ODC为转染siRNA质粒细胞。
1.4 Real-time PCR检测ODC mRNA表达
收集各组细胞,用Trizol提取总RNA,按照反转录试剂盒上的步骤反转录成cDNA,以cDNA为模板进行PCR扩增。ODC上游引物为TGGCTTCCAGAGGCCGACGA,下游引物为GACACAGGCAGGGTGCTGGC,扩增片段长度为126 bp;内参为β-actin,上游引物为GCCCTGGCACCCAGCACAAT,下游引物为GGAGGGGCCGGACTCGTCAT,扩增片段长度为150 bp。PCR 扩增条件为:95℃预变性 10 min,94℃变性 30 s,褪火 30 s,71℃延伸 30 s,40 个循环;融解曲线阶段:95℃ 15 s,56℃ 30 s,95℃ 15 s。 ODC mRNA 表达水平采用 2-△△Ct法评估。
1.5 Western blot检测ODC蛋白表达
选取各组处于对数生长期的细胞提取细胞总蛋白。取20 μL蛋白和 8 μL Loading在 6%浓缩胶和 12%分离胶SDS-PAGE凝胶电泳,将蛋白转移到PVDF膜上,用含5%脱脂奶粉的TBST液室温封闭2 h,然后加入1∶500稀释的羊抗人ODC多抗和1∶400稀释的抗β-actin抗体室温震荡培育4 h,TBST液充分洗涤 5次,每次10 min。 加入1∶1000稀释的羊抗鼠IgG二抗,室温震荡培育4 h,TBST液充分洗涤3次,每次10 min。暗室中显色、曝光、显影和成像。
1.6 MTT测定细胞增殖能力
取处于对数生长期的各组Ishikawa细胞经胰酶消化,以(1~2)×105个/mL的细胞密度接种于96孔板中,每组设5复孔。细胞在37℃、5%CO2条件下孵育,使之贴壁,依次分别培养 1、2、3、4、5、6 d。 结束培养前每孔加入 5 mg/mL 的 MTT 溶液 20 μL,继续在前述条件下培养 4 h,加入 DMSO 150 μL。 震荡10 min使紫蓝色结晶物充分融解。用酶标仪(Bio2rad 680)于570 nm波长测定每孔的吸光度(absorbance)。以各实验孔吸光度值减去空白对照孔吸光度值得出其A值来反映存活细胞数量,绘制细胞生长曲线。
1.7 流式细胞术检测细胞周期和凋亡情况
用0.25%胰蛋白酶适度消化收集处于对数生长期的各组细胞,每组至少收集细胞数1×106个细胞,轻轻吹打制备单细胞悬液细胞后移入新的1.5 mL离心管中,4℃,500 g,离心5 min。小心移去上清液并用冰预冷PBS洗细胞2次。上流式细胞仪检测各组细胞周期和凋亡数据并进行资料分析。
1.8 统计学方法
采用SAS 6.12和SPSS 13.0统计软件对数据进行统计学处理,计量资料数据以均数±标准差()表示,比较采用t检验,MTT结果采用两因素方差分析,其余结果采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 ODC mRNA和蛋白的检测
PCR和Western Blotting结果示pSUPER-EGFP-ODC组ODC mRNA和蛋白的表达水平与Ishikawa和pSUPEREGFP比较,明显降低,差异有高度统计学意义(P<0.01),Ishikawa和pSUPER-EGFP比较差异无统计学意义 (P>0.05)(图 1、2)。

图1 ODC mRNA在三组Ishikawa细胞中的表达情况
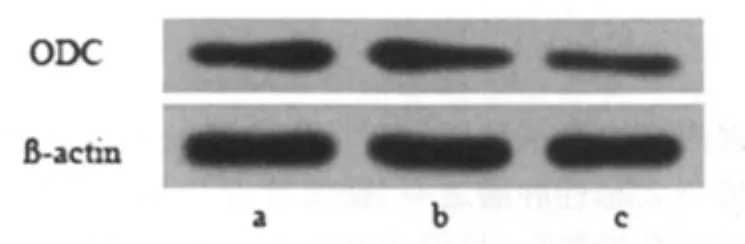
图2 ODC蛋白在三组Ishikawa细胞中的表达情况
2.2 pSUPER-EGFP-ODC对Ishikawa细胞增殖的影响
MTT结果显示pSUPER-EGFP-ODC组Ishikawa细胞生长能力与Ishikawa和pSUPER-EGFP比较,明显降低,差异有高度统计学意义(P<0.01),Ishikawa和pSUPER-EGFP比较差异无统计学意义(P>0.05)。见图3。

图3 pSUPER-EGFP-ODC对Ishikawa细胞增殖的影响
2.3 pSUPER-EGFP-ODC对Ishikawa细胞周期和凋亡的影响
流式细胞术结果显示ODC沉默后能阻滞Ishikawa细胞于期 G0/G1期pSUPER-EGFP-ODC组细胞百分比 (66.22±3.33)%与 pSUPER-EGFP 组的 (53.83±4.51)%和 Ishikawa组的(50.25±3.48)%比较,明显增高,差异有高度统计学意义(F=14.523,P<0.01);S 期细胞百分比pSUPER-EGFP-ODC组的(19.98±3.54)% 与 pSUPER-EGFP 组 的 (34.51±2.37)% 和Ishikawa组的(37.1±2.91)%比较,明显降低,差异有高度统计学意义(F=28.778,P<0.01)。ODC 沉默后能诱导 Ishikawa组细胞 凋 亡 ,pSUPER-EGFP-ODC组 细 胞 凋 亡 率 [(13.86±3.07)%]与 pSUPER-EGFP 组的(2.31±1.09)%和Ishikawa组的(2.17±0.99)%比较,明显增高,差异有高度统计学意义(F=34.866,P<0.01)(图 4、5)。
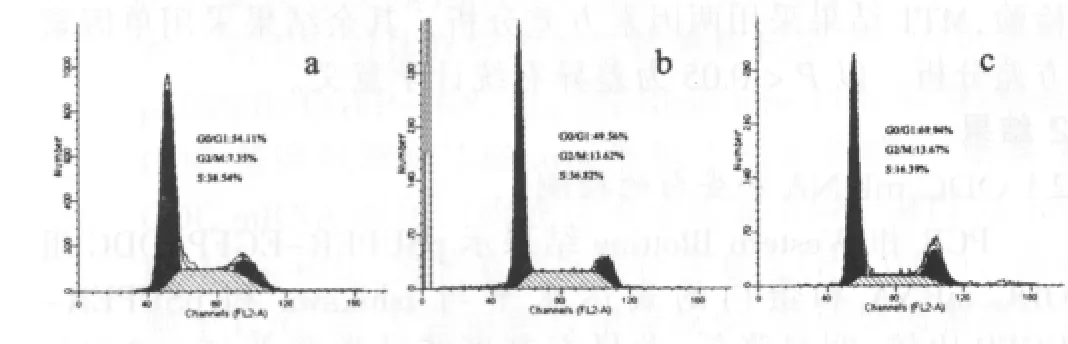
图4 pSUPER-EGFP-ODC对Ishikawa细胞周期的影响
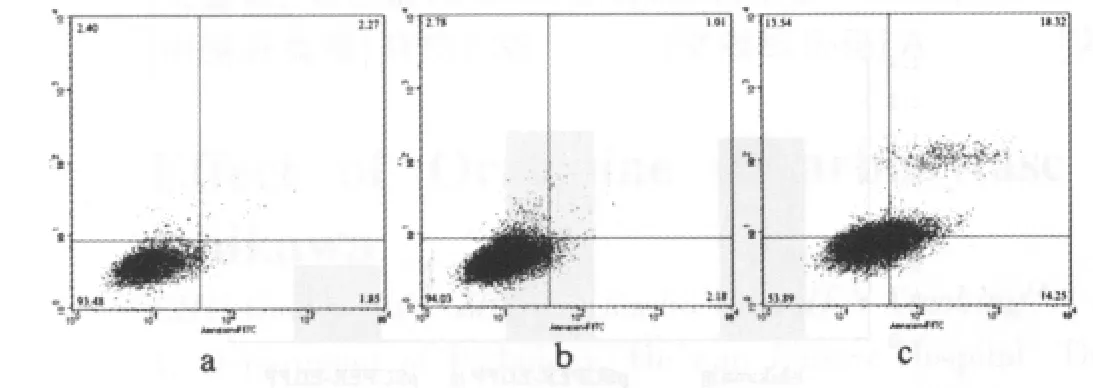
图5 pSUPER-EGFP-ODC对Ishikawa细胞凋亡的影响
3 讨论
子宫内膜癌是一种原发于子宫内膜的恶性肿瘤,是女性生殖系统三大恶性肿瘤之一,据统计近几年来发病率在世界范围内呈增高趋势[3]。目前子宫内膜癌的主要治疗手段是早期以手术治疗为主辅以放疗、化疗等手段,晚期患者则主要以手术缩瘤、术后辅助放疗、化疗及激素治疗,但疗效差,生存期短。基因治疗成为近年来子宫内膜癌研究热点之一。ODC作为多胺合成的限速酶,能催化鸟氨酸生成腐胺,后者再生成精脒和精胺[4]。研究发现ODC基因及其酶活性在多种肿瘤细胞和肿瘤组织中均呈显著增高状态,且ODC的高表达是疾病不良预后的指标[5-7]。有研究报道[8-9],ODC的抑制剂二氟甲基鸟氨酸(DFMO)能有效抑制结直肠癌等多种恶性肿瘤细胞的生长,但由于该药毒副作用大,限制了其在临床中的应用。因此有必要探讨以ODC为靶点新的抗肿瘤治疗策略,其中RNA干扰技术是研究方向之一。
本研究以子宫内膜癌细胞株Ishikawa为研究对象,以ODC为肿瘤治疗靶点,用RNA干扰技术特异性地下调ODC基因的表达,探讨ODC表达下降对子宫内膜癌细胞株Ishikawa的影响。本研究首先成功沉默了子宫内膜癌Ishikawa细胞ODC的表达,同时设pSUPER-EGFP转染组和亲本Ishikawa细胞作为对照。为证明ODC的沉默效果,笔者分别用realtime PCR和Western blot方法检测ODC mRNA和蛋白的表达情况,结果显示pSUPER-EGFP-ODC的mRNA和蛋白质表达水平均明显下降。说明本实验的脂质体介导的RNA沉默序列可以有效地下调ODC基因表达。这与其他学者以往报道的结果相符合,如Moussavi等[10]证实用病毒载体介导的RNA干扰可以在前列腺癌细胞LNCaP,C4-2,DU145 and PC-3下调ODC基因的表达。为进一步证实ODC基因表达下调后对子宫内膜癌细胞株Ishikawa的影响,笔者分别用MTT和流式细胞术来测定细胞的增殖能力和细胞周期和凋亡情况。本研究结果显示,pSUPER-EGFP-ODC细胞与pSUPER-EGFP转染组和亲本Ishikawa细胞相比ODC基因沉默的细胞的增殖活性明显受到抑制,细胞阻滞于G0/G1期,S期细胞数相应减少,并诱导细胞凋亡。
总之,本实验用RNA干扰技术引起ODC基因沉默并抑制了子宫内膜癌细胞株Ishikawa的生长,这是ODC基因沉默抑制子宫内膜癌细胞生长的有力证据,为ODC基因应用于子宫内膜癌的基因治疗提供了实验依据。
[1]Deng W,Jiang X,Mei Y,et al.Role of ornithine decarboxylase in breast cancer[J].Acta Biochim Biophys Sin,2008, 40(3):235-243.
[2]Kubo S,Tamori A,Omura T,et al.Ornithine decarboxylase activity in the non-cancerous hepatic tissue of patients with hepatocellular carcinoma[J].Hepatogastroenterology,2000,47(33):820-823.
[3]Ulrich LS.Endometrial cancer, types, prognosis, female hormones and antihormones[J].Climacteric,2011,14(4):418-425.
[4]Ma Q,Wang Y,Gao X,et al.L-arginine reduces cell proliferation and ornithine decarboxylase activity in patients with colorectal adenoma and adenocarcinoma[J].Clin Cancer Res,2007,13(24):7407-7412.
[5]Nakazawa K,Nemoto T,Hata T,et al.Single-injection ornithine decarboxylase-directed antisense therapy using atelocollagen to suppress human cancer growth[J].Cancer,2007,109(5):993-1002.
[6]Hoshino Y,Terashima S,Teranishi Y,et al.Ornithine decarboxylase activity as a prognostic marker for colorectal cancer[J].Fukushima J Med Sci,2007,53(1):1-9.
[7]Elmets CA,Athar M.Targeting ornithine decarboxylase for the prevention of nonmelanoma skin cancer in humans[J].Cancer Prev Res(Phila),2010,3(1):8-11.
[8]Laukaitis CM,Gerner EW.DFMO:targeted risk reduction therapy for colorectal neoplasia[J].Best Pract Res Clin Gastroenterol,2011,25(4-5):495-506.
[9]Nie L,Feng W,Diaz R,et al.Functional consequences of polyamine synthesis inhibition by L-alpha-difluoromethylornithine (DFMO):cellular mechanisms for DFMO-mediated ototoxicity [J].J Biol Chem,2005, 280(15):15097-15102.
[10]Moussavi M,Moshgabadi N,Fazli L,et al.Fibroblast growth factor and ornithine decarboxylase 5'UTRs enable preferential expression in human prostate cancer cells and in prostate tumors of PTEN (-/-)transgenic mice[J].Cancer Gene Ther,2012,19(1):19-29.

