山东地区Ⅰ型鸭肝炎病毒分离鉴定及单克隆抗体的研制*
提金凤,李志杰,李 舫
(山东畜牧兽医职业学院,山东 潍坊 261061)
鸭病毒性肝炎(Duck viral hepatitis,DVH)是由鸭肝炎病毒(Duck hepatitis virus,DHV)引起的一种传播快速、急性高度致死性传染病,主要侵害1月龄以内的雏鸭。该病于1949年由Levine和Hofstad首次发现于美国的长岛,呈世界性分布,是危害养鸭业最为严重的传染病之一[1]。鸭病毒性肝炎的病原为DHV,可分为3个血清型,分别为Ⅰ型DHV、Ⅱ型DHV和Ⅲ型DHV[1-2]。DHV属于小RNA病毒科,病毒粒子呈正二十面体结构,其组成为衣壳蛋白和一条由衣壳蛋白包裹的长约7.7kb左右的单链正股RNA组成。Ⅰ型DHV流行最广泛且致病力最强,Ⅱ型DHV仅见于英国,Ⅲ型DHV 仅见于美国和中国,均呈偶发性[3-4]。
近年来,国内外也相继有关新型DHV (NDHV)的报道,但Ⅰ型DHV仍是发病的主要血清型。传统上对该病的治疗是采用卵黄抗体,但有时受卵黄抗体中非特异性蛋白或抗体滴度过低的影响,治疗效果较差。针对这种情况,本文从山东地区分离出一株Ⅰ型DHV并进行鉴定,然后对其进行单克隆抗体的研制,筛选出具有中和性的单克隆抗体,为以后进一步用单抗来进行该病的临床诊断和治疗提供方法。
1 材料与方法
1.1 材料
1.1.1 鸡胚、细胞系及实验动物 SPF鸡胚购自山东省农科院家禽研究所;6周龄的Balb/c小鼠以及8周龄~10周龄的昆明鼠购自山东大学医学院;小鼠骨髓瘤细胞SP2/0-Ag14由中国动物卫生与流行病学中心邵卫星博士馈赠。
1.1.2 主要试剂 PEG4000、高糖型 DMEM、次黄嘌呤、胸腺嘧啶、L-谷氨酰胺、单克隆抗体亚类鉴定试剂盒、邻苯二胺(OPD)、辣根过氧化物酶(HRP)为Sigma公司产品;羊抗鼠IgG-HRP、羊抗鼠IgGM-HRP为华美公司产品;氨基喋呤为GIBCO BRL公司产品。
1.2 方法
1.2.1 病毒的分离培养 从山东地区某鸭场(临床诊断为鸭病毒性肝炎)采集发病鸭的肝脏,在匀浆器中加入适量灭菌的生理盐水(一般按照1∶4的比例)后进行匀浆,组织液12000r/min 10min离心,取上清液,加入青霉素和链霉素在4℃过夜。然后将上清液经尿囊腔接种9日龄~11日龄的SPF鸡胚10枚,0.2mL/枚,另设生理盐水对照。37℃温箱中培养,观察5d~8d,并收集死亡胚的尿囊液[5]。
1.2.2 病毒的鉴定[6-7]
1.2.2.1 病毒中和试验 按照文献[2]进行。用灭菌生理盐水稀释收集获得的疑似DHV尿囊液,稀释至0.2mL病毒含量为200ELD50。取0.2mL与等量的Ⅰ型鸭肝炎病毒的阳性血清进行混合,37℃水浴作用30min,然后接种10枚SPF鸡胚,每只胚0.2mL,37℃温箱培养,观察5d~8d。
1.2.2.2 动物回归试验 将10只3日龄鸭肝炎病毒母源抗体阴性的雏鸭分为2组,5只/组。其中1组用获得的疑似DHV尿囊液及死亡胚体的混合物,颈部皮下注射进行攻毒,攻毒量为0.5mL/只;另1组设为对照组,颈部皮下注射生理盐水,0.5mL/只。隔离饲养,观察并记录结果。
1.2.2.3 RT-PCR鉴定 按照文献[8-9]进行。参考GenBank中已发布的血清型Ⅰ型DHV VP1基因序列,由宝生物工程(大连)有限公司合成引物。上游引物:5′-GAA TTC GGT GAT TCC AAC AGT TG -3′;下游引物:5′-GCG GCC GCT TCA ATT TCC AGA TTG-3′。划线处分别为限制性内切酶EcoRⅠ、NotⅠ的识别位点。
用RNA提取试剂盒提取RNA进RT-PCR扩增。回收的PCR产物克隆至pMD18-T载体中,双酶切法进行阳性重组质粒鉴定。最后由宝生物工程(大连)有限公司完成测序。
1.2.2.4 免疫原和检测抗原的制备及鉴定 将已经鉴定的Ⅰ型DHV接种100枚9日龄~11日龄的SPF鸡胚,收集72h~96h死亡鸡胚的尿囊液,并将收集的尿囊液进行浓缩纯化。方法如下:先将尿囊液在4℃以12000r/min离心10min,取上清液,将上清液与等量的氯仿震荡混匀,在4℃ 以8000 r/min离心10min,取上清水相。然后将水相放在透析袋中4℃透析,透析液为50%的PEG4000。将透析后的浓缩液在4℃以12000r/min离心10min,取上清液。分光光度计测定DHV的浓度。
将纯化后的抗原经0.22μm滤器过滤后接种9日龄~11日龄的鸡胚,并设正常鸡胚作对照。记录鸡胚死亡及胚体病变情况。
1.2.3 杂交瘤细胞株的建立
1.2.3.1 免疫动物 取6周龄的 Balb/c小鼠,腹部皮下注射已浓缩纯化后的DHV,100μg/只,每隔2周免疫接种1次,第3次免疫接种后1周,眶下窦采血,用间接ELISA测定小鼠血清的OD值,若为阳性,1周后加强免疫1次,3d后融合。
1.2.3.2 融合 按照文献[10]方法,取免疫小鼠的脾细胞与处于对数生长期的SP2/0细胞按3∶1的比例,用PEG4000诱导融合。
1.2.3.3 杂交瘤细胞的筛选及其克隆化 采用间接ELISA法进行筛选,将检测为阳性的孔中的细胞扩大培养,及时冻存,同时按照有限稀释法进行亚克隆至阳性率为100%,并制备腹水。
1.2.4 单克隆抗体特性的鉴定
1.2.4.1 亚类鉴定 用亚类鉴定试剂盒,采用抗原介导的ELISA 法(Atigen-Mediated ELISA),按其说明书所介绍的方法进行测定。
1.2.4.2 效价测定 取已定株的杂交瘤细胞株的培养上清和其腹水做倍比稀释,间接ELISA进行测定。
1.2.4.3 单克隆抗体特异性鉴定 用鸡胚尿囊液、DPV、EDS-76V、IBV、MDV 及 NDV等抗原点样,用Dot-ELISA检测所制备的单克隆抗体的反应性。
1.2.4.4 鸡胚中和特性测定 采用固定病毒-稀释单抗法进行中和特性鉴定。用灭菌生理盐水稀释已鉴定的DHV尿囊液,稀释至0.2mL病毒含量为200ELD50。取0.2mL与等量的1∶5、1∶10、1∶50稀释的单抗进行混合,37℃水浴作用30min,然后接种SPF鸡胚,每个稀释度接种4枚鸡胚,37℃温箱培养,观察5d~8d。另设生理盐水空白对照和病毒对照组。然后将单抗分别与本实验室已分离鉴定的7株Ⅰ型DHV(其中3株分离自潍坊地区、4株分离自济南地区)进行中和试验,并记录试验结果。
2 结果
2.1 病毒的分离鉴定
10枚SPF鸡胚均在接种后72~96h之间死亡,死亡的胚体水肿出血,尤其是头部、翅膀和腿部点状出血明显。剖检发现有的肝脏边缘白色坏死,有的肝脏上白色点状坏死呈斑驳状,有的肝脏发绿且边缘坏死。收集死亡鸡胚的尿囊液。
病毒中和试验结果表明,该分离毒株能被Ⅰ型鸭肝炎病毒的阳性血清中和。动物回归试验显示攻毒组雏鸭在72h内死亡率达100%,病死鸭主要表现角弓反张、剖检肝脏出血、胆囊充盈、充满茶色胆汁,肾脏肿胀、出血;对照组健康无变化。
2.2 RT-PCR鉴定
用RNA提取试剂盒提取RNA,并利用设计的引物进行Ⅰ型DHV VP1基因扩增,获得714bp大小的基因片段(图1)。回收的RT-PCR产物克隆至pMD18-T载体中,用限制性内切酶EcoRⅠ、NotⅠ进行酶切鉴定(图2)。最后由宝生物工程(大连)有限公司完成测序。
2.3 免疫原和检测抗原的制备及鉴定
将浓缩纯化后的Ⅰ型DHV经分光光度计测定其蛋白质浓度,浓度为5mg/mL。
将纯化后的抗原经0.22μm滤器过滤后接种9日龄~11日龄的鸡胚,并设正常鸡胚作对照。鸡胚在72h~96h之间死亡,死亡的胚体水肿出血,肝脏上有白色坏死点,没有接种抗原的对照组鸡胚发育正常。
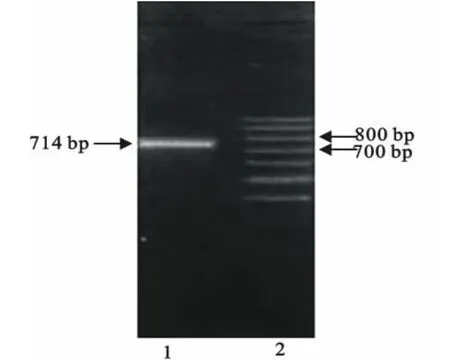
图1 Ⅰ型DHV VP1基因的RT-PCR产物Fig.1 RT-PCR products of DHV typeⅠ VP1gene
2.4 杂交瘤细胞株的建立
用间接ELISA方法,获得了一株针对Ⅰ型DHV的单抗杂交瘤细胞株,命名为3B2。传代培养后,依然能稳定分泌单抗。
2.5 单克隆抗体特性的鉴定
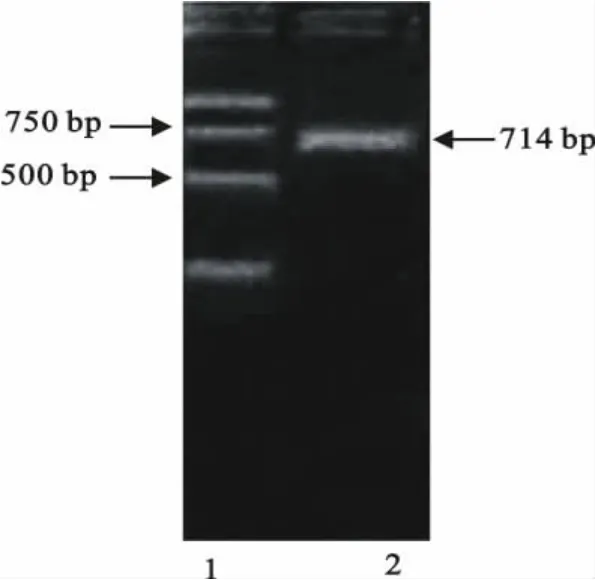
图2 重组质粒pMD-VP1的酶切结果Fig.2 Enzyme digestion of recombinant pMD-VP1
2.5.1 单克隆抗体的部分生物学特性 3B2单抗的亚类鉴定为IgG1,细胞上清与小鼠腹水的ELISA效价分别为1∶500和1∶100000。
2.5.2 单抗特异性及广谱性鉴定 本试验所获得的单抗与鸡胚尿囊液、DPV、EDS-76V、IBV、MDV和NDV等均不反应,特异性好。该单抗与本试验分离的7株Ⅰ型DHV均反应,具有一定的广谱性。2.5.3 中和特性鉴定 本试验所获得的单抗中和特性较好,能以该杂交瘤细胞上清的原倍中和鸡胚,并且和本试验分离的其他7株Ⅰ型DHV均能发生中和反应,广谱性较好,结果见表1、表2。

表1 单抗3B2细胞上清与DHV的Dot-ELISA反应结果Table1 Result of Dot-ELISA between the monoclonal antibody 3B2and DHV

表2 单抗3B2细胞上清与DHV中和反应结果Table2 Result of neutralization action between the monoclonal antibody 3B2and DHV
3 讨论
本研究通过鸡胚分离培养和各种鉴定,获得了一株Ⅰ型DHV。
DHV粒子的大小只有20nm~40nm,纯化较困难,参考杨萍萍等对DHV的纯化方法来浓缩纯化该病毒。该方法主要是利用DHV对脂溶剂不敏感,能耐受反复冻融,对外界环境的抵抗能力强等特点进行。通过处理,去除了绝大部分脂类和杂蛋白。浓缩后的DHV经测定病毒含量较高,杂质较少,可以作为制备单抗的免疫原和筛选抗原。由于作者所在实验室条件所限,无法对浓缩后的DHV利用层析法或其他方法进一步纯化,这可能会为单抗的筛选带来一定难度。再者,对病毒进一步纯化有可能会影响病毒的生物活性和病毒的结构,这会 破坏病毒的免疫性,可能筛选不到具有中和性的单抗。因此,关于DHV更好的纯化手段有待于进一步的研究[11]。
陈溥言等首先报道国内抗鸭肝炎病毒单抗的制备,之后杨萍萍等也做了报道[11],但两者所制备的DHV单抗中和特性较差,限制了该单抗的应用。本研究旨在利用纯化后的病毒制备出具有中和特性的Ⅰ型DHV单抗。本研究的纯化抗原中可能会存在鸡胚尿囊液中的一些杂蛋白,进行单抗筛选时我们采用了双筛选法,即用DHV纯化抗原和正常鸡胚尿囊液抗原同时包被酶标板进行同步检测;为了获得具有中和特性的单抗,对筛选到的阳性克隆先进行扩大培养后先进行中和试验鉴定,对具有中和性的杂交瘤克隆再进行亚克隆和保存。这样就大大增加了获得中和性单抗的概率。
本研究获得了一株杂交瘤细胞株3B2,该杂交瘤细胞株上清液能中和病毒,具有较好的中和特性,且与本试验分离的其他7株Ⅰ型DHV均能发生中和反应,广谱性较好;而且该株杂交瘤的稳定性和特异性较好,为该单抗应用于实验室对Ⅰ型DHV检测、DHV病毒检测试剂盒的制备以及对DVH的抗病毒治疗等提供重要的生物试剂。
[1]Tseng C H,Tsai H J.Molecular characterization of a new sero-type of duck hepatitis virus[J].Virus Res,2007,126(2):19-31.
[2]马秀丽,赵立娜,夏雪梅,等.一株韩国新型DHV的分离及RT-PCR鉴定[J].浙江农业学报,2010,22(5):596-598.
[3]Kim M C,Kwon Y K,Joh S J,et al.Recent Korean isolates of duck hepatitis virus revealed the presence of a new geno-and serotype when compared to duck hepatitis virus type 1typestrain[J].Arch of Virol,2007,152:2059-2072.
[4]Wang L,PanM,Fu Y,et al.Classification of duck hepatitisvirus into three genotypes based on molecular evolutionary analysis[J].Virus Genes,2008,37:52-59.
[5]Purchase H G.禽病原分离鉴定实验室手册[M].3版.唐桂运,武 华,译校.冀锡霖审校.北京:北京农业大学出版社,1993,10:190-194.
[6]施少华,苏敬良,黄 瑜,等.鸭肝炎病毒新血清型基因组序列分析[J].微生物学报,2009,49(3):309-315.
[7]范书才,李 虹,袁率珍,等.新型鸭肝炎病毒的分离鉴定[J].中国预防兽医学报,2009,31(10):770-775.
[8]马秀丽,宋敏训,于可响.鸭病毒性肝炎病毒VP1基因表达及其抗体检测[J].微生物学报,2008,48(8):1110-1114.
[9]甘一迪,刘家森,姜 骞.3株鸭肝炎病毒Ⅰ型结构基因VP1的克隆及序列分析[J].畜牧兽医学报,2009,40(6):952-957.
[10]提金凤,李志杰,刘秀梵.用DNA免疫研制鸡白细胞介素2单克隆抗体[J].中国预防兽医学报,2007,29(7):537-540.
[11]杨萍萍,宋敏训,艾 武,等.鸭肝炎病毒单克隆抗体的研制[J].中国预防兽医学报,2006,28(2):212-215.

