小鼠抗HCMV-gB多克隆抗体的制备及初步应用
韩慧平,于三科
(西北农林科技大学动物医学院,陕西 杨凌 712100)
巨细胞病毒(Cytomegalovirus,CMV)感染在人及动物中普遍存在,不同的物种具有其特定的病毒株,我国人巨细胞病毒(Human cytomegalovirus,HCMV)感染率高达86%~96%[1]。HCMV感染对胎儿和免疫功能低下者危害严重[2-3],而且与动脉粥样硬化和肿瘤发生密切相关[4]。研制HCMV疫苗对预防该病毒感染具有非常重要的意义[5]。HC-MV表面的包膜糖蛋白B(glycoprotein B,gB)全长906个氨基酸,介导病毒与宿主细胞的黏附和融合,是HCMV自然感染中诱生中和抗体的主要保护性抗原,因此也是HCMV疫苗研究的主要靶抗原[6]。本实验室在前期研究基础上构建了两个含有gB中和表位区域的重组蛋白gB1和gB2,以作为HCMV疫苗的候选抗原。为了对这两个候选疫苗抗原进行定性和定量分析,需要获得相应的高效价免疫血清。根据文献报道[7],gB分子57aa~146aa片段为介导病毒入侵细胞的关键位点,本研究利用原核表达系统表达了gB(57aa~146aa)蛋白,采用了一种快速简便的高效价小鼠免疫血清制备方法,5周内通过2次免疫即可制备获得高滴度的抗gB(57aa~146aa)多克隆抗体,为进一步研究以gB为基础的HCMV疫苗提供研究工具。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF级Balb/c小鼠6只,雌性,6周龄~8周龄,购自中国医学科学院实验动物中心。
1.1.2 主要试剂 TOP10和 Rosetta(DE3)感受态细胞为北京博迈德科技发展有限公司产品;pET21b(+)和pMD-18T-gB (aa 1-907)质粒由本室保存;质粒小量提取试剂盒和琼脂糖凝胶DNA回收试剂盒为Axygen公司产品;Primer STAR HS DNA聚合酶、T4DNA连接酶和限制性内切酶为宝生物工程(大连)有限公司产品;HRP标记的兔抗小鼠IgG为 USB公司产品;Al(OH)3和CpG-ODN佐剂、293FT细胞表达的HCMV-gB1和gB2糖蛋白由本室制备。
1.2 方法
1.2.1 PCR扩增 HCMV-gB (aa57-146)基因片段根据模板pMD-18T-gB (aa 1-907)设计引物,上游引物为:5′-CGCCATATGCACCATCATCATCATCATGTAACTTCTTCCCAAACGGTC-3′,下游 引 物 为:5′-GCGGGATCCTTATTAAACCTTCTGGTAGACTCGTAC-3′,由上海英骏生物技术有限公司合成。PCR反应参数为:94℃3min;94℃40s,55℃30s,72℃30s,共30个循环;72℃延伸10min。PCR产物经10g/L琼脂糖电泳分离。
1.2.2 pET21b(+)-gB(aa57-146)表达载体的构建用NdeⅠ和BamHⅠ双酶切PCR产物和质粒pET21b(+),琼脂糖凝胶电泳后切胶回收,T4 DNA连接酶于室温连接过夜。连接产物转化TOP10感受态细胞,筛选有目的基因片断插入的重组质粒,并对插入片断进行测序分析。
1.2.3 重组蛋白的表达和纯化 pET21b (+)-gB(57aa~146aa)质粒转化Rosetta(DE3)感受态细胞,挑单菌落接种2mL液体LB培养基,37℃振摇培养过夜。按1%接种量转接200mL 2×YT培养基,37℃振摇培养至OD600为0.5左右,加入终浓度为1mmol/L的IPTG诱导表达4h,离心收集菌体。用20mmol/L Tris-HCl缓冲液重悬菌体,超声破碎,用含1mol/L尿素的Tris-HCl缓冲液洗涤,再用含8mol/L尿素的Tris-HCl缓冲液溶解,进行镍柱亲和层析并收集不同浓度咪唑洗脱组分,于含4、2、0.5mol/L尿素的 Tris-HCl缓冲液中逐次进行透析,每次4h,最后于20mmol/L Tris-HCl缓冲液中透析过夜。
1.2.4 免疫动物 用于每只小鼠的免疫剂量分别为重组蛋白8μg、Al(OH)3300μg和 CpG-ODN 30μg,总体积为100μL,通过后腿肌肉注射免疫Balb/c小鼠。3周后按同样方式进行加强免疫,并于加强免疫后2周采集免疫血清。
1.2.5 ELISA测定抗体滴度 以重组蛋白包被酶标板,2μg/mL,4℃过夜;加入含50mL/L牛血清的PBS(pH7.4),100μL/孔,37℃封闭1h;PBST洗板3次后加入从1∶100开始倍比稀释的免疫血清,100μL/孔,37℃孵育2h;PBST洗板3次后加入HRP标记的兔抗小鼠IgG,100μL/孔,37℃孵育1h;PBST洗板3次后每孔加入显色液100μL,显色5min后终止反应;用酶标仪测定492nm处吸光度值,并以0.100作为判定终点滴度的Cut-off值。
1.2.6 Western blot 用哺乳动物细胞表达的gB1(每泳道0.2μg)和gB2(每泳道1μg)进行SDSPAGE;100v/60min电转至硝酸纤维薄膜,并用含50g/L脱脂奶粉的PBST封闭1h;PBST洗膜3次,每次3min,加入1∶500倍稀释的重组蛋白免疫血清,37℃孵育1h;PBST洗膜3次,每次3 min,加入1∶6000倍稀释的HRP标记的兔抗小鼠IgG,37℃孵育1h;PBST洗膜3次,每次3min,用TMB溶液显色,约5min后终止反应。
2 结果
2.1 HCMV-gB(57aa~146aa)编码基因的PCR扩增及原核表达载体构建
以pMD-18T-gB (1aa~907aa)质粒为模板,通过PCR扩增出大小约315bp的目的基因片断(图1A)。通过定向克隆将该目的基因片断插入原核表达载体pET21b(+)的NdeⅠ和BamHⅠ酶切位点,酶切鉴定结果显示获得重组表达质粒(图1B)。
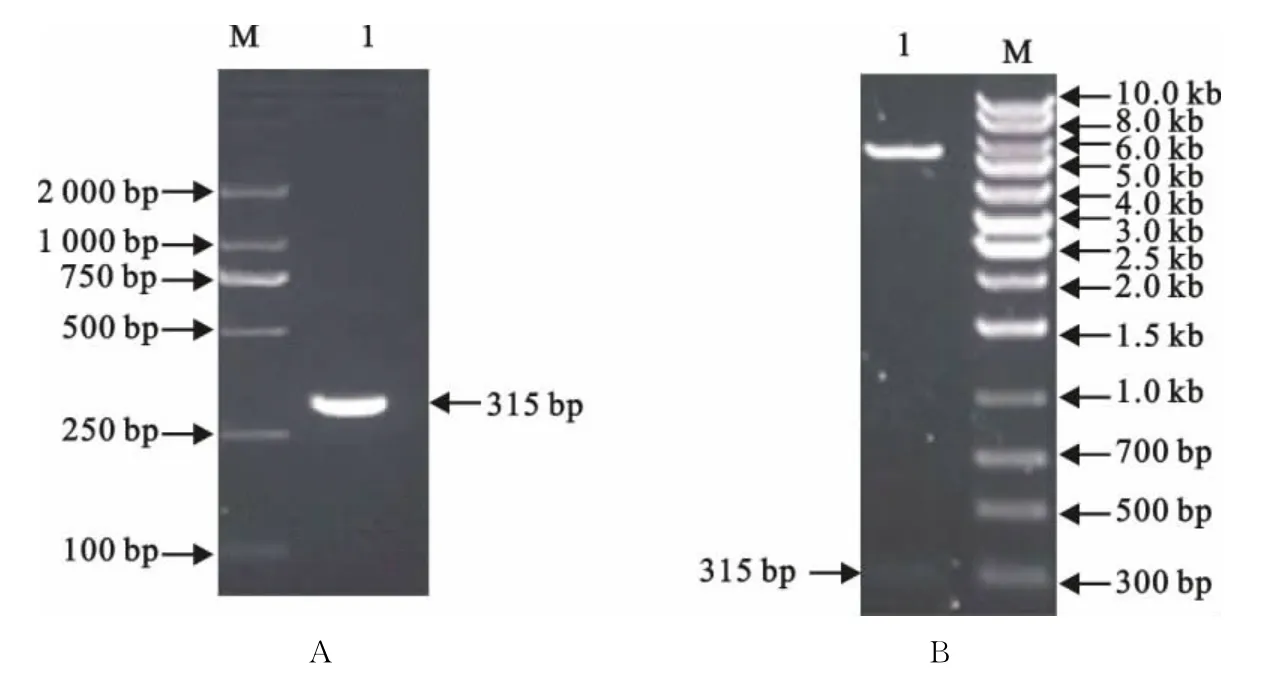
图1 HCMV-gB(57aa~146aa)片段的PCR扩增和重组表达质粒的酶切鉴定Fig.1 PCR amplification of HCMV-gB(57aa-146aa)fragment and enzyme digestion of the recombinant plasmid
2.2 HCMV-gB(57aa~146aa)重组蛋白的表达和纯化
pET21b(+)-gB(57aa~146aa)重组质粒转化Rosetta(DE3)感受态细胞,IPTG诱导表达后超声裂解细菌,重组蛋白以包涵体形式存在,用尿素溶解后通过镍胶亲和层析纯化,结果显示在咪唑浓度为50、100、200mmol/L洗脱液中含有大小约12ku的目的重组蛋白,且纯度较高(图2)。
2.3 ELISA检测免疫血清抗体效价
以CpG-ODN和Al(OH)3复合佐剂作为上述重组蛋白的免疫佐剂,通过0周和3周2次肌肉注射免疫Balb/c小鼠,并在第5周采血分离免疫血清,通过ELISA检测免疫血清抗体滴度达到1∶51200~1∶102400。
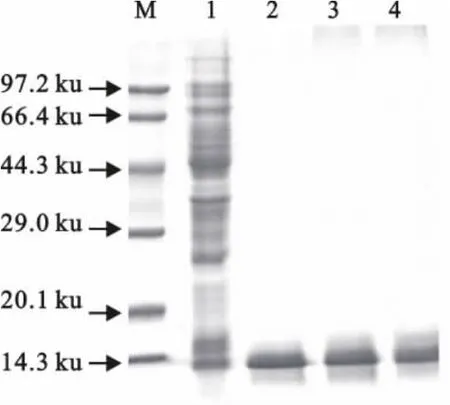
图2 HCMV-gB(57aa~146aa)片段的表达和纯化Fig.2 Expression and purification of HCMV-gB(57aa-146aa)fragment
2.4 Western blot检测免疫血清对哺乳动物细胞表达的HCMV-gB1和gB2的反应性
用所制备免疫血清作为一抗按1∶500稀释检测哺乳动物细胞表达的HCMV-gB1和gB2,结果显示两个重组蛋白均可出现3条特异性条带,根据分子质量推测可能分别为单体、二聚体和三聚体(图3)。
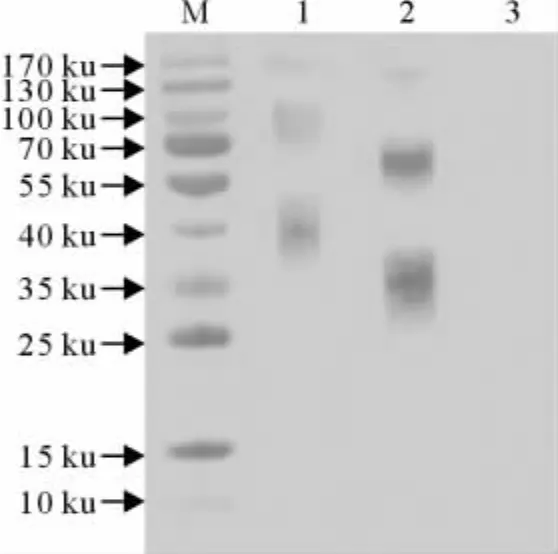
图3 Western blot检测免疫血清对HCMV-gB1和gB2的反应性Fig.3 Western blot analysis for reactivity of anti-sera against HCMV-gB1and gB2
3 讨论
HCMV感染严重危害人类健康,疫苗研究已开展了40多年[8],但仍无有效疫苗被批准上市。由于安全性和免疫效果不理想等方面原因,制备全病毒疫苗希望渺茫,目前HCMV疫苗研究主要寄希望于重组蛋白亚单位疫苗。包膜糖蛋白gB为HCMV的主要保护性抗原,也是蛋白亚单位疫苗研究的主要靶抗原。gB亚单位疫苗研究中需要相应的单克隆或多克隆抗体对候选疫苗抗原进行定性和定量分析。本研究在原核系统中表达了截短的HCMV-gB重组蛋白,并以AI(OH)3和CpG-ODN为联合佐剂免疫小鼠,在5周内即可制备获得高效价的gB特异性免疫血清,为进一步研究以gB为基础的HCMV疫苗提供了工具。
本研究中免疫小鼠制备gB免疫血清的方法与常规免疫家兔制备多克隆抗体的方法相比[9-12],具有以下几方面的优势:①蛋白用量大大减少,本文中每只小鼠免疫剂量仅为8μg,为常规家兔免疫的十分之一甚至百分之一;②免疫次数少,仅需2次免疫,而常规家兔免疫往往需要4~5次;③免疫血清效价高,本文中制备的免疫血清ELISA滴度高达1∶51200~1∶102400,与常规家兔免疫获得的抗体滴度相近;④需时短,本方法仅需5周,而常规家兔免疫往往需要8周~10周;⑤操作简便,不需要与弗氏完全佐剂或不完全佐剂的乳化过程;⑥成本低,小鼠与家兔相比,价格低且易饲养。
本研究采用一种独特的小鼠多克隆抗体制备方法,简便快速地获得了HCMV-gB高效价免疫血清,为HCMV亚单位疫苗的研究提供了研究工具,同时也为其他蛋白抗原的多克隆抗体制备提供了通用方法。
[1]罗 丹,方 峰.人巨细胞病毒疫苗的相关研究进展[J].In-fect Dis Info,2006,19(3):124-127.
[2]李登华,马玉燕,王磊一.孕妇与胎儿巨细胞病毒感染的研究[J].现代妇产科进展,2001,10(5):367-369.
[3]Boeckh M,Nichols W G,Papanicolaou G,et al.Cytomegalovirus in hematopoietic stem cell transplant recipients:current status,known challenges,and future strategies[J].Biol Blood Marrow Transplant,2003,9(9):543-558.
[4]夏俊保,段巧建,王明丽.人巨细胞病毒与动脉粥样硬化的相关性研究进展[J].安徽医学,2009,30(10):1244-1246.
[5]Adler S P.Human CMV vaccine trials:What if CMV caused a rash[J].Gen Virol,2008,41(3):231-236.
[6]Axelsson F,Persson J,Moreau E,et al.Novel antibody specificities targeting glycoprotein B of cytomegalovirus identified by molecular library technology[J].New Biotechnol,2009,25(6):429-436.
[7]Feire A L,Roy R M,Manley K,et al.The glycoprotein B disintegrin-like domain binds beta 1integrin to mediate cytomegalovirus entry[J].Virology,2010,84(19):10026-10037.
[8]Arvin A M,Fast P,Myers M,et al.Vaccine development to prevent cytomegalovirus disease:Report from the National Vaccine Advisory Committee[J].Clin Infect Dis,2004,39(15):233-239.
[9]刘秀财,李耕慧,郭伟华.丙型肝炎NS5A基因多克隆抗体的制备[J].中国医药导报,2010,15(7):20-22.
[10]曾 岩,任晓峰,蔡皓璠,等.鸡γ-干扰素基因原核表达及多抗血清的制备[J].中国家禽,2010,32(1):20-23.
[11]孙慧慧 朴敬爱 李文哲,等.原核表达C-myc蛋白的多克隆抗体制备[J].安徽农学通报,2011,17(1):56-58.
[12]雷孝锋,江志钢,李 志,等.斑马鱼心脏发育标记基因Wntll的多克隆抗体制备[J].生命科学研究,2011,15(2):107-110.

