猪源乳酸菌抑制致病性大肠埃希菌研究*
倪敬轩,杨 英
(内蒙古农业大学兽医学院,内蒙古 呼和浩特 010018)
猪大肠埃希菌病是由致病性大肠埃希菌的某些血清型引起的猪不同疾病的统称,以新生和幼龄猪为主的肠道传染病为特征。包括仔猪黄白痢、仔猪水肿病、仔猪断奶腹泻等,对养猪业造成了较大的威胁和重大的经济损失[1]。
乳酸菌是仔猪肠道的优势菌。一方面,乳酸菌与病原菌竞争黏附位点和营养,抑制有害菌在消化道的增殖。另一方面,乳酸菌产生抑制病原菌生长的物质,如细菌素(bacteriocin)、过氧化氢、二氧化碳、有机酸等可抑制病原菌,调整胃肠道菌群平衡。Barrow P A给仔猪饲喂乳酸菌可显著降低肠道中大肠埃希菌的数量[2-4]。
本研究以健康仔猪新鲜粪便为菌源,对乳酸菌进行分离与鉴定,就所获得的菌株进行抑菌性筛选、生长曲线和pH的测定研究,以期获得适合仔猪用微生态制剂优良菌种。
1 材料与方法
1.1 材料
1.1.1 样品 用棉拭子法从萨拉齐、东胜和集宁3个规模化猪场采集2、5、11、17、25、30(断奶)、38、42d共8个日龄的健康仔猪新鲜粪便。
1.1.2 标准菌株 3株致病性大肠埃希菌(CVCC195、CVCC 224、CVCC1477),购自国家兽医微生物菌种保藏中心;嗜酸乳杆菌(CICC6095),购自中国工业微生物菌株保藏中心;植物乳杆菌,由内蒙古农业大学食品科学与工程学院提供。
1.1.3 主要试剂和仪器 微量生化鉴定管购自广东环凯生物微生物科技有限公司;细菌DNA提取试剂盒购自天根生工生物工程(上海)有限公司;核酸染料、DNA Marker DL 5000购自宝生物工程(大连)有限公司;EasyTaqTM DNA Polymerase购自北京全式金生物技术有限公司;TPY液体培养基,MRS液体、半固体、固体培养基,营养肉汤、营养琼脂培养基[5-6]均自行配制。
厌氧培养箱 (1029Forma Autoclave System,Thermo Electron Corporation);FD-1真空冷冻干燥机;高速冷冻离心机(Eppendorf 5417R,德国);BCN-1360型生物洁净工作台(苏州净化设备有限公司);PCR扩增仪(Eppendorf,德国);DYY-12型电泳仪(北京市六一仪器厂);紫外凝胶成像分析系统(Biorad,意大利);牛津杯(内径6.00mm±0.10mm,外径7.80mm±0.10mm,高10.00mm±0.10mm)。
1.2 方法
1.2.1 样品富集、分离、纯化 样品放入TPY液体培养基,38℃下厌氧富集培养24h。用接种环取培养液划线接种于MRS固体培养基中,38℃厌氧培养24h。待菌落形成后,每个平皿挑取4个~6个有融钙圈的形态、大小、颜色、光泽、透明度各异的菌落再次划线接种于MRS固体培养基上,38℃下厌氧培养24h,挑取单菌落的一半做革兰染色。如果菌落纯化良好则将另一半菌落穿刺保存或加冻菌保护液后冷冻保存;如果菌落镜检不纯则继续划线培养,直至菌落特征和菌株镜检纯化良好[7]。
1.2.2 牛津杯法筛选 按文献[8-9]进行。初筛以3株致病大肠埃希菌作为指示菌,测定分离菌株发酵上清液的抑菌活性,保留具有抑菌活性的菌株。分离菌株和3株致病大肠埃希菌分别通过MRS液体培养基和营养肉汤培养基活化3代,在内径一致的平皿中加入15mL水琼脂。待凝固完全后,每个平皿中均匀放置7个灭菌牛津杯,缓慢倒入30mL营养琼脂(含106CFU个大肠埃希菌)。待第2层培养基完全凝固,用镊子拔出牛津杯,用移液枪向牛津杯形成的小孔内加入0.2mL分离菌株发酵产物上清液,中间孔加入0.2mL MRS液体培养基。加样完毕后平皿放入4℃冰箱中扩散12h后放38℃下培养24h左右,待孔内上清液扩散完全。观察抑菌环的有无,保留有抑菌作用的菌株,每个样品进行两个平行试验,试验重复3次;复筛方法同初筛。每个抑菌环用游标卡尺在不同位置测3次直径取平均值,保留抑菌作用最强的菌株,每个样品两个平行,试验重复3次。
1.2.3 生化鉴定 参照文献[7,10]进行。对革兰阳性无芽胞杆菌做硝酸盐还原试验,明胶液化试验,过氧化氢酶试验,靛基质试验和硫化氢试验以及运动性检查。鉴定为乳杆菌属的乳酸菌通过糖发酵试验进行乳酸杆菌的种间鉴定,用植物乳杆菌作阳性对照。
1.2.4 分子鉴定 依据乳酸杆菌16SrRNA基因的保守区设计一对引物F(5′-CTGGCGGCGTGCCTAATA-3′)和R(5′-CGCTCGTTGCGGGACTTA-3′)。以乳酸杆菌基因组DNA为模板,利用引物扩增1024bp的基因片段,将PCR产物送中美泰和生物技术(北京)有限公司进行序列测定。应用DNA Star软件中的MegAlign将扩增序列与Gen-Bank中 的 L.aviarius DSM20655 (登陆号M58808)、L.brevis ATCC14869(登陆号 M58810)、L.mali DSM20444(登陆号 M58824)、L.crispatus DSM20584 (登 陆 号 Y17362)、L.fermentum ATCC14931(登陆号 M58819)、L.plantarumJCM 1149(登陆号 D79210)、L.acidophilus ATCC4356(登陆号 M58802)和L.salivarius ATCC11741(登陆号AF089108)的16SrRNA基因进行同源性分析。
1.2.5 乳酸菌生物学特性试验
1.2.5.1 生长曲线的测定 待测菌株MRS液体培养基38℃下活化3代。取培养24h的菌液,以2%接菌量接入22支5mL/支的MRS液体培养基中,另取22支5mL/支的MRS液体培养基做空白对照。38℃下温箱静置培养54h,分别在0、2、4、6、8、10、12、14、16、18、20、22、24、26、28、30、32、34、38、42、48、54h取1支试管和1支空白对照测定OD600值和pH。
1.2.5.2 pH 测定 用梅特勒-托利多精密pH 计测量上述不同时间段所取菌液的pH。
1.2.6 14号菌株与标准嗜酸乳杆菌抑菌活性对比把前期分离的抑菌活性最强的14号菌株,与文献中报道抑制致病性大肠埃希菌活性最强的嗜酸乳杆菌进行抑菌活性比较,试验选用的嗜酸乳杆菌标准菌株分自猪直肠。
2 结果
2.1 分离菌株形态特征和牛津杯法筛选结果
8个样品分离纯化得到35株疑似乳酸菌,牛津杯法筛选后保留2株,分别为11号和14号。菌落形态均为淡黄色,中等大小,圆形,中央稍隆起,表面光滑,边缘不整齐,半透明;菌体形态均为革兰阳性,两端钝圆,无芽胞杆菌,细长,稍弯曲,单个、两个或一线排列。
经牛津杯法初筛,35株分离菌淘汰23株没有抑菌环的菌株。经牛津杯法复筛,剩余12株菌保留2株抑菌环最大的菌株(11号和14号)。结果见图1和表1。
2.2 生化鉴定结果
2.2.1 乳酸菌属的鉴定 乳酸菌属的鉴定结果见表2,11、14号菌株为革兰阳性无芽胞杆菌,触酶试验、硝酸盐还原试验均为阴性,不液化明胶,不产生吲哚和硫化氢,无运动性,鉴定其为乳酸杆菌属[7]。
2.2.2 乳酸杆菌的种间鉴定 种间鉴定结果见表3,11号除不发酵甘露醇外,其他性质符合唾液乳杆菌,14号菌性质完全符合唾液乳杆菌。
2.3 分子鉴定结果
用10g/L的琼脂糖凝胶对试验菌株的16S rDNA扩增产物做电泳检测,植物乳杆菌做阳性对照。经核酸染料染色后,在1000bp处出现荧光条带,与预期结果一致(图2)。
菌株11、14号的16SrDNA序列与GenBank/EMBL/DDBJ中8个乳杆菌属标准菌株的16S rDNA序列进行同源性比较(图3)。11号、14号与唾液乳杆菌(L.salivarius)的同源性分别为99.3%,99.4%,它们之间同源性为99.9%。这与生化鉴定结果一致,判定11号、14号菌株为唾液乳杆菌[11-12]。
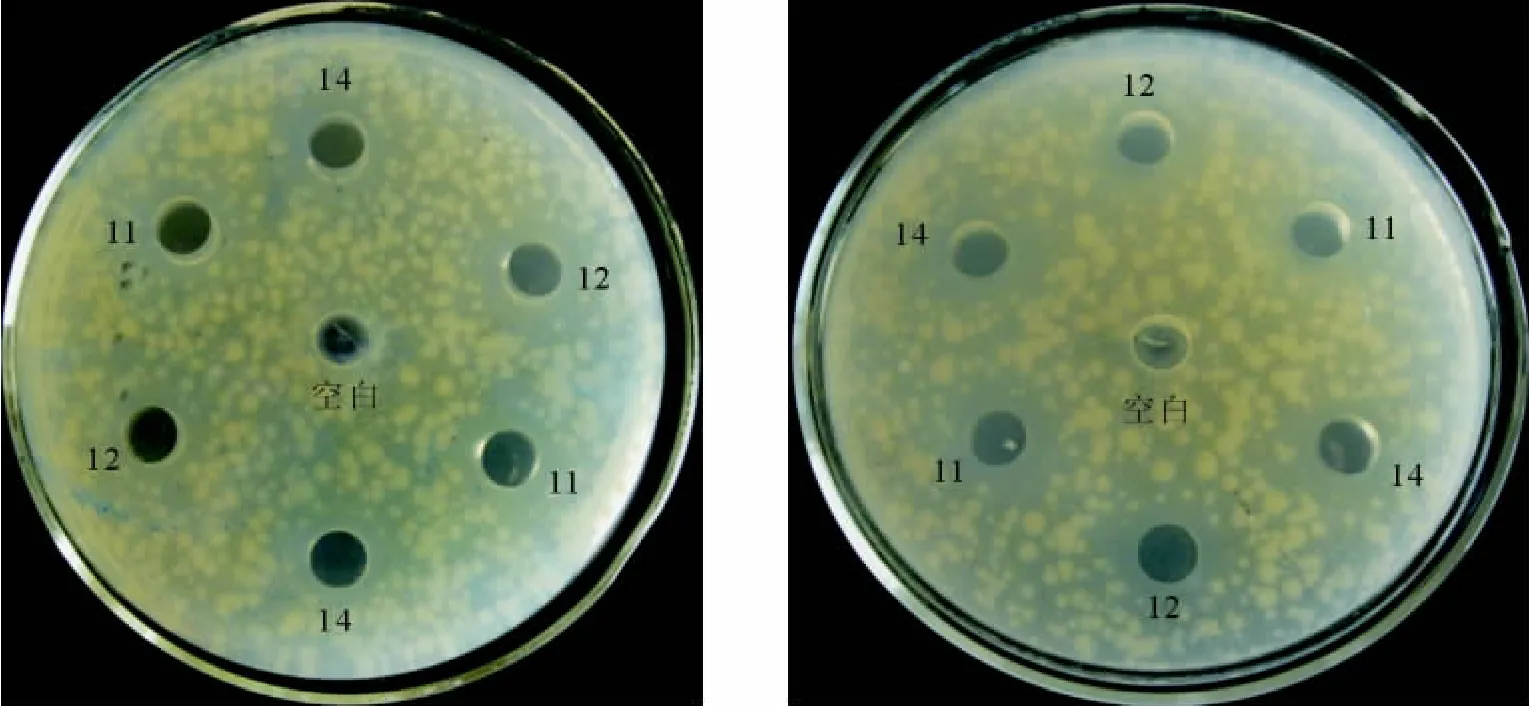
图1 牛津杯法复筛Fig.1 The second screening of Oxford cup method
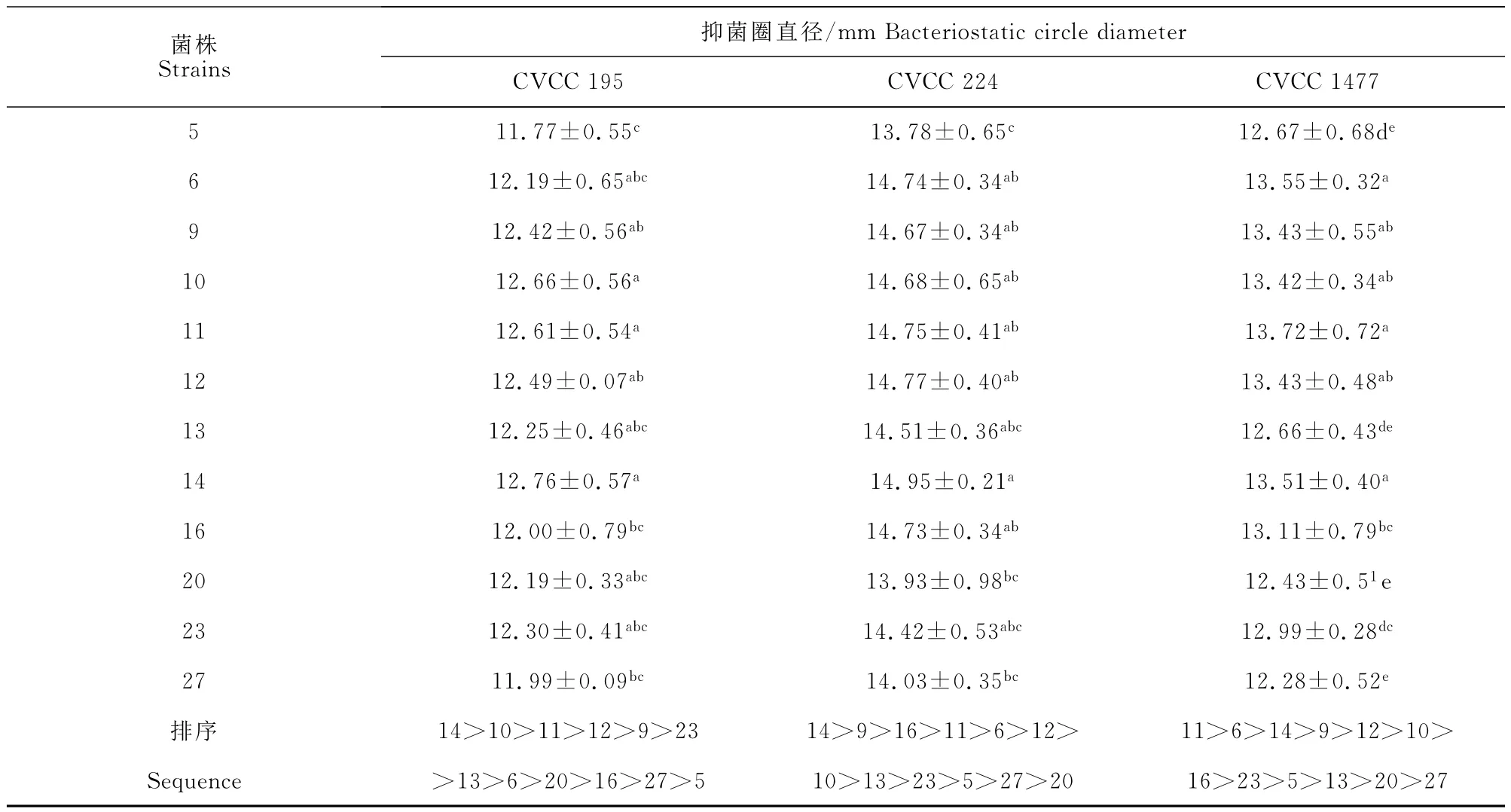
表1 12株疑似乳酸菌对3株致病大肠埃希菌的抑菌直径(M±SD)Table1 Bacteriostatic annulus diameters of 12strains suspected Lactobacillus inhibit 3strains of pathogenic Escherichia coli(M±SD)
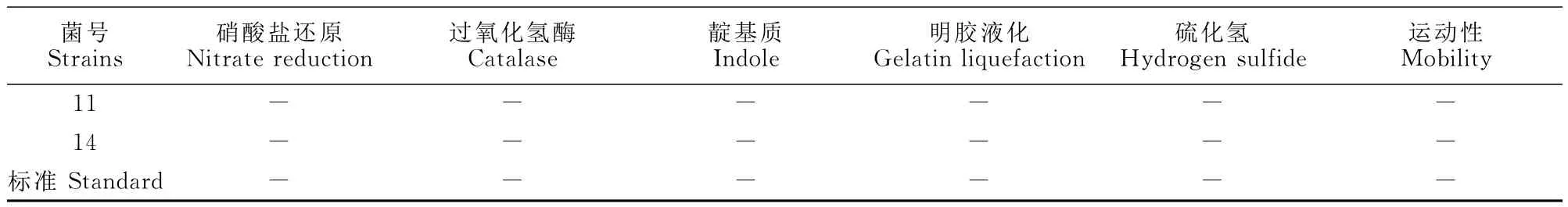
表2 乳杆菌属的鉴定结果Table2 The identification results of genus Lactobacillus
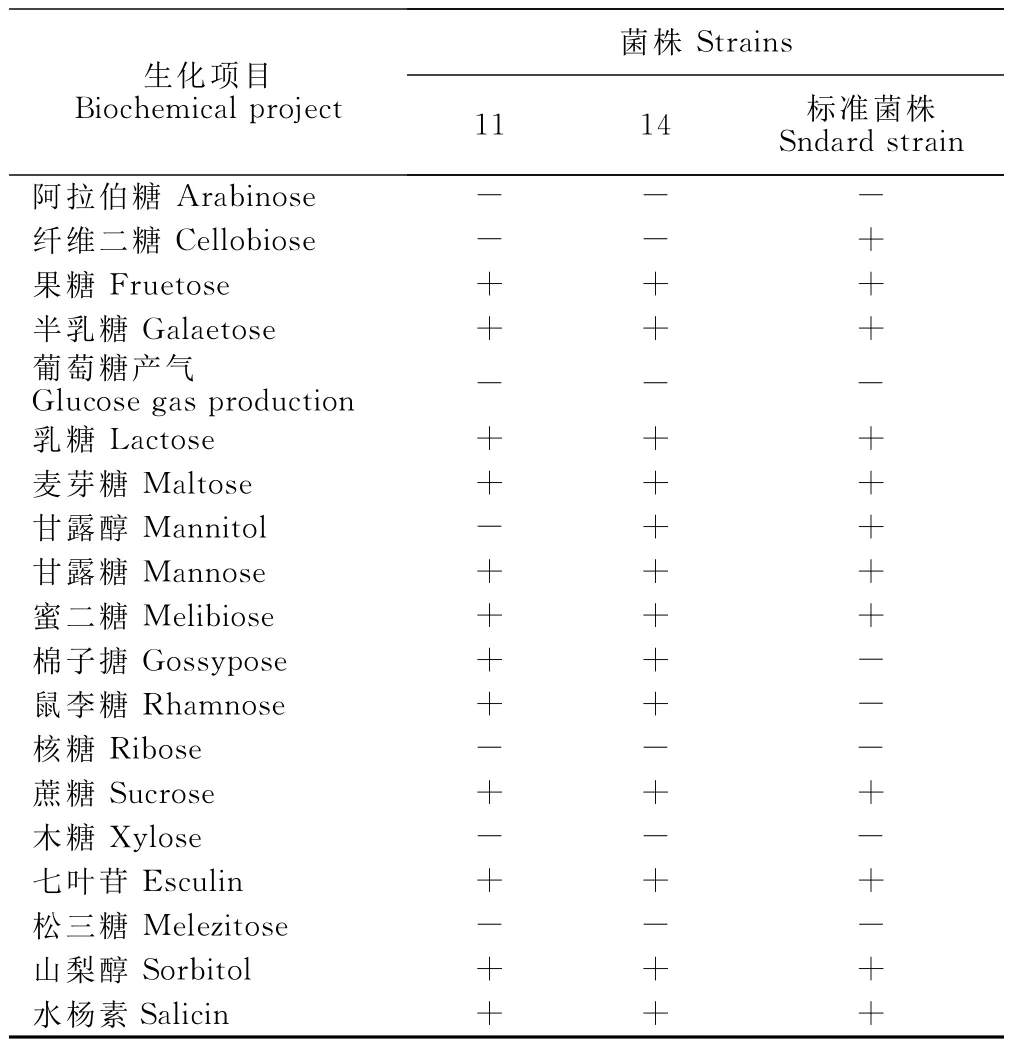
表3 乳杆菌的种间鉴定结果Table3 The identification results of genus Lactobacillus
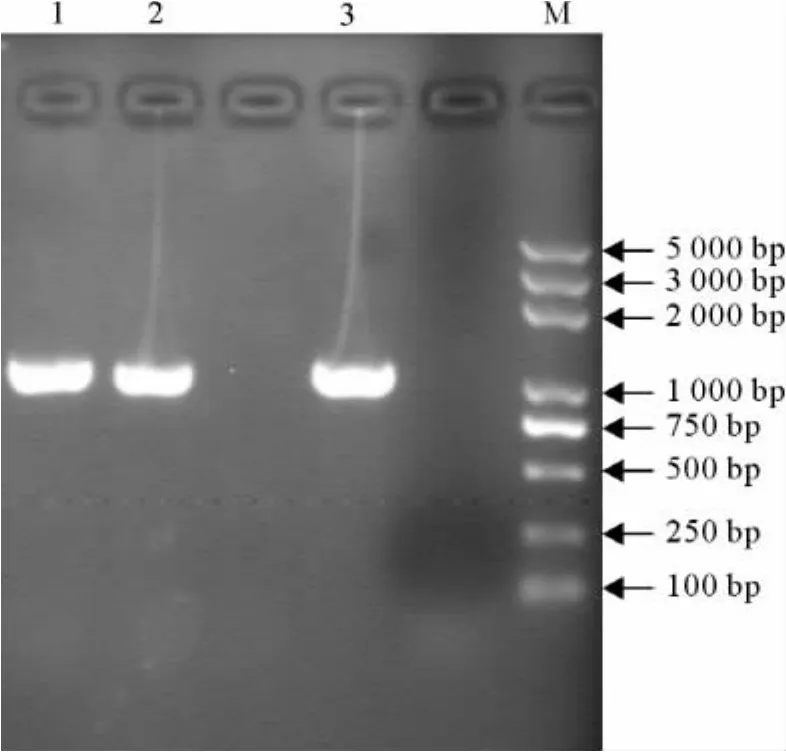
图2 PCR扩增结果Fig.2 Identification results of PCR
2.4 乳酸菌生长曲线及产酸性能的测定
由图4和图5可以看出,11号和14号菌株均在20h~22h左右进入稳定期,生长曲线较一致,而且2株菌产酸性能均比较好,最低pH为3.22。
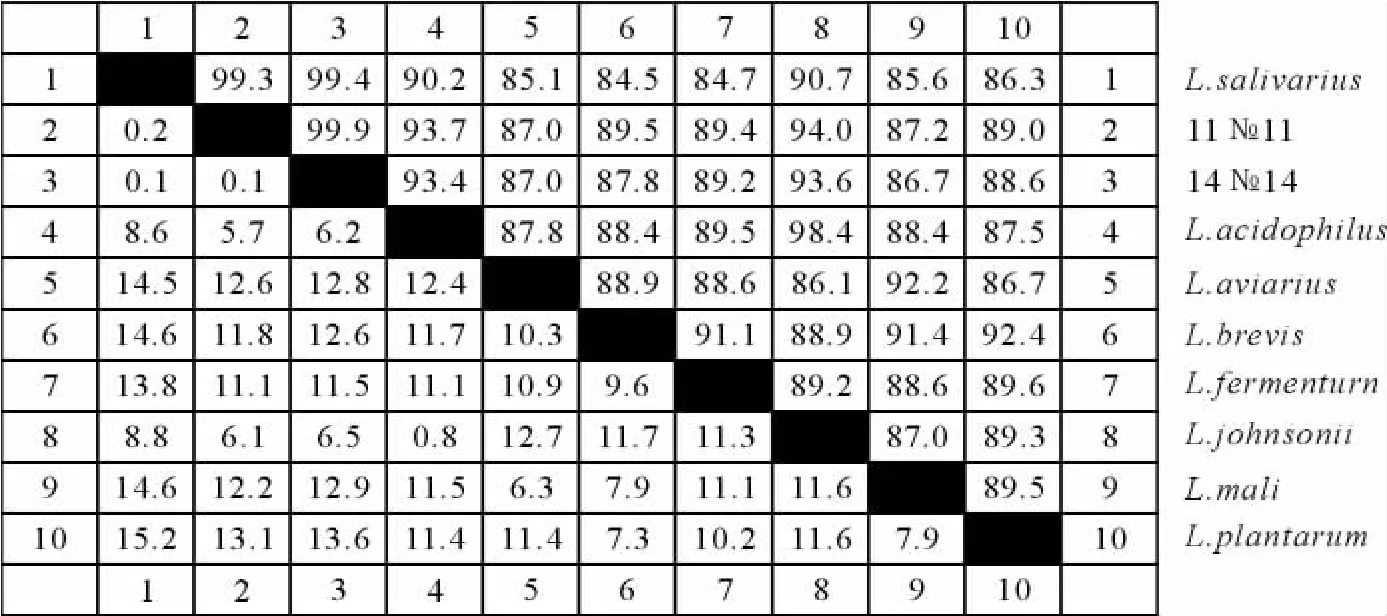
图3 11号和14号菌株16SrDNA序列同源性分析Fig.316 SrDNA homology analysis of strains No.11and No.14
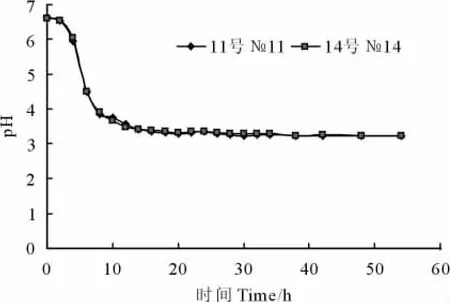
图4 乳杆菌培养物pH随培养时间变化曲线Fig.4 The changes of Lactic acid bacteria pH along with the culture time
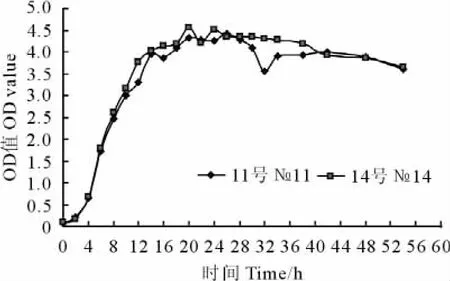
图5 乳杆菌培养物OD值随培养时间变化曲线Fig.5 The changes of Lactic acid bacteria OD along with the culture time
综合牛津杯法,生长曲线及产酸性能的测定,挑选14号菌株作为仔猪用微生态制剂优良菌种。
2.5 14号菌株与标准嗜酸乳杆菌抑菌活性对比
取2株菌3代培养物的上清液做牛津杯抑菌试验(表4),结果14号菌抑菌效果远远强于嗜酸乳杆菌标准菌株,且差异显著。
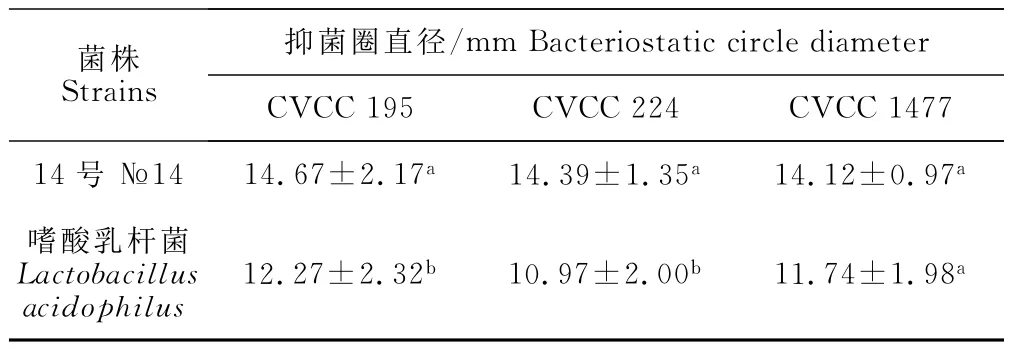
表4 乳杆菌对3株致病大肠埃希菌的抑菌直径(M±SD)Table4 Bacteriostatic annulus diameters of Lactobacillus inhibit three strains pathogenic Escherichia coli(M±SD)
3 讨论
由于猪肠道为厌氧环境,菌株的分离与纯化全部在厌氧培养箱中进行,培养温度以及培养基pH也尽量保证与仔猪肠道环境一致(38℃,近中性)这样保证了分离的准确性和减少菌株变异[13]。牛津杯法操作步骤繁琐,要求操作者技术娴熟、细致。本人总结前人操作,结合实验原理,并经过摸索对牛津杯打孔法做了一些改进和完善,力求更加精确,简便和重复性好。
(1)减少平皿用量,比如每个平皿可放7个牛津杯。这样降低了误差,节约2倍~3倍工作量,节省了试验耗材和时间。
(2)加样后,放4℃扩散12h,这样能形成清晰抑菌环,否则抑菌环模糊且不易测量。
(3)为保证重复性,指示菌的活力、浓度、菌龄等每次尽量做到一致[14-15]。
本研究中牛津杯法筛选的指示菌为3株致病性大肠埃希菌(O8:K88、K87(B)、O149:K91、K88(ac)、O139:K82(B):H1),分离源为猪,是引起仔猪黄白痢、仔猪水肿病、仔猪断奶腹泻等最主要的病原菌之一,这是分离抑菌效果良好菌株的关键。因为从某一类动物分离到的乳酸菌只对这类动物的消化道上皮表现出较强的黏附性,对其他动物不黏附或低黏附,而这种黏附性是关系到微生物添加剂作用效果的关键问题,这与Timmerman H M等[16]研究一致。而且通过3株猪源致病性大肠埃希菌筛选针对性更强。
牛津杯法筛选出抑菌效果最好的11号和14号菌株,经生化鉴定和分子鉴定,符合唾液乳杆菌特性。综合牛津杯法和生物学特性试验最终保留14号菌株,将14号菌株与文献中抑制致病性大肠埃希菌优良的一株猪直肠分离嗜酸乳杆菌标准菌株进行抑菌对比,结果14号菌抑菌效果远远强于标准菌株,为研究仔猪防腹泻、促增长的微生态制剂提供依据。
[1]甘孟侯,杨汉春.中国猪病学[M].北京:中国农业出版社,2005:279-288.
[2]Chiquette J.The role of probiotics in promoting dairy production[J].Adv in Diary Technol,2009,21:143-157.
[3]de Vrese M,Schrezenmeir J.Probiotics,prebiotics and synbiotics[J].Adv Biochem Eng Biotechnol,2008,111:1-86.
[4]Kinova Sepova H,Bilkova A.Lactobacilli and their probiotic properties[J].Ceska Slov Farm,2008,57:95-98.
[5]凌代文,东秀珠.乳酸菌分类鉴定及实验方法[M].北京:中国轻工业出版社,2002:33-46.
[6]尹军霞,沈国娟,沈 蓉,等.酸菜汁中降胆固醇乳酸菌的分离鉴定[J].中国食品学报,2008,8(2):47-48.
[7]张开屏.植物乳酸菌的鉴定及生物学特性的研究[D].内蒙古呼和浩特:内蒙古农业大学,2008:12-13.
[8]郭艳萍,盛海圆,陈晓琳,等.抑黄曲霉乳酸菌的筛选及菌种鉴定[J].中国微生态学杂志,2010,7(22):583-584.
[9]刘 宇,朱战波,赵星成,等.健康仔猪肠道乳杆菌黑龙江地方株的鉴定与种属分析[J].中国微生态学杂志,2008,20(3):210-215.
[10]王雪飞.苦豆籽粕-双歧杆菌合生元对AA+肉仔鸡免疫功能影响的研究[D].内蒙古呼和浩特:内蒙古农业大学,2010:7.
[11]Oelschlaeger T A.Mechanisms of probiotic actions-A review[J].Int J Med Microbiol,2009,300:57-62.
[12]唐雨蕊,倪学勤.乳酸杆菌对黄曲霉生长抑制的研究[J].中国饲料,2008(5):42-43.
[13]Wang Y W,Liu H,Li P L.Isolation and identification of lactic acid bacteria producing bile salt hydrolase and study on mechnism of recucing colestrol[J].Food Sci,2006,27:215-218.
[14]雷守成.耐特定抗菌药双歧杆菌的鉴定与特性研究[D].内蒙古呼和浩特:内蒙古农业大学,2007:40.
[15]Jaradat Z W,Ababneh Q O.Isolation of Cronobacter spp.(formerly Enterobacter sakazakii)from infant food,herbs and environmental samples and the subsequent identification and confirmation of the isolates using biochemical chromogenic assays,PCR and 16SrRNA sequencing[J].BMC Microbiol,2009,9:225.
[16]Timmerman H M,Veldman A,de Elsen E.Mortality and growth performance of broilers given drinking water supplemented with chicken-specific probiotics[J].Poultry Sci,2006,85:1383-1388.

