Ⅰ型鸭肝炎病毒VP1基因的克隆和表达
吕敏娜,戚南山,覃宗华,廖申权,余劲术,袁建丰,吴彩艳,孙铭飞*
(1.广东省农业科学院兽医研究所,广东 广州 510640;2.广州英赛特生物技术有限公司,广东 广州 510663)
鸭病毒性肝炎(Duck viral hepatitis,DVH)是由鸭肝炎病毒(Duck hepatitis virus,DHV)引起雏鸭的一种高度致死性、传播迅速的病毒性传染病[1]。我国于1963年在上海首次报道了该病的临床病例,1980年在北京某鸭场分离到该病毒[2],郭玉璞等于1984年将该病毒确定了DHV-1[3]。鸭病毒性肝炎临床表现痉挛、抽搐和角弓反张等神经症状,以发病急、传播快、病死率高为主要特征,病理变化以肝脏肿胀和出血为特征性病变[4-5]。Ⅰ型鸭病毒性肝炎呈世界性流行,也是我国主要流行的血清型,此病不仅严重影响养鸭业的发展,而且造成的经济损失也相当严重。
DHV编码含2249个氨基酸的一个多聚蛋白[6],经过一系列蛋白裂解,产生3种结构蛋白(VP0、VP3、VP1)和8个非结构蛋白(2A1、2A2、2B、2C、3A、3B、3C、3D)[7-9]。其中,VP1含有多个抗原表位,不仅能诱导机体产生免疫反应,还能诱导感染动物产生中和抗体,VP1包含了大多数与细胞受体相互作用和中和表位[10-13]。因此,VP1 与DHV的致病性关系密切,作为研制新型疫苗的候选分子而成为近年来的研究热点。
本研究将扩增的DHV-I VP1基因定向克隆到原核表达载体pMAL-C2X中,得到重组表达质粒pMAL-C2X-VP1,利用IPTG 诱导在 E.coli BL21(DE3)进行融合表达,为DHV-I VP1蛋白的结构与功能等后续相关研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 主要试验材料 Ⅰ型鸭肝炎病毒(DHV-I)GD株为广东省农科院兽医研究所分离、保存;E.coli DH5a、BL21(DE3)购自 Novagen公司;pGEMT easy、RNA提取试剂盒、RT-PCR试剂盒购自Promega公司;DNA胶回收试剂盒购自Omega公司;限制性内切酶EcoRⅠ、HindⅢ、DNA Marker DL 2000购自宝生物工程(大连)有限公司;pMALC2X为美国德克萨斯州A和M大学兽医学院朱冠博士惠赠。
1.1.2 引物设计与合成 根据GenBank中发表的Ⅰ型鸭肝炎病毒核甘酸序列,设计了针对VP1基因片段的引物,在上游引物引入EcoRⅠ酶切位点,下游引物中引入HindⅢ酶切位点,引物由上海生工生物工程技术服务有限公司合成。引物序列如下:
上游引物:5′-GGTGGTGAATTCGGTGATTCCAATCAGTTAGG-3′;下游引物:5′-GGTGGTAAGCTTTCATTCAATTTCCAAATTGAG-3′。
1.2 方法
1.2.1 病毒RNA的提取 取经DHV-1GD株强毒感染的病死雏鸭的肝脏,采用RNA提取试剂盒进行DHV-1GD株总RNA抽提,操作参照说明书。
1.2.2 DHV-1VP1基因的扩增和测序根据Promega公司的RT-PCR试剂盒操作说明设置RT-PCR反应体系,并按以下程序进行RT-PCR反应:反转录合成(48℃45min)→第二链合成(94℃2min)→30个循环(94℃变性30s,54.8℃退火1min,68℃延伸2min)→68℃延伸7min→4℃终止反应。将PCR产物经10g/L琼脂糖凝胶电泳,用DNA胶回收试剂盒回收纯化目的片段,并将其与克隆载体pGEM-T easy连接后,转化E.coli DH5α感受态细菌,转化产物铺于SOB平板(含100μg/mL氨苄青霉素)于37℃过夜培养。用蓝白斑筛选方法挑取白色菌落用LB培养基(含100μg/mL氨苄青霉素,以下同)培养后,用菌液PCR法和限制性酶切法对转化克隆进行鉴定,阳性克隆命名为pGEM-VP1,并送上海英骏生物工程公司进行核苷酸序列测定。
1.2.3 重组质粒的构建 取E.coli(pMAL-C2X)新鲜单菌落接种于10mL LB液体培养基中(Amp+),37℃振荡培养16h后,用小量质粒制备试剂盒抽提质粒。用限制性内切酶EcoRⅠ和HindⅢ对所抽提的质粒进行双酶切,酶切产物进行琼脂糖凝胶电泳后,用DNA胶回收试剂盒回收酶切后的质粒片段。将分别经过限制性内切酶EcoRⅠ和HindⅢ双酶切后回收纯化的 DHV-1VP1和pMAL-C2X在T4DNA连接酶作用下连接后用CaCl2法转化E.coli DH5α,利用蓝白斑筛选方法挑取白色菌落用LB液体培养基(Amp+)培养后,用菌液PCR法筛选阳性克隆菌,再经EcoRⅠ 和HindⅢ双酶切鉴定后,将阳性克隆菌送上海英骏公司进行重组质粒核苷酸序列测序,再用质粒小量制备试剂盒提取阳性质粒,此重组质粒命名为pMALC2X-VP1。
1.2.4 重组表达 将重组质粒pMAL-C2X-VP1用CaCl2法转化表达宿主菌E.coli BL21(DE3)。阳性菌落鉴定后命名为 BL21/pMAL-C2X-VP1。挑取BL21/pMAL-C2X-VP1单菌落接种于5mL LB液体培养基中(Amp+),37 ℃、200r/min摇床过夜培养,隔天以1%的接种量转接至50mL LB液体培养基中(Amp+),于37℃、200r/min摇床培养至OD600约为0.6,取1mL未诱导培养物,10000r/min离心1min,收集菌体,加适量1×SDS凝胶加样缓冲液重悬菌体,100℃煮沸3min。余下的培养物加入IPTG(使其终浓度为1mmol/L),于37℃诱导1、2、4h,取1mL培养物如前述步骤处理,进行SDS-PAGE电泳,观察诱导后不同时间外源基因的表达情况。
2 结果
2.1 DHV-1VP1基因的克隆与鉴定
用Ⅰ型鸭肝炎病毒GD株RNA为模板,用设计的引物经RT-PCR扩增,PCR产物经10g/L琼脂凝胶电泳后,得到一条约为750bp的目的条带(图1)。测序结果表明,扩增的VP1基因与预期相符,由714个核甘酸组成,编码237个氨基酸。
2.2 重组质粒的鉴定
DHV-1VP1基因片段经回收纯化后,与克隆载体pGEM-T easy连接后转化E.coli DH5α,得到的重组质粒pGEM-VP1,经PCR鉴定,在约714bp处有一条目的条带(图1)。
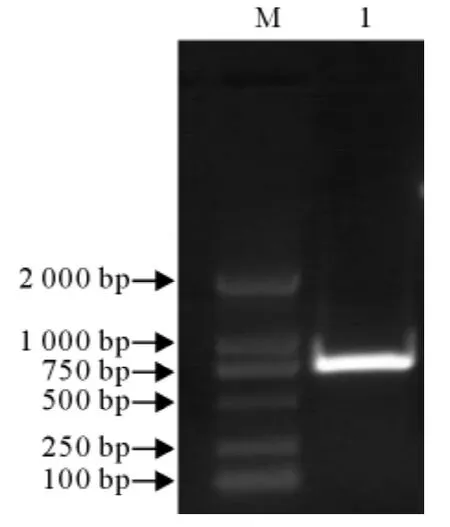
图1 VP1PCR扩增结果Fig.1 The PCR results of VP1
2.3 重组表达质粒的鉴定
重组质粒pMAL-C2X-VP1用CaCl2法转化E.coli BL21(DE3),阳性克隆菌抽提质粒,经EcoRⅠ和HindⅢ双酶切后,可见大小与空载体和VP1片段大小一致的2个条带,前者与线性化pMAL-C2X大小相近,而后者与DHV-1GD株VP1的PCR产物大小一致(图2)。
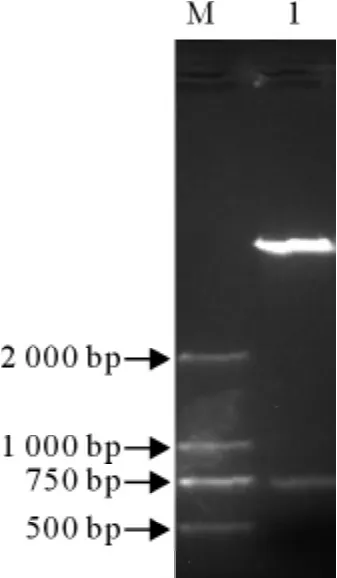
图2 pMAL-C2X-VP1酶切鉴定Fig.2 Identification of pMAL-C2X-VP1 by restriction enzyme digestion
2.4 重组表达载体的诱导表达及SDS-PAGE检测
重组表达质粒pMAL-C2X-VP1鉴定正确后,转化E.coli BL21(DE3),经IPTG诱导后的表达产物,在诱导表达后的1、2、4h取样品进行SDSPAGE电泳分析,结果表明,在诱导1h时已开始表达,融合蛋白的分子质量大约69ku(图3)。

图3 VP1蛋白在大肠埃希菌BL21(DE3)中的表达Fig.3 SDS-PAGE analysis of VP1protein expression in BL21(DE3)
3 讨论
Ⅰ型鸭肝炎病毒属小RNA病毒科,基因组为单股正链RNA,全长为7707bp~7713bp,内含一个编码2249个氨基酸多聚蛋白的开放阅读框(ORF)。结构蛋白 VP1位于 DHV-1基因组的2103位~2816位,VPl全基因由714个核苷酸组成,编码238个氨基酸[14]。然而,目前对 DHV-1 VP1蛋白的研究不多,其结构和功能未明确,因此与VP1蛋白相关的研究不仅具有重要的理论意义,而且对于应用也具有广泛的指导价值。
本研究利用RT-PCR技术获得Ⅰ型鸭肝炎病毒的VP1基因,并用pMAL-C2X表达载体成功表达了DHV-1结构蛋白VP1,利用序列分析表明,所克隆的VP1基因长度为714bp,编码237个氨基酸,原核表达产物大小约为69ku。这为深入研究VPl蛋白的结构与功能及研制DHV-1的新型疫苗与诊断试剂盒奠定了基础。
一直以来,Ⅰ型鸭病毒性肝炎的流行给我国的养鸭业带来了巨大的损失和严重的威胁。随着DHV-1全基因组序列的发表和分子生物学技术在兽医领域的广泛应用,进一步将基因工程技术表达的抗原或是根据蛋白质分子的某一抗原决定簇的氨基酸序列人工合成的多肽片段抗原运用到免疫学检测方法中,达到高特异性、高敏感性的效果是今后的研究方向。
[1]Saif Y M.禽病学[M].高 福,苏敬良,索 勋,译.第11版.北京:中国农业出版社,2005.
[2]王 平,潘文石,胡寿之,等.北京小鸭病毒性肝炎的研究(一)诊断与防治[J].北京大学学报:自然科学版,1980,10(1):55-72.
[3]蔡宝祥.家畜传染病[M].4版.北京:中国农业出版社,2001.
[4]郭玉璞,潘文石.北京鸭病毒性肝炎血清型的初步鉴定[J].中国兽医杂志,1984,10(11):2-3.
[5]陈育新,曾凡同,沈慧乐,等.中国家禽[M].北京:中国农业出版社,1988:463-470.
[6]马秀丽,宋敏训,于可响,等.鸭病毒性肝炎病毒VP1基因表达及其抗体检测ELISA方法的建立[J].微生物学报,2008,48(8):1110-1114.
[7]Carrillo C,Wigdorovitz A,Oliveros J C,et al.Protective immune response to foot and mouth disease virus with VP1expressed in transgenic plants[J].J Virol,1998,72(2):1688-1690.
[8]Brown F,Benkirane N,Limal D,et al.Delineation of a neutralizing subregion within the immunodomain epitope(GH Loop)of foot-and-mouth disease virus VP1which does not contain the RGD motif[J].Vaccine,1999,18(1-2):50-56.
[9]Liu M,Zhang T,Zhang Y,et al.Development and evaluation of a VP 1-ELISA for detection of antibodies to duck hepatitis type 1virus[J].J Viro l Meth,2010,69(1):66-69.
[10]Balamurugan V,Renji R,Saha S N.Protective immune response of the capsid precursor polypeptide(P1)of foot and mouth disease virus type O produced in Pichia pastoris[J].Virus Res,2003,92(2):141-149.
[11]Mason P W,Grubman M J,Bant B.Molecular basis of pathogenesis of FMDV[J].Virus Res,2003,91(3):9-32.
[12]刑继兰,潘 洁,陈 波,等.口蹄疫病毒结构蛋白基因的表达与应用研究[J].中国预防兽医学报,2007(4):209-302.
[13]Liu G,Wang F,Ni Z,et al.Gene tic diversity of the VP1 gene of duck hepatitis virus type I(DHV-I)isoates from southeast China is related to isolate attenuation[J].Virus Res,2008,137(1):137-141.
[14]Tseng C H,Tsai H J.Molecular characterization of a new serotype of duck hepatitis virus[J].Virus Res,2007,126(1-2):19-31.

