猪日本脑炎病毒NS3蛋白的基因克隆、原核表达及纯化*
韩秀杰,张保新,赵凡凡,余风艳,沈红霞,王晓杜
(浙江农林大学动物科技学院,浙江 临安 311300)
日本脑炎病毒(Japanese encephalitis virus,JEV),又称乙型脑炎病毒,属于黄病毒科黄病毒属单股正链RNA病毒,它可引起以中枢神经系统损害为主的虫媒性人畜共患病,即日本脑炎或乙型脑炎[1]。每年在全球有30000~50000个乙型脑炎病例,其中超过10000人死亡,乙型脑炎广泛分布于东南亚各地区,而我国是乙型脑炎发病人数最多的国家之一,占世界总发病数的80%以上[2],幸存者约有一半留有严重的神经和精神后遗症。而在动物中猪是JEV的主要感染对象和寄存宿主,种猪感染JEV后表现为繁殖机能障碍,母猪表现为产死胎、木乃伊胎等。该病的发生既严重影响养猪业的健康发展,同时也对公共卫生具有重要的影响。
JEV的基因组为单股、正链RNA分子,其长度约为11kb(10976bp),裸露的病毒RNA有感染性。在宿主和病毒蛋白酶的切割下,JEV产生3种结构蛋白,即C蛋白(壳/核心蛋白)、PrM/M(膜前体蛋白/膜蛋白)和E蛋白(囊膜糖蛋白)以及7种非结构白,即 NS1、NS2a、NS2b、NS3、NS4a、NS4b和NS5[3]。自从该病毒产生以来,进化出5种基因型,逐渐遍布整个亚洲[4]。
JEV NS3基因全长约1850bp,编码蛋白的分子质量为64ku。它是一个具有丝氨酸蛋白酶、螺旋酶、核苷酸5′磷酸酶的活性蛋白质,在病毒前体蛋白剪切和基因组RNA复制中具有重要作用[5]。有研究表明NS2B-NS3蛋白酶复合物的形成,有利于C-prM前体的剪切加工,并使C和prM分泌增加[6]。在JEV感染细胞中,NS3与微管和肿瘤敏感基因101蛋白密切相关,在病毒的RNA装配、病毒成分胞内运输以及病毒的装配中发挥重要作用[7-9]。NS3主要定位在JEV诱导的膜泡上,该膜泡是病毒成分贮存主要场所,NS3蛋白有利于病毒的装配。Chen C J等[10]。研究表明,NS3和NS5在体内相互作用形成蛋白复合物,继而与3′端非编码区的茎环结构形成复制复合体,参与负链RNA的合成。因此,NS3蛋白可能是一个潜在的药物靶标分子,在抗JEV病毒药物开发方面具有重要作用[9]。
本研究拟克隆猪日本脑炎病毒的NS3基因,构建重组原核表达载体,在大肠埃希菌中大量表达,并纯化该重组蛋白,鉴定其免疫学活性,为探讨该蛋白的功能及病毒复制的相关研究打下基础。
1 材料与方法
1.1 材料
猪日本脑炎病毒SH-JEV01毒株由中国农业科学院上海兽医研究所马志永研究员惠赠;BHK-21细胞原核表达载体pET-28(a)、大肠埃希菌感受态细胞、DH5α和BL21(DE3)由浙江农林大学兽医微生物学实验室保存。
DNA Marker DL 2000,限制性内切酶EcoRⅠ和SalⅠ,AMV反转录试剂盒,Taq DNA聚合酶等购自宝生物工程(大连)有限公司;T4DNA ligase购自 NEB公司;异丙基硫代-β-D-半乳糖苷(IPTG)购自Sigma公司;Trizol购自invitrogen公司;UNIQ-10柱式DNA胶回收试剂盒购自宝生物工程(大连)有限公司,A型小量DNA片段快速纯化回收试剂盒购于北京博大泰克基因技术有限公司;质粒DNA小量试剂盒购自上海华舜生物公司。其他试剂为国产分析纯。
1.2 方法
1.2.1 病毒基因组RNA的提取 将JEV感染的BHK-21细胞样品重悬于 Trizol试剂中,室温10min后,加入1/3体积的氯仿,反复混匀后室温5min。以15000r/min离心15min,小心吸取上清转移至另一离心管中,加入等体积的异丙醇,反复混匀后室温沉淀5min,以15000r/min离心15min。去掉上清后,用700ml/L乙醇洗涤沉淀1次,室温干燥后,溶于适量的RNase free水中,置-20℃贮存备用。
1.2.2 RT-PCR 扩增JEV NS3基因 根据 AMV反转录试剂盒说明书上的方法,将上面提取的病毒基因组RNA,利用随机引物扩增下合成cDNA。以此cDNA 为模板,引物 F:5′GCGGAATTCATGGGGGGCGTGTTTG 3′;R:5′GCGGTCGACTTATCTCTTCCCTGCT 3′,在PCR管中加入如下20μL体系:RNA se Free ddH2O,14.3μL;10 ×buffer 2μL;dNTPs 1.6μL;10μmol/L 引物各0.4μL;Taq酶0.3μL;cDNA模板1μL。在PCR仪中以下面条件进行PCR扩增:94℃5min;94℃50s,58℃50s,72℃2min,共35个循环;循环结束后72℃10min,最后4℃终止反应。10g/L琼脂糖凝胶电泳观察结果。
1.2.3 pET-28(a)-JEV-NS3重组质粒构建 将上述胶回收的JEV-NS3的PCR产物和pET-28(a)空载体分别用EcoRⅠ、SalⅠ酶进行双酶切,酶切回收后,在T4连接酶作用下,把JEV-NS3亚克隆到pET-28(a)质粒上,转化大肠埃希菌 DH5α,挑取克隆经PCR和双酶切鉴定为阳性者,送上海英骏生物公司测序鉴定。
1.2.4 重组蛋白JEV-NS3的诱导表达 将上述鉴定好的阳性重组质粒pET-28(a)-JEV-NS3转化到E.coli BL21(DE3)内,挑取克隆扩大培养,细菌生长到对数期时加入1mmol/L的IPTG,诱导3h后,取样并煮沸制备样品,SDS-PAGE电泳检测重组JEV NS3蛋白表达情况。
1.2.5 重组JEV NS3蛋白的包涵体提取与纯化将1.2.4鉴定好的表达JEV NS3蛋白的阳性克隆扩大到100mL进行培养,当细菌生长到对数期时,加入1mmol/L的IPTG,诱导表达3h后,收集菌体,按照王晓杜等[11]方法提取包涵体,并对溶解的包涵体进行复性,透析后制备大量可溶性的重组JEV NS3蛋白。SDS-PAGE检测该蛋白包涵体提取和复性效果。
2 结果
2.1 JEV NS3基因RT-PCR 结果
以JEV的cDNA为模板,RT-PCR扩增JEV NS3的基因片段,在该片段前面加上起始密码子ATG和后面加上终止密码子TAA,引物两端分别加有EcoRⅠ、SalⅠ酶切位点。扩增的PCR产物经琼脂糖凝胶电泳检测,获得大小1.8kb左右的片段,与预期大小基本一致(图1)。
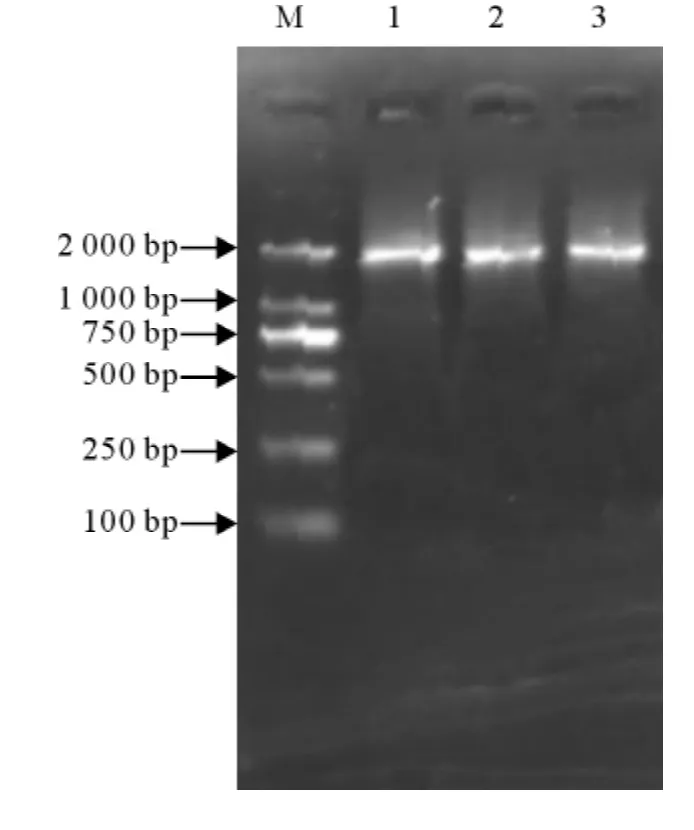
图1 JEV-NS3基因的RT-PCR扩增结果Fig.1 Amplification of JEV NS3gene by RT-PCR
2.2 重组质粒pET-28(a)-JEV NS3的构建
JEV NS3基因的PCR产物、pET-28(a)空载体分别用EcoRⅠ、SalⅠ酶进行双酶切,酶切产物经T4连接酶连接,连接产物转化大肠埃希菌DH5α后,经菌落PCR鉴定为阳性的克隆,扩大培养后提取质粒,质粒再进一步用EcoRⅠ、SalⅠ酶进行双酶切鉴定(图2),结果为阳性的克隆送生物公司测序,测序结果经NCBI上Blast比对表明,本研究克隆到了JEV NS3基因,该片段与NCBI上公布的序列(GenBank No:AF069076)同源性高达97%。
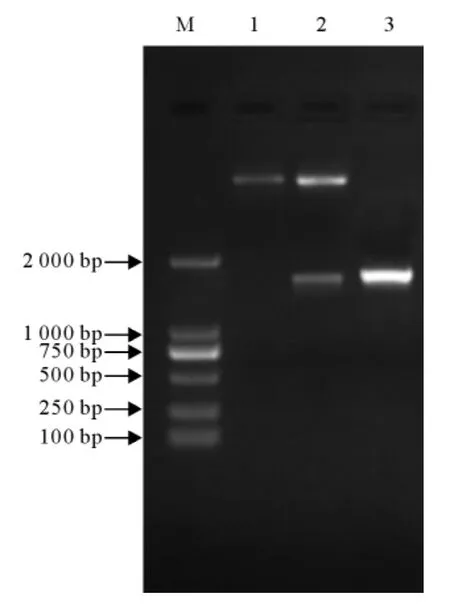
图2 pET-28(a)-JEV-NS3重组质粒的酶切鉴定Fig.2 Identification of recombinant plasmid pET-28(a)-JEV NS3by restrict enzyme digestion
2.3 重组JEV-NS3蛋白的诱导表达
上述鉴定好的阳性pET-28(a)-JEV NS3质粒转化大肠埃希菌BL21(DE3),挑取克隆扩大培养3h后,1mmol/L IPTG诱导3h,分别在诱导前和诱导后取样,煮沸裂解细菌,SDS-PAGE电泳检测重组蛋白表达情况。结果表明重组蛋白JEV NS3在大肠埃希菌内大量表达(图3),分子质量为64ku,与预期大小一致。薄层扫描分析表明,表达的重组蛋白占总菌体蛋白的30%以上。
2.4 重组JEV NS3蛋白的包涵体提取和纯化
为了获得高纯度的重组JEV NS3蛋白,把上述鉴定能表达重组蛋白的克隆扩大培养到100mL,收集菌体后,利用溶菌酶裂解和超声破碎菌体,高速离心收集沉淀,沉淀用脱氧胆酸钠处理后,变性剂十二烷基肌氨酸钠溶解包涵体,然后利用还原型和氧化型谷胱甘肽复性重组蛋白,透析除去变性剂后,PEG浓缩蛋白。在每一个步骤取样,SDS-PAGE检测纯化效果。结果表明,重组蛋白主要在包涵体中,上清中没有表达,纯化后检测发现该方法获得较好的纯化效果,薄层扫描分析表明,纯化后重组蛋白占总蛋白的70%以上(图4)。
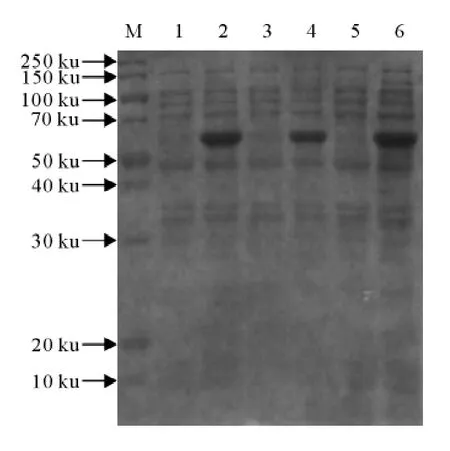
图3 重组JEV NS3蛋白的诱导表达Fig.3 Expression of recombinant protein JEV NS3by IPTG induction
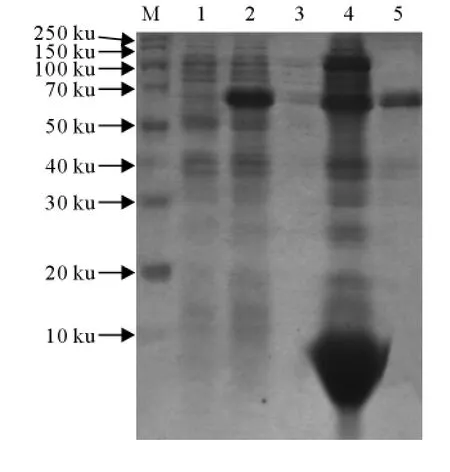
图4 重组JEV NS3蛋白包涵体的提取和纯化效果检测Fig.4 Extraction and purification of recombinant protein JEV NS3inclusion body
3 讨论
猪是JEV的天然宿主之一,病毒能在猪群中大量繁殖,经蚊虫再传播给人,所以控制该病在猪群中的发生具有重要的公共卫生学意义。除此之外,JEV引起的母猪繁殖障碍给养猪业也带来了重大危害,监测该病的流行情况,控制其在猪群中的扩散,研发抗病毒药物等措施都有利于该病的防控。
NS3蛋白在病毒RNA的复制和病毒包装等方面具有十分重要的功能,同时NS3蛋白在诱导宿主免疫应答和致病性方面也具有重要作用。它是诱导细胞免疫应答的主要抗原之一[12],同时也能激活胞内凋亡相关蛋白活性,诱导肿瘤细胞发生凋亡[13]。本研究克隆了从猪群中分离的神经毒JEV病毒株的NS3基因,该序列与NCBI上公布序列同源性97%以上,在原核表达系统中大量表达重组蛋白JEV NS3,表达量达到菌体总蛋白的30%以上,纯化后重组蛋白能占到总蛋白的70%以上。本研究利用前人的方法[11]获得较纯的NS3重组蛋白,为制备该蛋白的抗体,研究其病毒诱导的细胞免疫中作用和探讨其在病毒致病中的机理奠定了较好的基础。
[1]殷 震,刘景华.动物病毒学[M].2版.北京:科学技术出版社,1997:633-641.
[2]陈焕春.规模化养猪场疫病控制与净化[M].北京:中国农业出版社,2000:187.
[3]Mason P W,Dalrymple J M,Gentry M K,et al.Molecular characterization of a neutralizing domainof the Japanese encephalitis virus structural glycoprotein[J].J Gen Virol,1989,70:2037-2049.
[4]Mohammed M A,Galbraith S E,Radford A D,et al.Molecular phylogenetic and evolutionary analyses of Muar strain of Japanese encephalitis virus reveal it is the missing fifth genotype[J].Infect Genet Evol,2011,11(5):855-862.
[5]Yamashita T,Unno H,Mori Y,et al.Crystal structure of the catalytic domain of Japanese encephalitis virus NS3helicase/nucleoside triphosphatase at aresolution of 1.8A[J].Virology,2008,373:426-436.
[6]Yamshchikov V F,Trent D W,Compans R W,et al.Upreg-ulation of signalase processing and induction ofprM-E secretion by the flavivirus NS2B-NS3protease:roles of protease components[J].J Virol,1997,71(6):4364-4371.
[7]Liu W J,Sedlak P L,Kondratieva N,et al.Complementation analysis of the flavivirusKunjin NS3and NS5proteinsdefines the minimal regions essential for formation of a replicationcomplex and shows a requirement of NS3in cis for virus assembly[J].J Virol,2002,76:10766-10775.
[8]Chiou C T,Hu C C,Chen P H,et al.Association of Japanese encephalitis virus NS3protein with microtubules and tumoursusceptibility gene 101 (TSG101)protein[J].J Gen Virol,2003,84:2795-2805.
[9]Kaczor A,Matosiuk D.Structure-based virtual screening for novelinhibitors of Japanese encephalitis virus NS3helicase/nucleosidetriphosphatase[J].FEMS Immunol Med Microbiol,2010,58:91-101.
[10]Chen C J.RNA-protein interactions:involvement of NS3,NS5,and 3'noncoding regions of Japanese encephalitis virus genomic RNA[J].J Virol,1997,71(5):3466-3473.
[11]王晓杜.猪干扰素α、β、γ基因原核表达及单克隆抗体制备[D].湖北武汉:华中农业大学,2007.
[12]Kumar P,Sulochana P,Nirmala G,et al.Conserved amino acids 193-324of non-structural protein 3are adominant source of peptide determinants for CD4+and CD8+T cells ina healthy Japanese encephalitis virus-endemic cohort[J].J Gen Virol,2004,85:1131-1143.
[13]Yang T C,Shiu S L,Chuang P H,et al.Japaneseencephalitis virus NS2B-NS3protease induces caspase 3activation andmitochondria-mediated apoptosis in human medulloblastoma cells[J].Virus Res,2009,143:77-85.

